Вопросы к экзамену по химии Предмет и задачи химии. Химия и окружающая среда. Значение химии для инженеров вашей специальности
 Скачать 2.48 Mb. Скачать 2.48 Mb.
|
|
Окислительно-восстановительные реакции – это реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим, другими словами – это реакции, в результате которых изменяются степени окисления элементов. Степень окисления – это заряд атома элемента в соединении, вычисленный из условного предположения, что все связи в молекуле являются ионными. Степень окисления принято указывать арабской цифрой над символом элемента со знаком плюс или минус перед цифрой. Например, если связь в молекуле HCl ионная, то водород и хлор ионы с зарядами (+1) и (–1), следовательно Для того чтобы рассчитать степень окисления любого элемента, необходимо пользоваться следующими правилами: + Степень окисления атомов в простых веществах равна нулю: Степень окисления (+1) во всех соединениях имеют щелочные металлы (IA группа) и водород, за исключением гидридов активных металлов, где степень окисления водорода равна (–1), например Степень окисления +2 во всех соединениях имеют щелочноземельные металлы (II A группа). Кислород имеет степень окисления (–2), во всех соединениях, кроме пероксидов ( Алгебраическая сумма степеней окисления всех частиц в молекуле равна нулю, а в ионе – заряду иона Степень окисления иона элемента равна заряду иона: Не следует путать понятия «валентность» и «степень окисления». Так в N2, NH3, N2H4, NH2OH валентность (ковалентность) азота равна трем, так как азот образует три ковалентные связи, а степень окисления различна: Окислением называется отдача электронов, в результате чего степень окисления элемента повышается. Восстановлением называется присоединение электронов, в результате чего степень окисления элемента понижается. 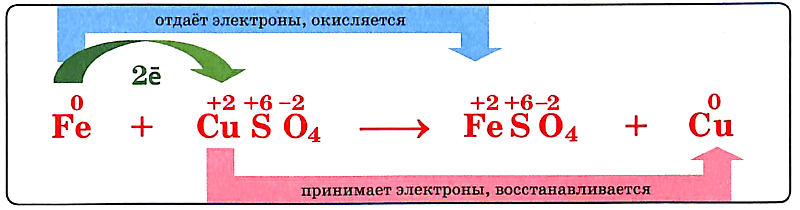 +Окислительные и восстановительные процессы тесно связаны между собой, так как химическая система только тогда может отдавать электроны, когда другая система их присоединяет (окислительно-восстановительная система). Присоединяющая электроны система (окислитель) сама восстанавливается (превращается в соответствующий восстановитель), а отдающая электроны система (восстановитель), сама окисляется (превращается в соответствующий окислитель). 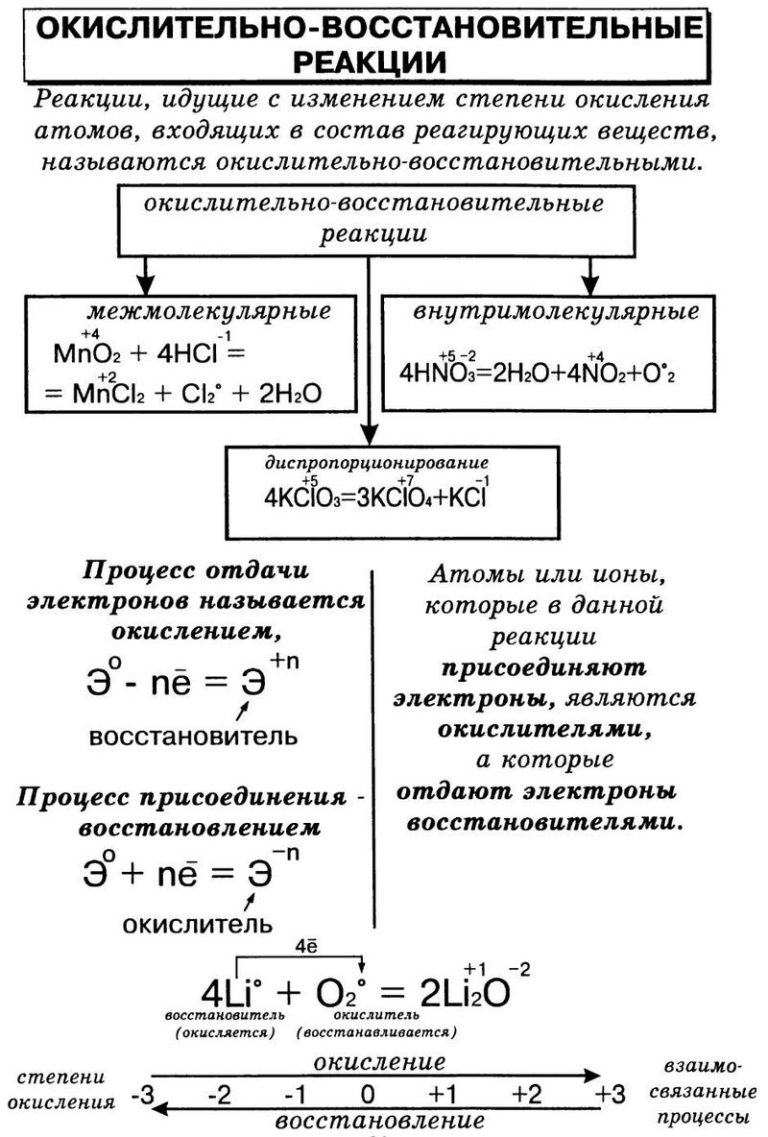 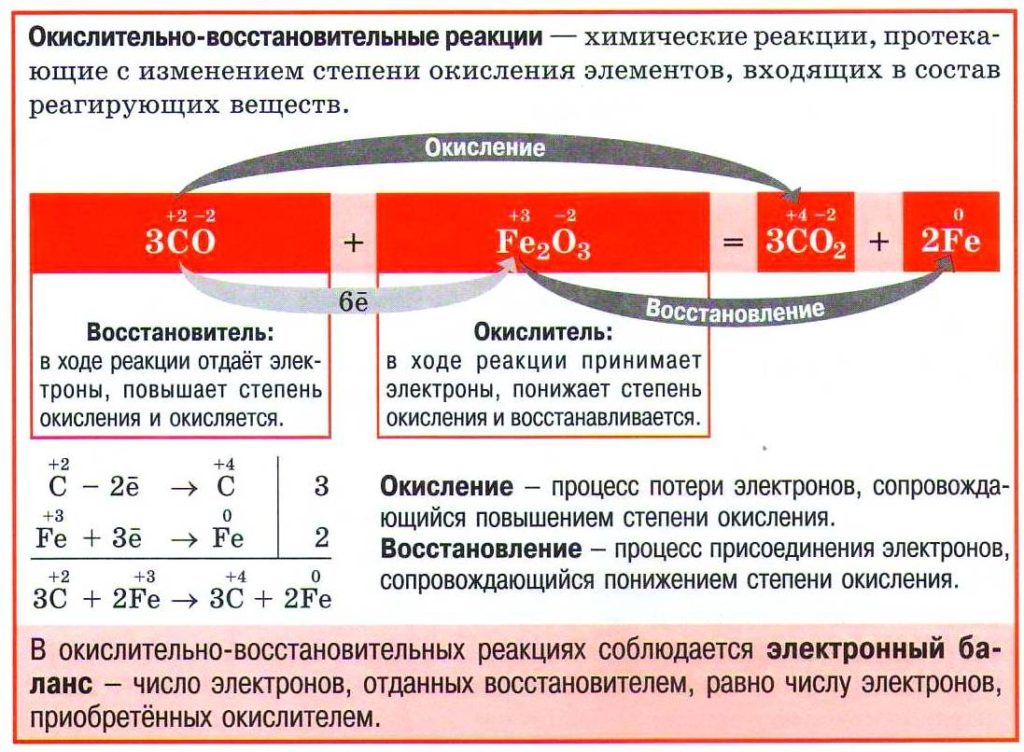 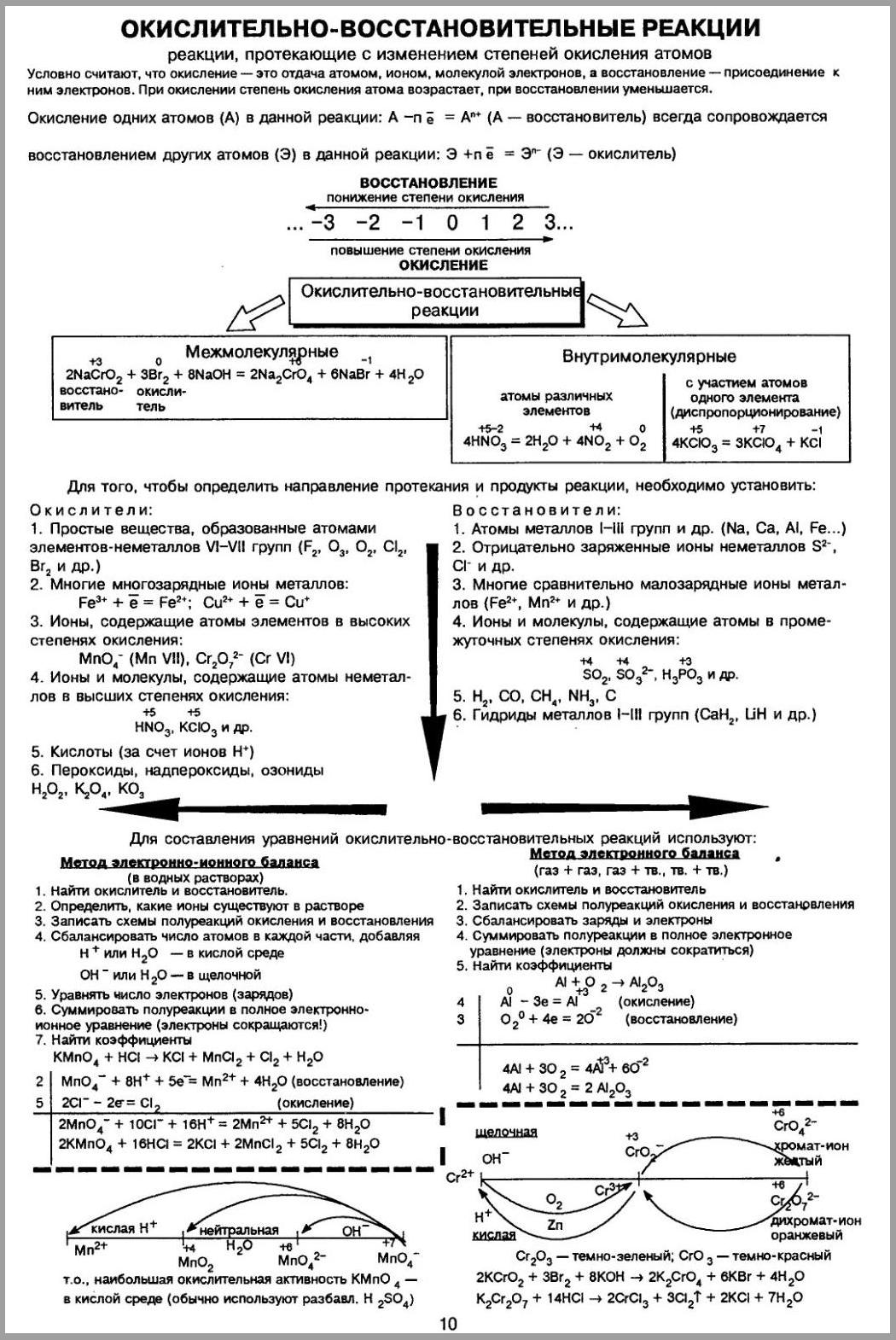 43. Ряд напряжений металлов, закономерности ряда. Гальванические элементы : Вольта и Даниэля-Якоби, ЭДС. Ряд напряжений металлов-это ряд металлов расположенных по возрастанию их стандартного электродного потенциала (). Положение металла в ряду напряжений свидетельствует о его окислительно-восстановительных способностях по отношению к другим металлам и их катионам для реакций, протекающих в растворах электролитах, т. е. в реакциях с солями и основаниями.элементы: Вольта и Даниэля-Якоби, ЭДС. Количественная характеристика, равная разности двух электродных потенциалов получила название электродвижущей силой (ЭДС) Е= φ1 – φ2 Для электродного потенциала количественная характеристика выражается уравнением Нернста. Е = Е0 + RT/nF · In aM +где Е0 -электродный потенциал при активности ионов в растворе = 1 и называется стандартным или нормальным потенциалом.  Гальванический элемент Даниэля – Якоби состоит из медной пластины, погружённой в раствор CuSO4, и цинковой пластины, погружённой в раствор ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие Zn ↔ Zn2+ + 2e¯. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие Cu ↔ Cu2+ + 2e¯ поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдёт дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдёт разряд ионов меди. При работе гальванического элемента Даниэля – Якоби протекают след. процессы: 1. реакция окисления цинка Zn – 2e → Zn2+. Процессы окисления в химии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами; 2. реакция восстановления ионов меди Cu2+ + 2e → Cu. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами; 3. движение электронов во внешней цепи; 4. движение ионов в растворе: анионов (SO42-) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем +Zn + Cu2+ = Cu + Zn2+. Вследствие этой хим. реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому суммарная хим. реакция, протекающая в гальваническом элементе, называется токообразующей. 44. Тяжелые конструкционные металлы: медь, цинк. Распространенность, получение, строение атома, свойства, применение. 45. Электролиз растворов, последовательность разрядки катионов и анионов. Электролизом называются окислительно-восстановительные реакции, протекающие на электродах при пропускании постоянного электрического тока от внешнего источника через раствор или расплав электролита.   |
