1. 1 Предмет химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
  Адсорбционные равновесия на неподвижных границах раздела фаз Физическая адсорбция и хемосорбция Причиной адсорбции на поверхности твердых тел является нескомпенсированность силовых полей молекул, находящихся в зонах деформации поверхности. Такие зоны называются активными центрами. Физическая адсорбция обусловлена межмолекулярным взаимодействием (ван-дер-ваальсовы взаимодействия, водородная связь) и проходит на активных центрах во впадинах микрорельефа. Физическая адсорбция обратима Ноб – 4 до 40 кДж/моль. Центры хемосорбции, находятся на выступах микрорельефа. При хемосорбции устанавливаются химические связи между атомами адсорбента и адсорбтива. Химическая адсорбция необратима Ноб – 40 до 400 кДж/моль. Хемосорбция часто протекает только на поверхности сорбента. Например, при поглощении кислорода алюминием, на поверхности металла образуется тонкая пленка оксида. Адсорбция газов на твердых телах Адсорбция газов на твердых телах зависит от температуры, давления и природы адсорбата; удельной поверхности и природы адсорбента. На поверхности твердого тела лучше адсорбируются те газы, которые легче конденсируются в жидкость. Активированный уголь хорошо адсорбирует: Cl2, NH3, не адсорбирует: CO, N2, H2. Адсорбция зависит от давления – с ростом давления адсорбция возрастает. С ростом температуры адсорбция газов твердыми телами уменьшается. Адсорбция возрастает с увеличением удельной поверхности. Адсорбция из растворов Адсорбция растворенных веществ твердыми адсорбентами является более сложным процессом, т.к. она осложнена рядом факторов: 1. присутствием третьего компонента – растворителя; 2. взаимодействием между молекулами адсорбата и растворителя; 3. электрохимическим взаимодействием между поверхностью адсорбента и ионами адсорбата, если он является электролитом. Адсорбция из растворов изучена русским химиком и фармацевтом Т.Е. Ловицем. Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией. страница 89-91 9. 2. ПОВЕРХНОСТНАЯ ЭНЕРГИЯ ГИББСА И ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ. К поверхностным явлениям относят процессы, протекающие на границе раздела фаз и обусловленные особенностями состава и структуры поверхностей. Все возможные поверхности раздела в зависимости от агрегатного состояния граничащих фаз делят на подвижные поверхности раздела между ж-г, двумя несмешивающимися жидкостями, ж-ж и неподвижные поверхности раздела т-г, т-ж, т-т. 86 Рассмотрим системы с подвижной поверхностью раздела фаз, например, система ж-г (рис. 12.1.) Поверхностный слой резко отличается по своим свойствам от свойств фаз, которые он разделяет. Молекулы, атомы, ионы, находящиеся на границе раздела фаз, не равноценны тем же частицам, находящимся в объеме фазы. Силы, действующие на молекулы, находящиеся внутри жидкости, одинаковы со всех сторон, а их равнодействующая F равна нулю (F=0). Силы, действующие на молекулы поверхностного слоя границы раздела жидкости с ее паром, не одинаковы, так как молекулярные взаимодействия сверху отсутствуют, равнодействующая сила F не равна нулю (F≠0) и направлена внутрь жидкой фазы. Для выхода молекул на поверхность требуется выполнить дополнительную работу Ws против этой силы. В итоге формируется поверхностный слой с избыточной (свободной) поверхностной энергией – энергией Гиббса. Свободной поверхностной энергией (энергией Гиббса) называется термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз. Свободная поверхностная энергия прямо пропорциональна площади раздела фаз и удельной энергии межфазного взаимодействия: Gs = s, где - удельная свободная поверхностная энергия (коэффициент пропорциональности, поверхностное натяжение, кДж/м2 ) s – площадь поверхности раздела фаз, м2. - зависит от природы контактирующих фаз, давления и температуры (с повышением температуры снижается, при критической температуре, когда исчезает различие между газом, паром и жидкостью = 0, с ростом давления ж-г уменьшается). Поверхностное натяжение биологических жидкостей используют в диагностических целях. Так, поверхностное натяжение плазмы крови варьирует в зависимости от заболевания (травма, шок, рана и др.). С возрастом поверхностное натяжение сыворотки крови уменьшается. Поверхностное натяжение играет значительную роль в таких явлениях как деление клеток, движение бактерий, фагоцитоз и др. Существует много несложных методов измерения поверхностного натяжения, которые используются в медикобиологической практике. Любая система в соответствии со вторым началом термодинамики стремится самопроизвольно перейти в такое состояние, в котором она обладает 87 максимальным запасом энергии Гиббса G. Следовательно, она стремится к минимальной поверхностной энергии Гиббса (Gsmin). Это возможно при снижении коэффициента поверхностного натяжения (сорбция, смачивание, эмульсирование), при уменьшении площади раздела фаз S 0 (слияние капель – коалесценция, коагуляция – слипание частиц). Например, раствор как двух- (или более) компонентная система может понизить запас поверхностной энергии Гиббса концентрированием на границе раздела фаз компонента с меньшим поверхностным натяжением. страница 85-87 9.3 Адсорбция. Капилярная конденсация. Уравнение Гиббса Самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз называется адсорбцией. Адсорбция – поглощение вещества всей массой адсорбента. Капиллярная конденсация – переход поглощаемого газа или пара в жидкое состояние в узких парах адсорбента. Поглотитель называется адсорбентом, а поглощаемое вещество – адсорбтивом или адсорбатом. Величину адсорбции (Г, моль/см2 ) можно определить по уравнению Гиббса:
где Ср – равновесная концентрация вещества, моль/л Т – абсолютная температура, К С/ - поверхностная активность, Дж/м2 R – универсальная газовая постоянная, 8,31. 103 Дж/К.моль. град 9.4 . Изотерма адсорбции. 1 – адсорбция пропорциональна концентрации; 2 – с ростом концентрации адсорбция замедляется; 3 – при больших концентрациях адсорбция достигает предельного значения 9.5 Поверхностно активные и поверхностно не активные вещества ПАВ обладают положительной адсорбцией, их молекулы дифильны, т.е. содержат полярные группы (-OH, -COOH, -NH2, -SO3H и др.) и неполярную углеводородную цепь. Чем длиннее углеводородная цепь, тем эффективнее снижается поверхностное натяжение водного раствора с ростом концентрации ПАВ (короткая цепь – гидрофильные свойства, длинная цепь – гидрофобные) 9.6 Изменение поверхностной активности в гомологических рядах (правило Траубе). правилом Дюкло-Траубе. Поверхностная активность ПАВ в разбавленных водных растворах при одинаковой молярной концентрации увеличивается в 3 – 3,5 раза с увеличением углеводородной цепи на группу – СН2 (жирные кислоты, спирты, амины). 9.7 Ориентация молекул в поверхностном слое и структура биомембран. Основным а. б. 90 элементом мембранных структур клетки является биномолекулярный слой из молекул липидов, полярные группировки которых направлены наружу, а неполярные углеводородные радикалы – внутрь. Полярные группы взаимодействуют с белками. Белки образуют симметричные мономолекулярные слои на внешней и внутренней стороне липидного бислоя. Позднее было установлено ассиметричное распределение белков в клеточных мембранах. Среди мембранных белков имеются такие, которые способны взаимодействовать с гидрофобными радикалами и проникать вглубь мембраны, образуя поры – ионные каналы, обладающие избирательной проницаемостью 9.8. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Причиной адсорбции на поверхности твердых тел является нескомпенсированность силовых полей молекул, находящихся в зонах деформации поверхности. Такие зоны называются активными центрами. Физическая адсорбция обусловлена межмолекулярным взаимодействием (ван-дер-ваальсовы взаимодействия, водородная связь) и проходит на активных центрах во впадинах микрорельефа. Физическая адсорбция обратима ΔНоб– 4 до 40 кДж/моль. Центры хемосорбции, находятся на выступах микрорельефа. При хемосорбции устанавливаются химические связи между атомами адсорбента и адсорбтива. Химическая адсорбция необратима Ноб – 40 до 400 кДж/моль. Хемосорбция часто протекает только на поверхности сорбента. Например, при поглощении кислорода алюминием, на поверхности металла образуется тонкая пленка оксида. 9.10. Адсорбция газов на твердых телах. Зависимость величины адсорбции от разных факторов. Адсорбция газов на твердых телах зависит от температуры, давления и природы адсорбата; удельной поверхности и природы адсорбента. На поверхности твердого тела лучше адсорбируются те газы, которые легче конденсируются в жидкость. Активированный уголь хорошо адсорбирует: Cl2, NH3, не адсорбирует: CO, N2, H2. 91 Адсорбция зависит от давления – с ростом давления адсорбция возрастает. С ростом температуры адсорбция газов твердыми телами уменьшается. Адсорбция возрастает с увеличением удельной поверхности. 9.12. Адсорбция из растворов. Молекулярная адсорбция. Адсорбция растворенных веществ твердыми адсорбентами является более сложным процессом, т.к. она осложнена рядом факторов: 1. присутствием третьего компонента – растворителя; 2. взаимодействием между молекулами адсорбата и растворителя; 3. электрохимическим взаимодействием между поверхностью адсорбента и ионами адсорбата, если он является электролитом. Адсорбция из растворов изучена русским химиком и фармацевтом Т.Е. Ловицем. Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией. В результате адсорбции концентрация растворенного вещества в растворе уменьшается. Адсорбцию определяют по разности концентраций исходного и равновесного растворов адсорбата: Г = ((Со -С)*V)/m, где Со – исходная концентрация адсорбата (моль/л) С – равновесная концентрация адсорбата (моль/л) V – объем раствора, из которого происходит адсорбция, л m – масса адсорбента, кг Г – адсорбция, моль/кг Адсорбция т-ж зависит от природы и концентрации адсорбента, температуры, природы адсорбента и растворителя, удельной поверхности адсорбента. 9.13. Гемосорбция (гемоперфузия). Механизм молекулярной адсорбции лежит в основе одного из самых современных методов лечения - гемосорбции, т. е. очистке крови от токсичных веществ с помощью различных адсорбентов. В медицине этот метод называют гемоперфузией и применяют при почечной, печеночной недостаточности, при отравлении снотворными, фосфорорганическими соединениями, ожоговой болезни, обморожениях. В качестве адсорбентов применяют активированный уголь, реже иониты, когда нужно вывести ионы из организма, иногда применяют энтеросорбенты. 9.14. Правило выравнивания полярностей Избирательная адсорбция (правило Фаянса) Отечественный физико – химик П.А. Ребиндер сформулировал правило выравнивания полярностей: на полярных адсорбентах лучше адсорбируются полярные адсорбаты из монополярных растворителей; на неполярных адсорбентах – неполярные адсорбаты из полярных растворителей. Влияние природы растворителя на адсорбцию может быть так же сформулировано в виде правила: Чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже адсорбируется и наоборот. Избирательная адсорбция (характерна для растворов сильных электролитов) Адсорбция подчиняется правилу, установленному американским физикохимиком К. Фаянсом. На поверхности данного адсорбента преимущественно адсорбируются те ионы, которые могут достраивать кристаллическую решетку этого адсорбента (или родственные ему). Рассмотрим образование осадка хлорида серебра по реакции: KCl + AgNO3 = AgCl + KNO3 1) Если реагируют эквивалентные количества солей, поверхность осадка не заряжена. 2) При избытке KCl поверхность осадка заряжена отрицательно (адсорбируется Cl- ). 3) При избытке AgNO3 – положительно (адсорбируется Ag+ ). 9.15. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов. Значение адсорбционных процессов для жизнедеятельности: С явлениями адсорбции на клеточных мембранах из полярных биосред организма связано физиологическое действие многих лекарств (барбитураты, анастезирующие средства) и токсическое действие отравляющих веществ. Молекулярная адсорбция твердыми адсорбентами из растворов широко распространена в медицинской практике. При отравлении ядами, токсинами, барбитуратами применяют активированный уголь для их удаления из пищевого тракта. В настоящее время осуществляют сорбционную детоксикацию крови и лимфы больного пропусканием через активированный уголь, что позволяет удалить из организма токсичные органические жидкости (дихлорэтан, фосфорорганические соединения). Адсорбция используется для очистки питьевой воды и сточных вод. Известны адсорбенты, твердые природные и синтетические вещества, нерастворимые в воде и органических растворителях, способные к обмену ионами – иониты. Их используют для очистки воды, в ионнообменнойхроматоографии, для выделения и очистки аминокислот. Их применяют для консервирования крови, для беззондового определения кислотности желудочного сока, для детоксикации при отравлении токсичными электролитами, применяют для лечения отеков (катиониты), связанных с декомпенсацией сердечной деятельности и т.д. Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов. Механизм молекулярной адсорбции лежит в основе одного из самых современных методов лечения - гемосорбции, т. е. очистке крови от токсичных веществ с помощью различных адсорбентов. В медицине этот метод называют гемоперфузиейи применяют при почечной, печеночной недостаточности, при отравлении снотворными, фосфорорганическими соединениями, ожоговой болезни, обморожениях. В качестве адсорбентов применяют активированный уголь, реже иониты, когда нужно вывести ионы из организма, иногда применяют энтеросорбенты. 10.1. Дисперсные системы. Классификация дисперсных систем (по степени дисперсности, по агрегатному состоянию фаз, по межфазному взаимодействию, по структуре). ДИСПЕРСНЫЕ СИСТЕМЫ Дисперсные системы – многофазные системы, в которых раздробленное вещество называется дисперсной фазой, а непрерывная среда – дисперсионной средой. Классификация дисперсных систем: По агрегатному состоянию дисперсной фазы и дисперсионной среды известны 8 систем (встречаются более сложные, многокомпонентные системы) 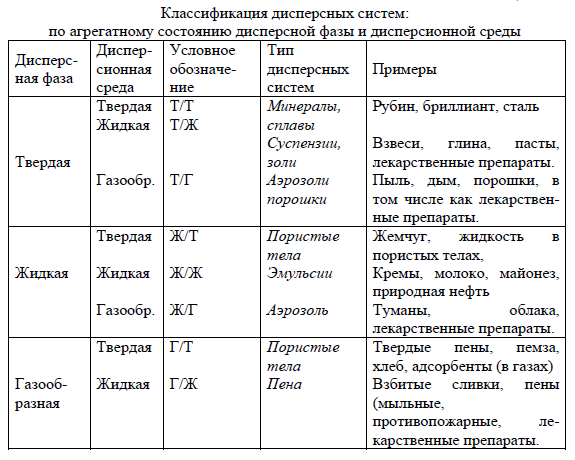 2) По степени дисперсности (по размеру частиц дисперсной фазы). - грубодисперсные с размером частиц более 10-7 м – суспензии, эмульсии, порошки, пены; это гетерогенные системы, неустойчивы. - высокодисперсные или коллоидные системы с размером частиц от 10-7 – 10-9 м 3) По межфазному взаимодействию В зависимости от интенсивности взаимодействия дисперсной фазы и дисперсионной среды различают системы: - лиофильные – сильное взаимодействие дисперсной фазы и дисперсионной среды (дисперсная фаза хорошо смачивается, набухает или растворяется). Пример лиофильных систем – растворы мыл (натриевые и калиевые соли высших карбоновых кислот), алкалоидов (азотсодержащие органические основания природного происхождения), некоторых красителей. Образуются самопроизвольно и являются обратимыми. - лиофобные – слабое взаимодействие дисперсной фазы и дисперсионной среды (дисперсные частицы плохо смачиваются, не набухают и не растворяются). Лиофобные - коллоиды малорастворимых веществ: металлов, гидроксида железа (III), в биологических системах – нерастворимые соли кальция, магния,холестерин. Лиофобные золи могут существовать длительное время только в присутствии стабилизаторов и являются необратимыми. Если дисперсионной системой является вода, то соответствующие системы называются гидрофильными или гидрофобными. 4) По структуре: - свободнодисперсные – частицы дисперсной фазы не связаны между собой – суспензии, эмульсии, золи, аэрозоли, лекарственные пасты (цинковая паста); - связаннодисперсные– частицы дисперсной фазы образуют пространственную сетку и фаза не может свободно перемещаться – гели и студни (ВМС), пены, биологические мембраны, твердые растворы (сплавы), пористые тела. 10.2. Методы получения коллоидных систем. Методы получения коллоидных систем Так как размеры коллоидных частиц занимают промежуточное положение между размерами грубодисперсных частиц и размерами частиц в истинных растворах, возможны два противоположных метода их получения: диспергированиемакроскопических фаз и конденсация из истинных растворов. Метод диспергирования (лат. dispergire – измельчать). а) механическое дробление – измельчение твердого вещества в ступке или при помощи коллоидной мельницы в присутствии стабилизатора. На коллоидных мельницах диспергируют некоторые фармацевтические вещества, сухие краски, крахмал, пряности, какао, химические препараты и т.п. б) действие ультразвука, в) электрическое распыление в вольтовой дуге (синтез фуллерена в присутствии лекарственных веществ – получается золь фуллерена, полости которого заполнены лекарственными препаратами) г) эмульгирование жиров в кишечнике (эмульгаторы и стабилизаторы - соли желчных кислот) д) пептизация – раздробление химическим способом. Это метод получения золей из студней или рыхлых осадков при действии на них некоторых веществ, способных хорошо адсорбироваться на поверхности коллоидных частиц и таким путем сообщать им способность перехода в золь. При пептизации происходит не изменение степени дисперсности частиц, образующих студень или осадок, а только их разъединение. В организме подобный процесс происходит при рассасывание атеросклеротических бляшек, почечных и печеночных камней. Метод конденсирования(лат. condencire – укрупнять). Соединение (конденсация) атомов и молекул под действием остаточных Ван-дер-ваальсовых сил притяжения в агрегаты коллоидного размера. а) химические реакции, сопровождающиеся образованием труднорастворимых веществ: - окислительно-восстановительные реакции: Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S По этой реакции образующиеся атомы серы в зависимости от условий могут конденсироваться до размеров коллоидных частиц; - реакции обмена: AgNO3 + KI = KNO3 + AgI В приведённой реакции дисперсная фаза образуется из частиц AgI; - реакции гидролиза: при вливании небольшого количества раствора FeCl3 в кипящую воду соль гидролизуется. Гидролиз, проходя две ступени, может достичь третьей с получением нерастворимого гидроксида железа (III), который и образует золь: 1-ая ступень FeCl3 + H2O ↔ FeOHCl2 + HCl 2-ая ступень FeOHCl2 + H2O ↔ Fe(OH)2Cl + HCl 3-я ступень Fe(OH)2Cl + H2O ↔ Fe(OH)3 + HCl б) физические: - замена растворителя – такое изменение среды, при котором вещество из ра-створимого становится нерастворимым или малорастворимым. Сера, канифоль или прополис растворяются в этиловом спирте, образуя истинный раствор. В воде они практически нерастворимы, поэтому при добавлении воды к их спиртовому раствору молекулы конденсируются в более крупные агрегаты. 97 - собственно конденсация молекул испаряющегося вещества, соединяющихся в мелкие частицы. Образование тумана в природе при резком охлаждении воздуха и конденсации водяных паров. 10.3. Методы очистки коллоидных систем (диализ, электродиализ, ультрофильтрация). Физико-химические принципы функционирования искусственной почки. Методы очистки коллоидных систем При любом способе получения коллоидные растворы оказываются загрязненными примесями истинно растворенных веществ (примеси в исходных материалах, избыток стабилизаторов, продукты химической конденсации). Примеси электролитов сильно понижают устойчивость золей. Поэтому после получения золи очищают. Очистка производится методами диализа, электродиализа, ультрафильтрации. Указанные методы основаны на применении полупроницаемых мембран, легко пропускающих молекулы и ионы и задерживающих коллоидные частицы. диализ(греч. dialysis - отделение) – удаление примесей низкомолекулярных веществ и ионов с помощью мембран. Электродиализ — процесс изменения концентрации электролита в растворе под действием электрического тока (Электродиализ применяют для опреснения воды, выделения солей из растворов) ультрафильтрация(лат. ultra – сверх) – фильтрование коллоидов под давлением или разряжением (вакуумом) через плотные фильтры, пропускающие только низкомолекулярные вещества. Так были впервые определены размеры вирусов и бактериофагов. Функционирование почек основано на ультрафильтрации. Физико-химические принципы функционирования искусственной почки. Аппарат «Искусственная почка» (АИП) используют при острой почечной недостаточности. Кровь под давлением, создаваемым пульсирующим насосом («искусственное сердце») протекает через систему, снабженную мембранами с избирательной проницаемостью, которые омываются диализным раствором. Благодаря большой поверхности мембран (≈1,5 м2) сравнительно быстро (3-4 часа) из крови удаляются продукты обмена и распада тканей, ядовитые вещества. Образование и строение коллоидных частиц. Коллоидная частица представляет собой образование со сложной структурой – мицеллу (лат. micelle – крошка, крупинка). Мицелла состоит из электронейтрального агрегата (ядра) и ионогенной части. |
