1. 1 Предмет химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
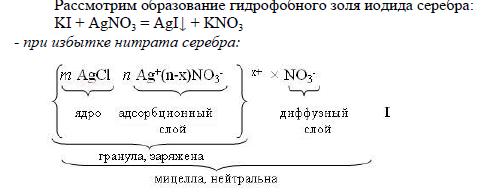 10.4. Молекулярно-кинетические свойства коллоидных растворов: броуновское движение, диффузия, осмотическое давление, седиментационное равновесие. 1) Молекулярно-кинетические свойства коллоидных систем (связаны с движением частиц). а) Свойства, связанные с тепловым движением частиц – броуновское движение, диффузия, осмотическое давление, температуры замерзания, кипения и др. – у коллоидных растворов выражены слабее, чем у истинных растворов. Это связано с большими размерами коллоидных частиц. Броуновское движение— это непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров, не затухающее во времени. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды. Результат броуновского движения – диффузия. Диффузиейназывается самопроизвольный процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. Процесс диффузии является необратимым, он протекает до полного выравнивания концентраций, так как хаотическое распределение частиц отвечает максимальной энтропии системы. Осмос - односторонняя диффузия молекул растворителя в коллоидный раствор через полупроницаемую мембрану. Подобно броуновскому движению и диффузии, осмос является процессом самопроизвольным. Переход растворителя в коллоидный раствор будет происходить до тех пор, пока постоянно возрастающее гидростатическое давление раствора не воспрепятствует ему. Это давление называется осмотическим давлением. б) Седиментация – оседание коллоидных частиц под действием силы тяжести. Этому противодействует диффузия. Со временем устанавливается седиментационное равновесие, при котором концентрация дисперсной фазы равномерно понижается от нижних слоев к верхним и остается постоянным во времени. Седиментационное равновесие используется в диагностике, например, определение СОЭ – скорости оседания эритроцитов. СОЭ изменяется при различных заболеваниях. При воспалительных процессах СОЭ увеличивается, т.к. при воспалении уменьшается вязкость крови. Седиментация возможна под действием центробежных (центрифугирование) и электрических сил. 10.5 Оптические свойства: рассеивание света. Путь светового луча, проходящего через прозрачный коллоидный раствор, на темном поле, становится видимым – наблюдается конус Тиндаля (эффект Тиндаля) .Это явление похоже на рассеяние света запыленным воздухом. При пропускании света через истинные растворы конус Тиндаля не наблюдается – они прозрачные.Использование оптических свойств коллоидных систем: нефелометрия - измерение концентрации по рассеянию света опалесцирующими растворами, турбодиметрия - измерение концентрации по мутности, т.е. кажущейся 101 оптической плотности, ультрамикроскопия – изучение концентрации, формы и размеров частиц. 10.6 Электрокинетические свойства коллоидных растворов: электрофорез и электроосмос. Электрокинетический потенциал и его зависимость от различных факторов. Электрофорез – движение заряженных частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля.С помощью электрофореза вводится обычно не более 10–20% содержащегося в растворе лекарственного вещества. Электроосмос – движение дисперсионной среды относительно дисперсной фазы под действием внешнего электрического поля. Электрокинетический потенциал- определяет возможность и скорость относительного перемещения дисперсной фазы и дисперсионной среды, интенсивность электрокинетических явлений, устойчивость золей. . На величину потенциала влияют: – температура;С повышением температуры растет величина - потенциала, так как увеличивается тепловое движение ионов и толщина ДЭС – добавки электролитов;Индифферентные электролиты снижают значение - потенциала в результате увеличения концентрации противоионов и сжатия ДЭС. Неиндифферентные электролиты наоборот – рН среды; – природа дисперсионной среды: потенциал дисперсной фазы тем меньше, чем меньше полярность среды 10.7. Устойчивость коллоидных систем. Факторы влияющие на устойчивость лиозолей. Коагуляция. Порог коагуляции. Явление привыкания. Взаимная коагуляция. Пептизация. Коллоидная защита. Устойчивость – способность системы сохранять свои свойства, дисперсионный состав, равномерное распределение частиц по объему. а) седиментационная(молекулярно-кинетическая) устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести. б) агрегативнаяустойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять свои размеры. Сохранение коллоидной степени дисперсности во времени объясняется наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание. У гидрофильных золей (большинство органических веществ) заряженное ядро дополнительно адсорбирует полярные молекулы воды. При этом повышается агрегативная устойчивость золя. Коагуляция- нарушение агрегативной устойчивости, процесс укрупнения частиц (лат. coagulatio – свертывание, сгущение). При этом происходит объединение коллоидных частиц. Две стадии коагуляции: Начальная стадия – скрытая коагуляция, она не сопровождается внешним изменением системы. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости. Вторая стадия - явная коагуляции (т.е. видимая внешне). Наблюдается изменение окраски, помутнение, агрегаты частиц всплывают или выпадают восадок, вследствие седиментации. Частицы становятся крупными и не участвуют в броуновском движении. Коагуляция может происходить самопроизвольно (старение), но чаще всего она вызвана внешними признаками: - повышение концентрации золя, - изменение температуры, - механическое воздействие, - облучение, - длительный диализ или ультрафильтрация, - действие электролитов, неэлектролитов, - смешение двух золей с различными знаками заряда - действие электрического или электромагнитного поля. Минимальная концентрация электролита, при которой наступает коагуляция называется порогом коагуляции, Сп . Cп(Х) – порог коагуляции, ммоль/л (миллимоль электролита на 1л золя). Сэл– исходная концентрация, моль/л; Vэл– наименьший объем раствора электролита, вызывающий коагуляцию, л; Vколл.р-ра– объем коллоидного раствора, л. «привыкание» золей- если добавлять электролит малыми порциями, коагуляция наступает позже, т.е. коагулирующая способность электролита зависит от способа его прибавления к золю. Взаимная коагуляция– образование осадка при смешении коллоидных растворов с разноименно заряженными частицами. Коагуляция возможна только в случае нейтрализации зарядов. Пептизация – превращение свежеосажденного осадка, образовавшегося в результате коагуляции, в устойчивый коллоидный раствор. Это процесс, обратный коагуляции Устойчивость коллоидной системы повышают введением в нее стабилизаторов– веществ, которые при адсорбции на поверхности коллоидных частиц, создают достаточно интенсивное взаимодействие между поверхностью частиц и окружающей их средой: - небольшой избыток одного из реагентов, - небольшое количество высокомолекулярных соединений (ВМС) или коллоидных поверхностно-активных веществ (ПАВ). - молекулы дисперсионной среды, образующие защитную оболочку вокруг частиц и препятствующие их слипанию и выпадению в осадок. Коллоидная защита играет большую роль в физиологических процессах. Белки крови препятствуют выпадению в осадок карбонатов и фосфатов кальция или холестерина. Высокое содержание в молоке фосфата кальция, обладающего незначительной растворимостью, объясняется тем, что в молоке эта соль содержится в виде гидрофобного коллоида, защищенного гидрофильными веществами молока. В некоторых случаях введение в коллоидную систему очень малых количеств ВМС приводит не к защите, а к снижению устойчивости. Сенсибилизацией называется снижение порога коагуляции золя при добавлении в него ВМС. 10.8. Липосомы. Липосомы– би- или многослойные структуры, содержащие внутри воду и другие вещества. Липосомы образуют многие природные молекулы, обладающие свойствами ПАВ, например, фосфолипиды. Липосомы по размерам и структуре подобны клеткам живых тканей, а бислойная липидная оболочка близка по структуре и свойствам к клеточным мембранам. Поэтому липосомы используют в качестве моделей при изучении клеточных мембран, для доставки лекарственных веществ к больным органам. Например, инсулин при лечении диабета, противоопухолевые препаратов при лечении рака, хелатные реагенты при лечении отравлений тяжелыми металлами. Липосомы используют в иммунологических исследованиях при изучении взаимодействия между антителами и антигенами. Липосомы образуются в системе «вода – фосфолипид» при встряхивании, интенсивном перемешивании. 11.1. Понятие биогенности химических элемнтов. Биосфера , круговорот биогенных элементов . Кларки элементов. Биогенными элементами называют элементы, необходимые для построения и жизнедеятельности различных клеток организма.Из 92 встречающихся в природе элементов 81 обнаружен в организме человека. При этом 15 из них признаны эссенциальными, т.е. жизненно необходимыми. Биосфера .Часть земной оболочки, занятая растительными и животнымиорганизмами.Главная функция биосферы заключается в обеспечении круговорота химических элементов, который выражается в циркуляции веществ между атмосферой, почвой, гидросферой, живыми организмами. Кларки элементов. Среднее содержание элементов в живых организмах, земной коре, атмосфере, гидросфере, в атмосфере Солнца и звезд выражается в кларках. Термин предложен А.Е. Ферсманом в 1923 г., в честь американского геохимика Ф.У. Кларка 11.2. Концентрирование биогенных элементов живыми системами . Классификация биогенных элементов по их функциональной роли: органогены, элементы электролитного фона, микроэлементы.Содержание некоторых элементов в организме по сравнению с окружающей средой повышенное – это называют биологическим концентрированием элемента. Например, углерода в земной коре 0,35%, а по содержанию в живых организмах занимает второе место (21%). Однако эта закономерность наблюдается не всегда. Классификация биогенных элементов по их функциональной роли: Органогены( C,H,O,N,P,S )главные химические элементы, входящие в состав органических веществ. Элементы электролитного фона( Na, К, Ca, Mg, Сl) ионы данных металлов составляют 99% общего содержания металлов в организме. Микроэлементы (I, Cu, F, Br, Ba, CoFe, Mn, Zn,Mo) входят в состав ферментов, витаминов, гормонов распределены между тканями. 11.3. Понятие о примесных элементах (аккумулирующихся и неаккумулирующихся). Основные источники поступления примесных элементов в организм человека. Примесные элементы Элементы, содержание которых меньше чем 10-5%, относят к ультрамикроэлементам. Данные о количестве и биологической роли многих элементов невыяснены до конца. Некоторые из них постоянно содержатся в организме животных и человека: Ga, Ti, F, Al, As, Cr, Ni, Se, Ge, Sn и другие. Биологическая роль их мало выяснена. Их относят к условно биогенным элементам. Другие примесные элементы (Те, Sc, In, W, Re и другие) обнаружены в организме человека и животных, и данные об их количестве и биологической роли не выяснены. Примесные элементы также делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F). Известны крылатые слова, сказанные в 40-х годах немецкими учеными Вальтером и Идой Ноддак: «В каждом булыжнике на мостовой присутствуют все элементы периодической системы». Если согласиться, что в каждом булыжнике содержатся все элементы, то тем более это должно быть справедливо для живого организма. Имеется большое число химических элементов, особенно среди тяжелых, являющихся ядами для живых организмов, – они оказывают неблагоприятное биологическое воздействие. В табл. 3 приведены эти элементы в соответствии с Периодической системой Д.И. Менделеева. За исключением бериллия и бария, эти элементы образуют прочные сульфидные соединения. Существует мнение, что причина действия ядов связана с блокированием определенных функциональных групп (в частности, сульфгидрильных) протеина или же с вытеснением из некоторых ферментов ионов металлов, например меди и цинка. Такие элементы, как бериллий, никель, палладий, серебро, кадмий, мышьяк, селен, сурьма, теллур, платина, золото, барий, таллий, свинец, висмут, ртуть называют примесными. Их диаграмма доза – эффект имеет другую форму по сравнению с жизненно необходимыми (рис. 2). До определенного содержания этих элементов организм не испытывает вредного воздействия, но при значительном увеличении концентрации они становятся ядовитыми. Встречаются элементы, которые в относительно больших количествах являются ядами, а в низких концентрациях оказывают полезное влияние. Например, мышьяк – сильный яд, нарушающий сердечнососудистую систему и поражающий почки и печень, в небольших дозах полезен, и врачи прописывают его для улучшения аппетита. Кислород, необходимый человеку для дыхания, в высокой концентрации (особенно под давлением) оказывает ядовитое действие. Из этих примеров видно, что концентрация элемента в организме играет весьма существенную, а порой и катастрофическую роль. Среди примесных элементов имеются и такие, которые в малых дозах обладают эффективными лечащими свойствами. Так, давно было замечено бактерицидное (вызывающее гибель различных бактерий) свойство серебра и его солей. Например, в медицине раствор коллоидного серебра (колларгол) применяют для промывания гнойных ран, мочевого пузыря, при хронических циститах и уретитах, а также в виде глазных капель при гнойных конъюктивитах и бленнорее. Карандаши из нитрата серебра применяют для прижигания бородавок, грануляций. В разбавленных растворах (0,1–0,25%) нитрат серебра используют как вяжущее и противомикробное средство для примочек, а также в качестве глазных капель. Ученые считают, что прижигающее действие нитрата серебра связано с его взаимодействием с белками тканей, что приводит к образованию белковых солей серебра – альбуминатов. Серебро пока не относят к жизненно необходимым элементам, однако уже экспериментально установлено его повышенное содержание в мозге человека, в железах внутренней секреции, печени. В организм серебро поступает с растительной пищей, например с огурцами и капустой. Тяжелые металлы (свинец, медь, цинк, мышьяк, ртуть, кадмий, хром, алюминий и др.) в микроколичествах необходимы организму и в основном они находятся в активных центрах коферментов. Особенно опасны металлорганические соединения, т. к. они гораздо лучше проходят барьеры внутри организма. Некоторые металлы, например, свинец, стронций, иттрий, кадмий замещают в организме кальций, а это приводит к хрупкости костей. Кадмий накапливается в почках, участвует в нескольких ферментативных реакциях. В ничтожно малых количествах кадмий способен стимулировать остроту зрения, активизировать сердечно-сосудистую деятельность, регулировать содержание сахара в крови. Однако незначительное повышение уровня кадмия в крови отрицательно сказывается на деятельности головного мозга. Кадмий является антагонистом цинка, селена способствует также нарушению обмена железа в организме животных. Кадмий повышает кровяное давление и играет значительную роль в возникновении и развитии инсультов и онкологических заболеваний. Медь оказывает на организм многогранное действие, влияет на рост, развитие, воспроизводство, гемоглобинообразование и на активность лейкоцитов. Является переносчиком кислорода при образовании пигментов В регионах с недостатком меди в почве отмечается анемия сельскохозяйственных животных. Дефицит меди приводит к разупорядочению соединительной ткани кровеносных сосудов у свиней, индюков. Избыток меди у животных вызывает поражение печени и развитие желтухи, у человека – острый панкреатит, язву двенадцатиперстной кишки, бронхиальную астму, гиперкупремию и др. Свинец способен накапливаться в костях, печени, почках. При отравлениях животных свинцом отмечают в первые часы повышенную активность и бессонницу, а в последующем утомляемость, депрессии, Более поздними симптомами являются расстройства функции нервной системы и поражение головного мозга. В медицинской практике свинцовое отравление часто диагностируют и лечат как психогенное заболевание. Установлено, что вдоль автомобильных дорог содержание свинца намного выше. С удалением от дорог на расстоянии 220 м в обе стороны концентрация свинца в почве снижается от 60 мг/кг до 30 мг/кг. В крови коров и буйволов концентрация свинца соответственно составляет 1,62 ±0,38 мг/л и 0,86±0,23 мг/л. Хром концентрируется в волосах и ногтях, меньше в гипофизе, надпочечниках, поджелудочной железе, легких, скелетных мышцах и тонких кишках. Ежесуточное поступление хрома до 0,05–0,2 мг считается нормой для человека. С пищей в организм человека поступает до 150 мкг хрома в сутки, а с водой от 10 до 40 мкг. Он участвует в процессах обмена глюкозы в организме. Является кофактором инсулина. Выявлено, что у человека избыток хрома вызывает ряд метаболических сдвигов: снижение толерантности к глюкозе, ослабление метаболизма углеводов, повышение инсулина в крови, глюкозурию, гипергликемию, а также задержку роста и повышение уровня холестерина и триглицеридов в сыворотке крови, увеличение числа атеросклеротических бляшек в аорте. Интоксикация хромом приводит к периферической невропатии, к нарушению деятельности нервной системы, снижает оплодотворяющую способность. Превышение МДУ хрома во всех органах диких и сельскохозяйственных животных обнаружено в Центрально-Черноземном районе России. Недостаток в организме хрома проявляется в угнетении роста, сокращении продолжительности жизни, нарушении обмена глюкозы, липидов, белка. Количество биологически активных химических элементов в организмах животных и тканях в основном зависит от их места обитания и особенностей потребления кормов. В большинстве случаях сельскохозяйственные животные страдают от дефицита и несбалансированности микроэлементов. При содержании тяжелых металлов в почве выше допустимых норм отмечают повышение поступления указанных металлов в рационы и соответственно в продукцию животноводства, ухудшение качества сельскохозяйственной продукции. Например, в пригородных хозяйствах при содержании в рационе тяжелых металлов- свинца, никеля, хрома и фтора в 2–7 раз выше ПДК содержание их в молоке оказалось в 1,25–2 раза выше допустимых. В Вологодской области из-за нехватки селена при избытке железа, марганца, кадмия отмечено поступление молока на молокозаводы с низкой титруемой кислотностью. Основной причиной являются выбросы предприятий Череповецкой промышленной зоны. Наличие тяжелых металлов влияет на качество сыра, при этом нарушается технология производства. В частности, ухудшается его вкус и запах становится нечистым, сыр легко крошится, творог становится мажущим. У овец, разводимых в промышленной зоне Ирака, отмечается депонирование в организме ртути, кадмия и свинца. У пятилетних овец содержание ртути и кадмия в мускулатуре выше МДУ (максимально допустимого уровня). У овец, разводимых в сельскохозяйственных районах Ирака, содержание тяжелых металлов в тканях и органах оказались в 2–7 раз меньше, чем у животных, разводимых в промышленной зоне. Все живые организмы имеют тесный контакт с окружающей средой. Жизнь требует постоянного обмена веществ в организме. Поступлению в организм химических элементов способствует питание и потребляемая вода. Организм состоит из воды на 60%, 34% приходится на органические вещества и 6% на неорганические. Основными компонентами органических веществ являются С, Н, О. В их состав входят также N, P, S. В составе неорганических веществ обязательно присутствуют 22 химических элемента. Например, если вес человека составляет 70 кг, то в нём содержится (в граммах): Са - 1700, К - 250, Na –70, Mg - 42, Fe - 5, Zn - 3. На долю металлов приходится 2,1 кг. Содержание в организме элементов IIIA–VIA групп, ковалентносвязанных с органической частью молекул, уменьшается с ростом заряда ядра атомов данной группы периодической системы Д. И. Менделеева. Например, w(О) > w(S) > w(Se) > w(Fe). Количество элементов, находящихся в организме в виде ионов (s-элементы IA, IIА групп, р-элементы VIIA группы), с ростом заряда ядра атома в группе увеличивается до элемента с оптимальным ионным радиусом, а затем уменьшается. Например, во IIА группе при переходе от Be к Са содержание в организме увеличивается, а затем от Ва к Ra снижается. Элементы, аналоги, имеющие близкое строение атомов, имеют много общего в биологическом действии. В соответствии с рекомендацией диетологической комиссии Национальной академии США ежедневное поступление химических элементов с пищей должно находиться на определенном уровне (таблица № 1). Столько же химических элементов должно выводиться , поскольку их содержание в организме находится в относительном постоянстве. Обычные микроэлементы, когда их концентрация в организме превышает биотическую концентрацию, проявляют токсическое действие на организм. Токсичные элементы при очень малых концентрациях не оказывают вредного воздействия на растения и животных. Например, мышьяк при микроконцентрациях оказывает биостимулирующее действие. Следовательно, нет токсичных элементов, а есть токсичные дозы. Таким образом, малые дозы элемента - лекарство, большие дозы - яд. «Все есть яд, и ничто не лишено ядовитости, одна лишь доза делает яд незаметным» - Парацельс. Уместно вспомнить слова таджикского поэта Рудаки: «Что нынче снадобьем слывет, то завтра станет ядом». Итак, биогенность 30 элементов установлена. Относительно постоянно содержание в организме человека 70 элементов (в пределах порядка). Отмечаются сильные колебания уровня (несколько порядков) примесных элементов и относительно низкий уровень примесных элементов у сельских жителей. Постоянство содержания необходимых элементов вероятнее всего определяется эффективными механизмами гомеостаза. |
