1. 1 Предмет химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
|
1.1 Предмет химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики. Термодинамика – наука, изучает взаимосвязь между различными видами энергии, определяет возможность, направленность и пределы самопроизвольно протекающих процессов. Выделяют общую (физическую), техническую и химическую термодинамику. Химическая термодинамика изучает энергетические эффекты различных химических и физико-химических процессов, определяет возможность, направление и глубину их протекания в конкретных условиях. Химическая термодинамика является основой биоэнергетики. Биоэнергетика изучает законы и механизмы накопления и использования энергии живыми системами. Она позволяет рассчитать энергетический баланс организма, калорийность пищевых продуктов и выбрать диету 1.2 Термодинамическая система. Типы термодинамических систем (изолированные, закрытые, открытые). Термодинамическая система – тело или совокупность тел, выделенных из пространства с определенной поверхностью раздела. Эта макросистема, она состоит из большого числа молекул. Поверхность раздела может быть реальной – стенки сосуда, или воображаемой (фиктивной), наделенной заранее заданными свойствами. Все, что вне термодинамической системы – окружающая среда. Классификация систем: а) по характеру взаимодействия с окружающей средой: изолированные– нет обмена веществом и энергией с внешней средой, например (очень приближенно), раствор хлорида натрия в закрытом сосуде Дьюара или термосе, подводная лодка, космический корабль. В природе таких систем нет (раствор NaCl в закрытом термосе ) закрытые (замкнутые) – обмен с внешней средой только энергией, например, раствор хлорида натрия в стеклянном сосуде с плотной крышкой, ампула с лекарственным веществом (раствор хлорида натрия в стеклянном сосуде с плотной крышкой) открытые– обмен веществом и энергией с внешней средой, например, , человек 1.3 Термодинамическое состояние системы. Интенсивные и экстенсивные параметры. Термодинамический процесс. Типы термодинамических процессов (изотермические, изобарные, изохорные). Виды термодинамического состояния (равновесное, стационарное переходное) Состояние системы – совокупность всех физических и химических свойств системы. Для описания состояния используют термодинамические параметры (характеристики) и функции состояния. Параметр - величина, характеризующая какое-либо свойство вещества или процесса. Совокупность параметров определяет состояние термодинамической системы. Все термодинамические параметры системы разделяют на экстенсивные и интенсивные. Экстенсивные– термодинамические характеристики, значения которых пропорциональны числу частиц в системе – масса (m), объем (V), количество вещества (n). Интенсивные– термодинамические характеристики, значения которых не зависят от числа частиц в системе температура (T), давление (P), концентрация (C, ω), плотность (ρ). Термодинамический процесс – переход системы из одного состояния в другое. Этот переход сопровождается изменением одного или нескольких параметров. Изменение – Δ; ΔV = V2 – V1 (конечное значение параметра минус начальное значение параметра). При переходе системы из одного состояния в другое изменение ее свойств не зависит от пути перехода, а определяется лишь конечным и начальным ее состояниями. Виды термодинамического состояния Равновесное – постоянство всех свойств во времени, в любой точке системы, нет потоков вещества и энергии. Стационарное – постоянство всех свойств во времени, оно поддерживается потоками вещества и (или) энергии. Для живого организма характерно стационарное состояние. Переходное – изменение свойств системы во времени. Виды процессов Обратимые – процессы, в которых небольшое противоположное воздействие меняет направление на обратное. При этом все промежуточные состояния – равновесные. Необратимые – процессы, которые самопроизвольно идут в одном направлении. Изотермический – T – const, ΔT=0 Изобарический– Р– const, ΔP =0 Изохорический– V – const, ΔV=0 Адиабатический– ΔQ=0 нет теплообмена с окружающей средой. 1.4 Функция состояния. Внутренняя энергия. Работа и теплота - две формы передачи энергии. Внутренняя энергия ΔU– полная энергия системы, сумма энергий теплового движения молекул, внутримолекулярной энергии и энергии межмолекулярного взаимодействия. Она описывает энергетическое состояние термодинамической системы. Согласно первому закону термодинамики в замкнутой системе она всегда должна быть величиной постоянной. Работа и теплота – две формы передачи энергии. Работа W (A)– передача энергии упорядоченного движения от одной системы к другой. В живых системах работа совершается за счет энергии, выделяющейся в катаболических процессах (распад и окисление веществ до углекислого газа, воды и мочевины). Работа – механическая (перемещение в пространстве), электрическая (изменение электрических потенциалов на клеточных мембранах нервных и мышечных клеток), химическая (анаболические процессы – синтез веществ, обеспечивающих структурную целостность организма и его функции). Теплота (Q) характеризует передачу энергии за счет хаотичного, беспорядочного движения молекул, которая осуществляется при контакте двух тел, имеющих разную температуру. Теплота и работа характеризуют процесс. В статических условиях работа и теплота не существуют. 1.5 Первый закон термодинамики (зак4он сохранения энергии). Закон сохранения энергии для тепловых процессов формулируется как первое начало термодинамики. Был открыт немецким ученым Ю. Майером. Для закрытой системы сообщенная системе теплота расходуется на рост внутренней энергии и на совершение работы против внешних сил: Q = ΔU + W; Qр = ΔН = Н2 – Н1. Т.е. для изобарного процесса теплота, подводимая к системе, идет на увеличение ее энтальпии (от греч. enthalpo – нагреваю). 1.6. ЭНТАЛЬПИЯ. ТЕРМОДИНАМИЧЕСКОЕ УРАВНЕНИЕ. СТАНДАРТНАЯ ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ. СТАНДАРТНАЯ ЭНТАЛЬПИЯ СГОРАНИЯ. Энтальпия -термодинамическая функция, характеризующая энергетическое состояниесистемы при изобарно-изотермических условиях (кДж/моль). Термодинамическое уравнение: Cтв. + О2(г.) = СО2( г.), ΔН = -393,5 кДж/моль Термохимическое уравнение: Cтв. + О2(г.) = СО2( г.) + 393,5 кДж/моль Стандартная энтальпия образования – это тепловой эффект реакцииобразования 1 моль какого-либо вещества из простых веществ при стандартныхусловиях. Обозначение ΔН0обр. Единица измерения – кДж/моль. В медицине невышла из употребления старая единица измерения – калория (от лат. calor -тепло), 1Дж = 4,185кал. ΔН0обр образования простых веществ, устойчивых пристандартных условиях равны 0. Стандартная энтальпия сгорания – тепловой эффект процесса приполном сгорании 1 мольвещества в атмосфере кислорода при стандартныхусловиях. Обозначение ΔН0сгор.. Единица измерения – кДж/моль. Стандартные энтальпииобразования и сгорания веществ приведены в таблицах. Иногда стандартныевеличины могут быть отнесены к другим условиям, что должно быть указано. 1.7. ЗАКОН ГЕССА. СЛЕДСТВИЯ ИЗ ЗАКОНА ГЕССА. Закон Гесса установил опытным путем в 1840 году русский ученыйГ.И. Гесс. Тепловой эффект процесса не зависит от путипроцесса (промежуточных стадий), а определяетсятолько начальным и конечным состояниями системы, т.е.состоянием исходных веществ и продуктов реакции. Следствия из закона Гесса: 1. Стандартная энтальпия реакции равна разнице между суммойстандартных энтальпий образования продуктов реакции и суммойстандартных энтальпий образования исходных веществ с учетомстехиометрических коэффициентов. ΔHор-ции.= Σ n ΔHо( 298,обр.прод.)- Σ n ΔHо( 298,обр.исх) 2. Стандартная энтальпия реакции равна разнице между суммойстандартных энтальпий сгорания исходных веществ реакции и суммойстандартных энтальпий сгорания продуктов с учетом стехиометрическихкоэффициентов. ΔHор-ции.= Σ n ΔHо( сгор.исх.)- Σ n ΔHо( сгор.прод.) 1.8. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ. РАСЧЕТ ЭНТРОПИИ РЕАКЦИИ. - теплота сама собой не может переходить от тела с меньшей температурой ктелу с большей температурой, - невозможен вечный двигатель второго рода, т.е. невозможенпериодический процесс, единственным результатом которого было быпревращение теплоты в работу вследствие охлаждения одного тела. Все самопроизвольные процессы протекают в направлении, при которомсистема переходит из менее вероятного состояния в более вероятное. т.е. изболее упорядоченного состояния в менее упорядоченное. Энтропия –мера неупорядоченности или вероятности системы.(S ) Математическое выражение для энтропии: ΔS = Qмин./ Т– изменение энтропии, размерность Дж/моль. Расчет энтропии реакции: Изменение энтропии химической реакции равно разнице между суммойэнтропий продуктов реакции и суммой энтропий исходных веществ с учетомстехиометрических коэффициентов. ΔS298,р-ции.= Σ n S298,прод. - Σ n ΔS298,исх 1.9. ЭНЕРГИЯ ГИББСА. ВЕРОЯТНОСТЬ ПРОТЕКАНИЯ ПРОЦЕССА. РАСЧЕТ ЭНЕРГИИ ГИББСА ХИМИЧЕСКОЙ РЕАКЦИИ. СТАЦИОНАРНОЕ СОСТОЯНИЕ. ЭКЗЕРГОНИЧЕСКИЕ И ЭНДЕРГОНИЧЕСКИЕ ПРОЦЕССЫ, ПРОТЕКАЮЩИЕ В ОРГАНИЗМЕ. ПРИНЦИП ЭНЕРГЕТИЧЕСКОГО СОПРЯЖЕНИЯ. Третий закон термодинамики Теорема Нернста: Энтропия любой системы при абсолютном нулетемпературы всегда может быть принята равной нулю.( на всякий случай!) Энергия Гиббса – термодинамическая функция состояния, учитывающаявлияние энтальпийного и энтропийного факторов на состояние системы приизобарно-изотермических условиях. Вероятность протекания процессаопределяется соотношением энтальпийного и энтропийного факторов. ΔH – ТΔS = ΔG, ΔG – энергия Гиббса. Расчет энергии Гиббса химической реакции Изменение энергии Гиббса химической реакции равно разнице междусуммой энергий Гиббса продуктов реакции и суммой энергий Гиббса исходныхвеществ с учетом стехиометрических коэффициентов. ΔGор-ции.=ΣnΔGо298, прод.- Σ n ΔGо298, исх.ΔGо298 – стандартная энергия Гиббса. Значения ΔGо298 приведены втаблицах. Стационарное состояние системы характеризуется постоянством свойствво времени, которое поддерживается за счет непрерывного обмена веществом,энергией информацией между системой и окружающей средой. Для биосистем ΔG, ΔS, T, π – const, рН ≈ 7 и р ≈ 1 атм. Биохимические реакции, сопровождающиеся уменьшением энергииГиббса (ΔG<0), называются экзергоническими, сопровождающиесяувеличением энергии Гиббса (ΔG>0) – эндергоническими. Энергия,необходимая для протекания эндергонической реакции, поступает за счетэкзергонической. Такие реакции называются сопряженными. 1.10. КАЛОРИЙНОСТЬ ПИЩИ . РАСЧЕТ КАЛОРИЙНОСТИ ПИЩИ. Источник энергии в живом организме – химическая энергия, заключеннаяв пищевых продуктах. Энергия расходуется на: - совершение работы внутри организма – дыхание, кровообращение,перемещение продуктов обмена (метаболитов) и т.д.; - нагревание вдыхаемого воздуха, потребляемой воды и пищи; - покрытие потерь теплоты в окружающую среду; - совершение внешней работы, связанной со всеми перемещениями человека. Энергия, необходимая организму человека, освобождается при окисленииуглеводов, жиров и белков. Запас веществ возобновляется при приеме пищи. Пищевые рационы,необходимые человеку при различных условиях труда и жизни, определяютсяиз условий баланса между энергией, расходуемой за сутки и энергией,выделяющейся при окислении веществ. Химический состав и калорийностьпищевых продуктов приводятся в справочниках. Фактические затраты зависятот возраста, пола, состояния здоровья, климатических условий, характератруда. Научной основой для расчетов суточной потребности человека в энергииявляются первое и второе начала термодинамики. Для расчета калорийности продукта используют калорическиекоэффициенты: белки и углеводы: kб= ky = 4,1 ккал/г (3,9-4,2 ккал/г); жиры kж =9,2 ккал/г (9,1-9,3 ккал/г). q = [m (б) + m (у) ] ∙ kб,у + m (ж) ∙ кж 1.11 Химическим равновесием называется состояние системы, при котором скорость образования продуктов реакции равна скорости их превращения в исходные реагенты. Химическое равновесие является динамическим, то есть его установление не означает прекращения реакции. Химическое равновесие По направлению реакции делят на обратимые и необратимые. Необратимыми называются реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные продукты. Большинство химических реакций являются необратимыми. Например реакции, протекающие в растворах, в результате которых: 1) образуется осадок: BaCl2 + H2SО4 = BaSО4 + 2HCI; 2) выделяется газ: 2HCl + FeS = H2S + FeCl2; 3) образуется слабый электролит: HCl + KOH = KCl + H2O. Обратимые по направлению химические реакции – те, которые при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлении. 1) C6H12O6 + 6O2(г) = 6CO2 + 6H2O, Δ G= –2880 кДж/моль 2) Hb(p) + O2(г) ↔ Hb · O2(p) , Δ G= –10 кДж/моль 3) H2 + I2 ↔ 2HI, Δ G=1,6 кДж/моль 4) СО(NH2)2 + H2O ← 2NH3 + CO2, Δ G=15 кДж/моль Константа химического равновесия При химическом равновесии скорости прямой и обратной реакций равны. Константа химического равновесия обратимого процесса равна отношению произведения равновесных парциальных давлений газообразных веществ (равновесных молярных концентраций) конечных продуктов к произведению равновесных парциальных давлений газообразных веществ (равновесных молярных концентраций) исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам при формулах соответствующих веществ в уравнении химической реакции. 1.12 Принцип Ле-Шателье Французский физико-химик Ле-Шателье, обобщая экспериментальные и теоретические данные, сформулировал принцип: воздействие какого-либо фактора на равновесную систему вызывает смещение равновесия в таком направлении, которое способствует восстановлению первоначальных характеристик системы. Влияние изменения концентрации Повышение концентрации исходных веществ приводит к самопроизвольному протеканию прямой реакции. Это приводит к повышению концентрации продуктов. И наоборот. Повышение концентрации продуктов реакции приводит к самопроизвольному протеканию обратной реакции. Это приводит к повышению концентрации исходных веществ. Влияние изменения давления (для системы газов) Повышение общего давления в системе газов увеличивает в системе долю продуктов того направления, которое приводит к снижению общего числа молей газообразных веществ. И наоборот. Понижение общего давления в системе газов увеличивает в системе долю продуктов того направления, которое приводит к повышению общего числа молей газообразных веществ. Изменение концентрации или давления, смещая равновесие, не изменяет величину константы равновесия, которая зависит только от природы реагирующих веществ и температуры. Влияние изменения температуры Нагревание ускоряет эндотермическое направление реакции, а охлаждение – экзотермическое направление. 1.13 Гомеостаз – относительное динамическое постоянство состава и свойств внутренней среды организма, обуславливающее устойчивость его физиологических функций. 2.1 Химическая кинетика – раздел физической химии, изучающий скорости и механизмы химических реакций. Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий. 2.2 Скорость химической реакции Скоростью химической реакции называют количество элементарных актов реакции, совершающихся в единицу времени. Средняя скорость реакции V – изменение концентрации реагирующих веществ в единицу времени (для гомогенной реакции): Где Δ C – изменение концентрации вещества, Δ τ – изменение времени. Чтобы скорость реакции была величиной положительной, в случае изучения скорости реакции по изменению концентрации исходных веществ перед отношением ставят знак минус. Истинная скорость реакции – изменение концентрации реагирующего вещества за бесконечно малый промежуток времени. Истинная скорость также называется мгновенной скоростью реакции . где – первая производная концентрации по времени. Cτ \ Чтобы скорости различных реакций можно было сравнить, для гомогенных реакций удобно скорость реакции относить к единице объема, а для гетерогенных – к единице поверхности. Для гетерогенной реакции: где Δ n – изменение количества вещества, Δ τ – изменение времени, s – площадь поверхности. 2.3. Классификация реакций, применяющиеся в кинетике:гомогенные , гетерогенные, микрогетерогенные; простые и сложные (последовательные, параллельные, сопряженные , цепные). 2.3.1. По механизму (реакции простые и сложные: параллельные, последовательные, сопряженные) Лимитирующая стадия сложной реакции. Простые – реакции, которые протекают только в одну стадию, т.е. В один элементарный акт.Сложные – реакции, протекающие в несколько стадий, несколько элементарных актов.Сложные реакции делят на: - последовательные – реакции с промежуточными стадиями типа: А → В → С. В этом случае промежуточный продукт В является исходным для получения конечного продукта С.Параллельные – реакции, при которых исходные вещества реагируют сразу в нескольких направлениях: А→ В ↓ С Например: при нитровании фенола получаются сразу три изомера: орто-, пара- и мета- нитрофенол.– Сопряженные (тандемные реакции) – реакции, из которых одна протекает лишь совместно с другой. Например, пероксид водорода легко окисляет соединения железа, но практически не окисляет бензол.Лимитирующая стадия сложной реакции. Это самая медленная стадия в сложном процессе и скорость ее протекания определяет (лимитирует) скорость всего процесса. 2.3.2. По природе частиц.По природе частиц реакции делят на: - молекулярные – реагируют молекулы, - ионные – реагируют ионы, - цепные – участвуют молекулы, радикалы и ионы. 2.3.3. По числу фаз.по числу фаз: - гомогенные реакции протекают в одной фазе, - гетерогенные – на границе раздела фаз. 2.3.4. По числу частиц, участвующих в элементарном акте. Молекулярность реакций определяется числом молекул, принимающих участие в элементарном акте реакции, число молекул образующихся веществ при этом не имеет значения: -мономолекулярные, бимолекулярные ,тримолекулярные . 2.4. Зависимость скорости реакции от концентрации. Кинетические уравнения. Порядок реакции. Зависимость скорости реакции от концентрации.Закон действия масс Количественная зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действия масс, впервые установленным профессором Харьковского университета Н.Н. Бекетовым в 1865 г. и сформулированным норвежскими учеными К. Гульдбергом и П. Вааге в 1867. Кинетические уравнения. Для мономолекулярной реакции типа А В + С  CA; Для бимолекулярной реакции типа А + В = С + D, V= CA; Для бимолекулярной реакции типа А + В = С + D, V=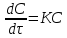 ACB; ACB;Для тримолекулярных реакций типа 2А+В = С , 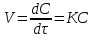 2ACB , где К — коэффициент пропорциональности. Величину К называют также константой скорости реакции. Она зависит от температуры и природы реагирующих веществ и не зависит от их концентраций. С точки зрения теории столкновений величина К пропорциональна доле из общего числа соударений молекул, приводящих к химическому взаимодействию. 2 2ACB , где К — коэффициент пропорциональности. Величину К называют также константой скорости реакции. Она зависит от температуры и природы реагирующих веществ и не зависит от их концентраций. С точки зрения теории столкновений величина К пропорциональна доле из общего числа соударений молекул, приводящих к химическому взаимодействию. 22.5. Период полупревращения. Период полупревращения (0,5) – время, в течение которого в реакцию вступает половина исходного вещества. Для радионуклидов аналогичная величина называется периодом полураспада. 2.6. Зависимость скорости реакции от температуры.Правило Вант-Гоффа . Температурный коэффициент скорости реакции и его особенности для биологических процессов . При повышении температуры на каждые 10 °C скорость большинства реакции возрастает в 2-4 раза, а при понижении температуры на 10 °C скорость реакции во столько же раз уменьшается.Для биохимических процессов составляет величину от 1,06 до 1,82 (в среднем). Температурный коэффициент биохимических процессов организма человека соответствует 310К 5 (32-42 С o ). Организм использует температурный эффект для ускорения соответствующих реакций с целью 39 регулирования биохимических процессов для ликвидации патологических изменений своего состояния. |
