1. Аналитическая часть
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
2.3 Вариант технологической схемы утилизации резины с регенерацией серной кислотыСерная кислота является одним из основных продуктов неорганических производств (более 100 млн. т/год мировое производство). Основным сырьем для ее производства служат сульфидные минералы (пирит - FeS2, медный колчедан - FeCuS2 и др.) и свободная сера. В России большая часть серной кислоты производится из пирита и описывается следующими химическими стадиями: 1. Получение сернистого газа при обжиге пирита: 2. Каталитическое окисление сернистого газ: 3. Гидратация серного ангидрида:  Принципиальную технологическую схему получения серной кислоты можно представить следующим образом: - обжиговая печь; - промывные башни; - мокрый электрофильтр; - сушильная башня; - контактный аппарат; - абсорбционные башни; - холодильник кислоты; - сборник кислоты. Производство серной кислоты контактным способом - это отлаженный технологический процесс, позволяющий получать достаточно дешевый продукт. Следует отметить, что в себестоимости серной кислоты ≈ 50% приходится на пирит, т.е. сырье для получения сернистого газа. Исходя из экспериментальных результатов процесса деструкции резины при действии концентрированной серной кислоты может быть предложен следующий возможный вариант принципиальной технологической схемы утилизации резинотехнических изделий представленной на рисунке 2. Необходимая для процесса деструкции резиновая крошка (фракция 1-2 мм) может быть получена по известным технологиям, в частности на установке, разработанной в МГТУ им. Н.Э. Баумана [9, 10]. Предлагаемая технологическая схема позволяет не только полностью регенерировать серную кислоту, израсходованную на процесс деструкции резины и являющуюся оборотным продуктом, но и получит ее как товарный продукт за счет окисления серы, входящей в состав резины. Так, при содержании серы в резине в количестве 5% переработка 1 т. Резины дает 0,15 т. Товарной серной кислоты. 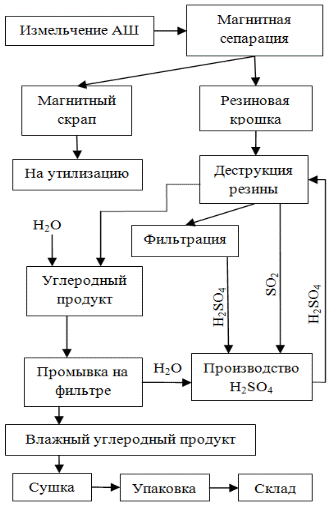 Рисунок 2 - Принципиальная технологическая схема безотходной утилизации отработанных АШ путем сернокислотной деструкции Другим товарным продуктом предлагаемой технологической схемы является углеродный материал, который может быть использован: - как твердое топливо; - как восстановитель при пирометаллургических процессах получения металлов, например никеля, являясь заменителем коксика; как сорбент для улавливания органических веществ, в частности нефти и нефтепродуктов, а также неорганических веществ, в частности ионов тяжелых металлов. Более детальные исследования этого материала позволят, вероятно, расширить области его применения. 2.4 Регенерация серной кислотыПолучение серной кислоты из сернистого газа является каталитическим процессом, где в качестве катализатора обычно используют модифицированную пятиокись ванадия. Для лабораторной проверки возможности регенерации серной кислоты при деструкции резины серной кислотой была собрана лабораторная установка, состоящая из: - реактора деструкции резины; - склянки осушения SO2; реактора окисления SO2 на стандартном ванадиевом катализаторе; поглотителя полученного SO3; поглотителя непрореагировавшего SO2 (раствор перманганата калия). Методика эксперимента заключалась в следующем. В стеклянный реактор с концентрированной серной кислотой (50,4 г) при температуре 125˚С помещалось 7,22 г резины (т.е. моделировался ранее описанный опыт по кинетике деструкции резины, что позволило знать скорость выделения SO2 в этих условиях). Одновременно через реактор продувался воздух с определенной скоростью, что давало газовую смесь SO2(9,3%) и O2(18,7%). Полученная газовая смесь барботировалась через две осушительные колонки с концентрированной серной кислотой и направлялась в контактную колонку высотой 20 см и диаметром 4 см, которая была заполнена стандартным ванадиевым катализатором с диаметром гранул 5 мм. В колонке поддерживалась температура 450˚С. После контактной колонки газы барботировались через две поглотительные склянки с 90%-ной серной кислотой, которые охлаждали. Отходящие из поглотителей газы барботировали через раствор KmnO4 для определения остаточного содержания SO2. После анализа поглотительных растворов был рассчитан баланс по превращению сернистого газа, полученного при деструкции резины серной кислотой, который представлен в таблице 8. Таблица 8 - Баланс превращения SO2 в H2SO4
Полученные результаты подтверждают обоснованность нашего предположения о регенерации серной кислоты, которая затрачивается на деструкцию резины. Следует подчеркнуть, что затраты на регенерацию серной кислоты будут значительно ниже, чем при ее первичном получении из пирита, поскольку процессы обжига и очистки получаемого сернистого газа отпадают, т.к. полученный при деструкции резины SO2 не требует очистки и может быть прямо направлен в контактный аппарат. | |||||||||||||||||||||
