1. Аналитическая часть
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
3. Экспериментальная часть3.1 Кинетика процесса деструкцииДля определения температуры начала процесса деструкции была использована резиновая крошка с размером частиц 1,5-2,5 мм, которая заливалась концентрированной серной кислотой и стакан нагревался на электрической плитке, а температура определялась по опущенному в стакан термометру. Заметное выделение SO2, которым сопровождается процесс деструкции резины, наблюдалось при температуре около 100оС и значительно усиливалось с ростом температуры. Таким образом, процесс деструкции целесообразно проводить при температурах несколько выше 100˚С. Изучение кинетики процесса деструкции резины было основано на определении количества сернистого газа, выделяющегося за определенный промежуток времени, для чего использовалась реакция восстановления им перманганата калия: 2KMnO4 + 5SO2 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 (19) Схема использовавшейся для этого лабораторной установки приведена на рисунке 3. Рисунок 3 - Схема лабораторной установки для изучения кинетики деструкции резины В термостат (1) помещается стеклянный реактор (2), в который загружалось соответствующее количество концентрированной серной кислоты и резиновой крошки крупность 1,0-1,5 мм. Через подводную трубку (3) в реактор (2) подавался ток воздуха, который транспортировал выделяющийся сернистый газ по трубопроводу (4) в реактор (6), снабженный механической мешалкой (5). Перед началом эксперимента в реактор (6) заливали определенный объем титрованного раствора перманганата калия, подкисленного серной кислотой. В реакторе (6) протекала реакция (19). Через определенные промежутки времени из реактора (6) отбирали пробы раствора и определяли там содержание перманганата калия путем титрования им стандартного раствора щавелевой кислоты по следующей реакции: 2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5CO2 + 8H2O (20) Реакция (20) позволяла определить уменьшение концентрации перманганата калия во времени, а реакция (19) позволяла рассчитать количество выделившегося за это время сернистого газа. Условия проведения эксперимента и полученные результаты приведены в таблице 9 и на рисунке 4. Таблица 9 - Скорость выделения SO2 при деструкции резины концентрированной серной кислотой; масса резины равна 9,6 г, масса серной кислоты составляла 25,2 г
Используя уравнение Аррениуса: была рассчитана величина энергии активации (Ea) процесса деструкции резины серной кислотой:  (22) (22)Для Т1 = 388 К и Т2 = 398 К Еа = 102,9 кДж Для Т1 = 398 К и Т2 = 408 К Еа = 101,4 кДж Средняя Еа = 102,15 кДж. Рассчитанная из данных таблицы 9 средняя удельная скорость образования SO2 за первые 15 мин процесса деструкции при t=125°C составляет 9,676 л/мин·кг. Подбирая соответствующую скорость подачи воздуха (газа-носителя) можно на выходе из аппарата деструкции получать такую концентрацию сернистого газа, которая обеспечит нормальную работу контактного аппарата окисления его в серный ангидрид. 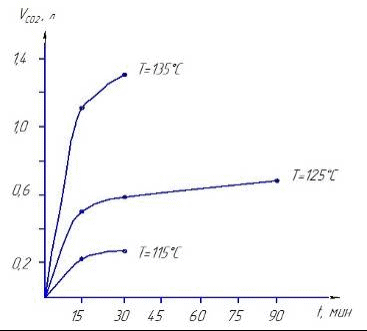 Рисунок 4 - Зависимость количества выделившегося SO2 от времени Как видно из рисунка 4, процесс деструкции первоначально протекает в кинетической области, а затем переходит в диффузионную, что характерно для гетерогенных процессов такого типа. Следует подчеркнуть, что сернистый газ от деструкции резины не содержит твердых частиц и не требует очистки на электрофильтрах. |
