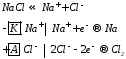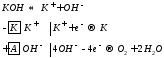Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет
 Скачать 2.97 Mb. Скачать 2.97 Mb.
|
65 билетЕ 298 K = +1.45+1.984*10^-4*(298/2)*lg (10^-4)^4/0.1 = +1.006576 В. https://www.liveexpert.org/topic/view/1523638-rasschitajte-ravnovesnij-potencial-elektroda-na-kotorom-protekaet-reakciya-po-uravneniyu-pbo2-4h-2e-pb2-2h2o-standartnij-potencial-raven-1 66 билет67 билет 68 билетЭлектролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.Электролиз— совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении электрического тока через расплав или раствор электролита. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду. На катоде, происходит процесс восстановления (принятие электронов). На аноде идет процесс окисления (отдача электронов). Электролиз расплавов
Электролиз водных растворовНа процессе электролиза в водных растворах влияние оказывают продукты диссоциации воды Катодный процесс Поведение катионов металлов при электролизе зависит от расположения металла в ряду активности, возможны 3 случая: а) катионы металлов (от Li+ по Al3+) не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды; б) катионы металлов (от Sn2+ по Au+) полностью восстанавливаются на катоде; в) катионы металлы средней части ряда от (Al3+ до Sn2+) восстанавливаются на катоде одновременно с молекулами воды. Вода на катоде (-) А) кислая среда рН<7 Б) нейтральная и щелочная рН>=7 Анодный процесс Аноды могут быть растворимые (активные) и нерастворимые (инертные). Активные аноды изготавливают металлов (из меди, серебра, железа), они сами растворяются, т.е. окисляются при электролизе. Инертные аноды из угля, графита, платины, они не окисляются, т.е. не растворяются при электролизе, а служат для передачи электродов во внешнюю цепь. На инертном аноде происходит окисление анионов раствора или молекул воды. При этом анионы бес кислородных кислот легко окисляются, а вместо кислородосодержащих анионов окисляется вода.
Вода на аноде (+) А) щелочная среда рН>7 Б) нейтральная и кислая среда |