Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет
 Скачать 2.97 Mb. Скачать 2.97 Mb.
|
Законы электролизаКоличественная характеристика процессов электролиза определяется законами Фарадея. Первый закон Фарадея Масса вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду, прошедшему через электролит. Второй закон Фарадея При постоянном количестве прошедшего электричества массы образующихся на электродах веществ пропорциональны их эквивалентным массам: Для выделения 1 эквивалента вещества нужно пропустить через электролизер 1 Фарадей количества электричества: 1F=96500 Кл/моль=26,8г/А*ч В обобщенном виде законы Фарадея записывают: где m - масса в-ва образуемого на электроде (в г); Мэ – эквивалентная масса; i – сила тока (в А); τ – время электролиза; q – количество электричества Электрохимический эквивалент КЭ – число, показывающее какая масса вещества выделится на электродах при прохождении 1 Кл электричества Выход по токуПоказателем эффективности электролиза является выход по току – отношение массы фактически полученного при электролизе полезного продукта к его массе отвечающей законам Фарадея: 7.Комплексные соединения. Состав и строение комплексных соединений: комплексообразователь, лиганды, комплексный ион, координационное число, внутренняя и внешняя сфера. Номенклатура комплексных соединений. При взаимодействии молекул часто образуются более сложные соединения, соединения высшего порядка. 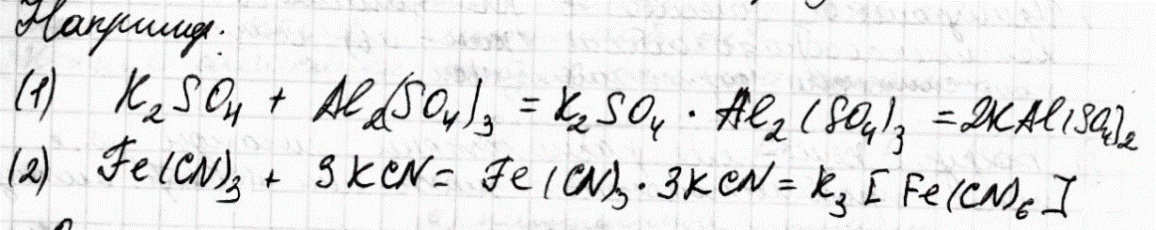 Одни из них диссоциируют на все составляющие ионы, и называются двойными солями (1), другие на сложные (комплексные ионы), и называются комплексными или координационными соединениями (2). 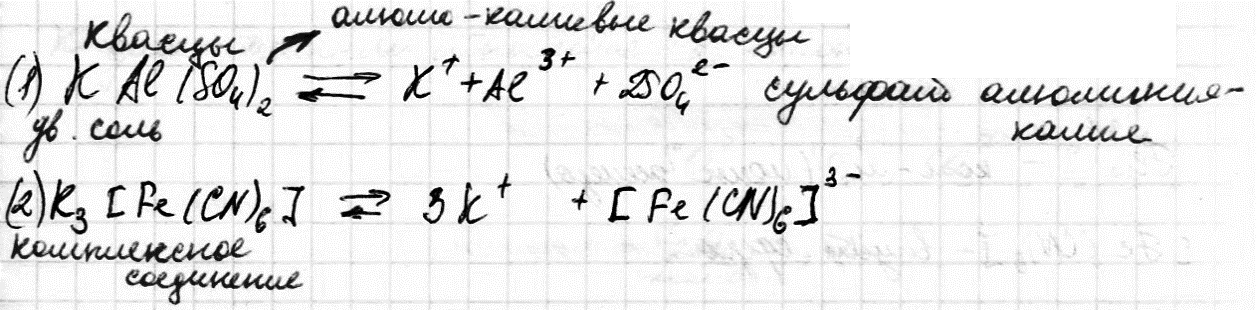 К комплексным соединениям относятся такие вещества, которые содержат группу, способных к независимому существованию атомов или молекул (лигандов), координированных в определенном порядке, вокруг центрального атома, называемого комплексообразователем. 69 билетСтандартный потенциал никеля (-0,250в) , поэтому при электролизе на катоде в основном происходит разряд ионов Ni(+2) и выделение металла, на угольном аноде - выделение кислорода, на никелевом аноде - окисление металла - растворение анода. Процесс применяется для очистки никеля ( электролитическое рафинирование) + никелирование . 70 билетСоль образована катионом сильного основания и анионом сильной кислоты. При электролизе на всегда окисляется вода, а на катоде- восстанавливается вода. K: 2H2O + 2e --> H2 + 2OH(-) A: 2H2O -4e --> O2 + 4H(+) 2H2O --> 2H2 + O2 m(H2) = 0,02 г m(O2) = 32*1930/(96500*4) = 0,16 г. 71 билетУпрощенный расчет выглядит так: 1) рассчитываете Е 298 для возможных процессов на катоде: Ni2+ +2e- = Ni с учетом [Ni2+] и 2H+ +2e- = H2 (а точнее для процесса 2H2O +2e- = H2 + 2OH-) без учета гидролиза по катиону Ni2+ (т.е. для [H+] = 10^-7 моль/л); 2) рассчитываете Е 298 для процесса на аноде 2H2O -4e- = O2 + 4H+ опять же без учета гидролиза по катиону Ni2+; 3) вычисляете напряжение разложения электролита NiSO4 как разность E 298 анодного процесса — E 298 катодного процесса для определения наиболее вероятного процесса на катоде (процесс на катоде с меньшей разностью будет преобладать); 4) по ф-ам m = M*I*t/(z*F) и V = Vm*I*t/(z*F) рассчитываете массу и объем продуктов элек-а; для более точного расчета придется вычислить [H+] с учетом гидролиза NiSO4 по катиону Ni2+ (потребуются справ. данные по Кд. Ni(OH)2 по 2 ступени), пересчитать Е 298 для процессов 2H+ +2e- = H2 и 2H2O -4e- = O2 + 4H+, а далее — см. п. 3) и 4) выше. |
