Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет
 Скачать 2.97 Mb. Скачать 2.97 Mb.
|
78 билетОсновные способы защиты металлов от коррозииДля защиты металлов от коррозии применяются различные способы, которые условно можно разделить на следующие основные направления: легирование металлов; защитные покрытия (металлические, неметаллические); электрохимическая защита; изменение свойств коррозионной среды; рациональное конструирование изделий. Легирование металлов. Это эффективный метод повышения коррозионной стойкости металлов. При легировании в состав сплава или металла вводят легирующие элементы (хром, никель, молибден и др.), вызывающие пассивность металла. Пассивацией называют процесс перехода металла или сплава в состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса. Пассивное состояние металла объясняется образованием на его поверхности совершенной по структуре оксидной пленки (оксидная пленка обладает защитными свойствами при условии максимального сходства кристаллических решеток металла и образующегося оксида). Широкое применение нашло легирование для защиты от газовой коррозии. Легированию подвергаются железо, алюминий, медь, магний, цинк, а также сплавы на их основе. В результате чего получаются сплавы с более высокой коррозионной стойкостью, чем сами металлы. Эти сплавы обладают одновременно жаростойкостью и жаропрочностью. Жаростойкость – стойкость по отношению к газовой коррозии при высоких температурах. Жаропрочность – свойства конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры. Жаростойкость обычно обеспечивается легированием металлов и сплавов, например, стали хромом, алюминием и кремнием. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов, например Al2O3 и Cr2O3 . Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионностойким сплавам, например, относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы. Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий для защиты их коррозии, называются защитными покрытиями. Нанесение защитных покрытий – самый распространенный метод борьбы с коррозией. Защитные покрытия не только предохраняют изделия от коррозии, но и придают поверхностям ряд ценных физико-химических свойств (износостойкость, электрическую проводимость и др.). Они подразделяются на металлические и неметаллические. Общими требованиями для всех видов защитных покрытий являются высокая адгезионная способность, сплошность и стойкость в агрессивной среде. Металлические покрытия. Металлические покрытия занимают особое положение, так как их действие имеет двойственный характер. До тех пор, пока целостность слоя покрытия не нарушена, его защитное действие сводится к изоляции поверхности защищаемого металла от окружающей среды. Это не отличается от действия любого механического защитного слоя (окраска, оксидная пленка и т.д.). Металлические покрытия должны быть непроницаемы для коррозионных агентов. При повреждении покрытия (или наличии пор) образуется гальванический элемент. Характер коррозионного разрушения основного металла определяется электрохимическими характеристиками обоих металлов. Защитные антикоррозионные покрытия могут быть катодными и анодными. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. Анодные покрытия имеют наиболее отрицательный потенциал, чем потенциал основного металла. Так, например, по отношению к железу никелевое покрытие является катодным, а цинковое – анодным (рис. 2.). При повреждении никелевого покрытия (рис. 2,а) на анодных участках происходит процесс окисления железа вследствие возникновения микрокоррозионных гальванических элементов. На катодных участках - восстановление водорода. Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждения покрытия. Местное повреждение защитного цинкового слоя ведет к дальнейшему его разрушению, при этом поверхность железа защищена от коррозии. На анодных участках происходит процесс окисления цинка. На катодных участках - восстановление водорода (рис. 2,б). Электродные потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Для получения металлических защитных покрытий применяются различные способы: электрохимический(гальванические покрытия);погружение в расплавленный металл(горячее цинкование, лужение);металлизация(нанесение расплавленного металла на защищаемую поверхность с помощью струи сжатого воздуха);химический(получение металлических покрытий с помощью восстановителей, например гидразина). 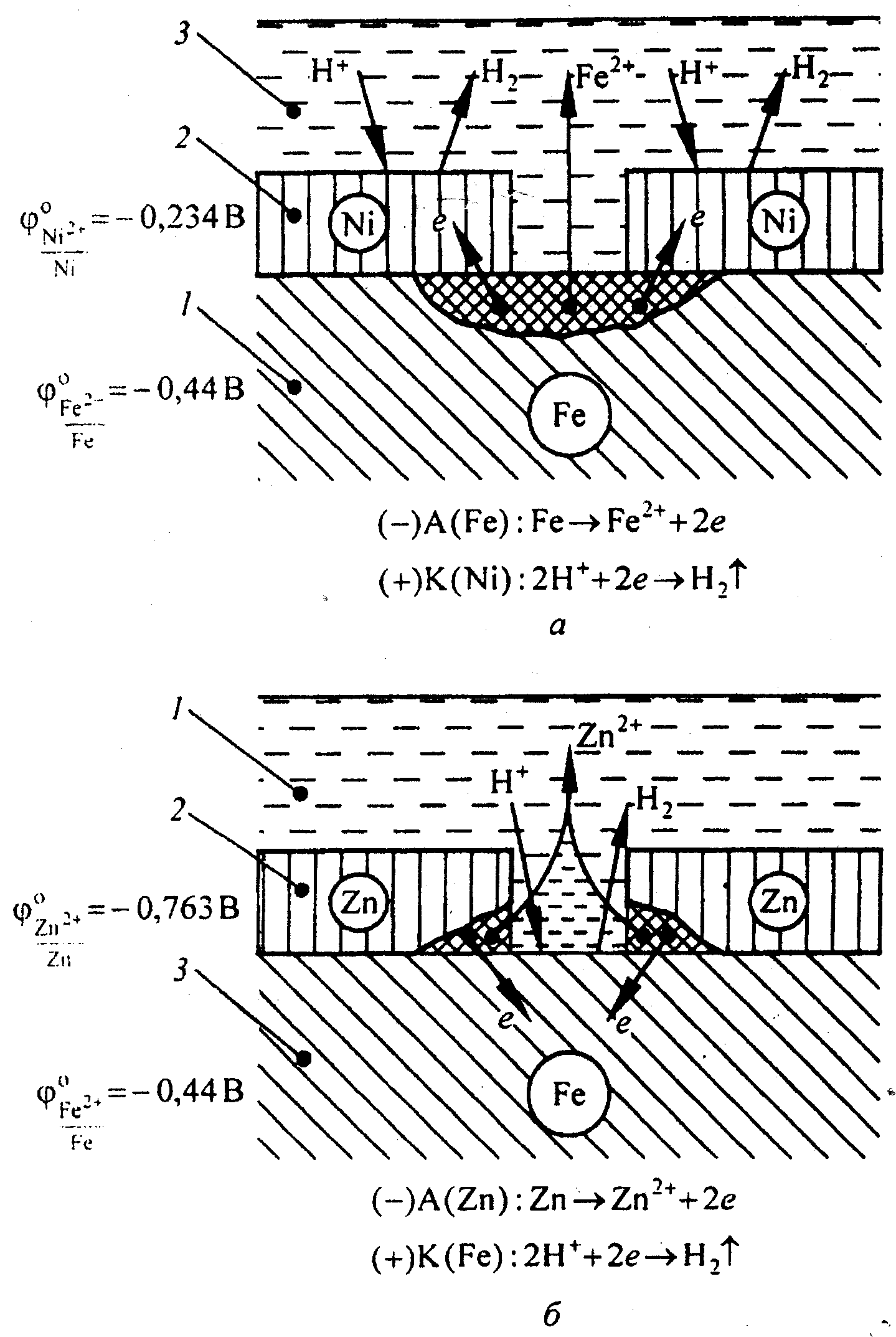 Рис. 2. Коррозия железа в кислотном растворе с катодным (а) и анодным (б) покрытиями: 1 – основной металл; 2 – покрытие; 3 – раствор электролита. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). Неметаллические защитные покрытия. Они могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединение хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной. Неорганические эмали по своему составу являются силикатами, т.е. соединениями кремния. К основным недостаткам таких покрытий относятся хрупкость и растрескивание при тепловых и механических ударах. Лакокрасочные покрытия наиболее распространены. Лакокрасочное покрытие должно быть сплошным, газо -и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью. Химические способы очень разнообразны. К ним относится, например, обработка поверхности металла веществами, вступающими с ним в химическую реакцию и образующими на его поверхности пленку устойчивого химического соединения, в формировании которой принимает участие сам защищаемый металл. К числу таких способов относится оксидирование, фосфатирование, сульфи-дирование и др. Оксидирование - процесс образования оксидных пленок на поверхности металлических изделий. Современный метод оксидирования – химическая и электрохимическая обработка деталей в щелочных растворах. Для железа и его сплавов наиболее часто используется щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре 135-140ОС. Оксидирование черных металлов называется воронением. На анодных участках происходит процесс окисления: Fe Fe2+ + 2 На катодных участках происходит процесс восстановления: 2 Н2О + О2 + 4 4ОН- На поверхности металла в результате работы микрогальванических элементов образуется Fe(OH)2, который затем окисляется в Fe3O4. Оксидная пленка на малоуглеродистой стали имеет глубокий черный цвет, а на высокоуглеродистой стали – черный с сероватым оттенком. Fe2+ + 2OH- Fe(OH)2; 12 Fe(OH)2 + NaNO3 4Fe3O4 + NaOH + 10 H2O + NH3 Противокоррозионные свойства поверхностной пленки оксидов невысоки, поэтому область применения этого метода ограничена. Основное назначение – декоративная отделка. Воронение используется в том случае, когда необходимо сохранить исходные размеры, так как оксидная пленка составляет всего 1,0 – 1,5 микрона. Фосфатирование - метод получения фосфатных пленок на изделиях из цветных и черных металлов. Для фосфатирования металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4 + Mn(H2PO4)2) при температуре 96-98 оС. На поверхности металла в результате работы микрогальванических элементов образуется фосфатная пленка, которая имеют сложный химический состав и содержит малорастворимые гидраты двух- и трех замещенных фосфатов марганца и железа: MnHPO4, Mn3(PO4)2 , FeHPO4 ,Fe3(PO4)2 nH2O. На анодных участках происходит процесс окисления: Fe Fe2+ + 2 На катодных участках происходит процесс восстановления водорода: 2Н++ 2 Н2 (рН < 7) При взаимодействии ионов Fe2+ с анионами ортофосфорной кислоты и ее кислых солей образуются фосфатные пленки: Fe2+ + H2PO-4 FeHPO4 + H+ 3Fe2+ + 2 PO43- Fe3(PO4)2 Образующаяся фосфатная пленка химически связана с металлом и состоит из сросшихся между собой кристаллов, разделенных порами ультрамикроскопических размеров. Фосфатные пленки обладают хорошей адгезией, имеют развитую шероховатую поверхность. Они являются хорошим грунтом для нанесения лакокрасочных покрытий и пропитывающих смазок. Фосфатные покрытия применяются в основном для защиты металлов от коррозии в закрытых помещениях, а также как метод подготовки поверхности к последующей окраске или покрытию лаком. Недостатком фосфатных пленок является низкая прочность и эластичность, высокая хрупкость. Анодирование – это процесс образования оксидных пленок на поверхности металла и прежде всего алюминия. В обычных условиях на поверхности алюминия присутствует тонкая оксидная пленка оксидов Al2O3 или Al2O3 ∙ nH2O, которая не может защитить его от коррозии. Под воздействием окружающей среды алюминий покрывается слоем продуктов коррозии. Процесс искусственного образования оксидных пленок может быть осуществлен химическим и электрохимическим способами. При электрохимическом оксидировании алюминия алюминиевое изделие играет роль анода электролизера. Электролитом служит раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот, катодом может быть металл, не взаимодействующий с раствором электролита, например нержавеющая сталь. На катоде выделяется водород, на аноде происходит образование оксида алюминия. Суммарный процесс на аноде можно представить следующим уравнением: 2 Al + 3 H2O Al2O3 + 6 H+ + 6 79 билет 80 билет 81 билет82 билет 83 билет 84 билетO2 + 2H2 = 2H2O 400мл = 0,4л находим количество вещества О2 = 0,4л/22,4л/моль = 0,018моль находим количество вещества Р2 по уравнению реакции 1моль ----- 2й моль 0,018моль---Хмоль Н2 Х= 0,036моль находим массу Н2 = 0,036моль*2г/моль = 0,072г находим объем Н2 = 0,036моль*22,4л/моль = 0,807л находим количество молекул Н2 = 0,036моль* 6,02*10 в 23 степени =0,217*10 в 23 степени дано V(O2)=400 mL=0.4 L +H2 -------------------------- V(H2)-? m(H2)-? N(H2)-? 0.4 л X л O2 + 2H2-->2H2O 1mol 2mol X=0.4*2 / 1=0.8 L (H2) 0.4 л X g O2 + 2H2-->2H2O Vm=22.4 L/mol M(H2)=2 g/mol 22.4 2*2 X=0.4*4/22.4=0.07 g - (H2) N(H2)=(V/Vm)*N(A)=(0.8 / 22.4)*6.02*10^23=2.15*10^22 молекул ответ 0.8 л, 0.07 г, 2.15*10^22 молекул 85 билетCa(OH)2 + CO2 -> CaCO3↓ + H2O CaCO3 = CaO + CO2 CaO + H2O = Ca(OH)2 CaCl2=Ca+Cl2 2Al + 3H2SO4 ⟶ Al2(SO4)3 + 3H2↑ Al2(SO4)3 + 8NaOH → 2Na[Al(OH)4] + 3Na2SO4 Na[Al(OH)4] + 4HNO3 = Al(NO3)3 + NaNO3 + 4H2O Fe+H2SO4=FeSO4+H2 FeSO4+2KOH=K2SO4+Fe(OH)2 4Fe(OH)2+02+2H20=4Fe(OH)3 3Cu + 8HNO3(разб.) ⟶ 3Cu(NO3)2 + 2NO↑ + 4H2O Cu(NO3)2 + 2NaOH ⟶ Cu(OH)2↓ + 2NaNO3 Cu(OH)2 + 2HCl ⟶ CuCl2 + 2H2O CuCl2 + 4NH3 ⟶ [Cu(NH3)4]Cl2 2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O Cr2(SO4)3 + 8NaOH → 2Na(Cr(OH)4) + 3Na2SO4 Na[Cr(OH)4] + 4HNO3 = Cr(NO3)3 + NaNO3 + 4H2O |
