|
|
Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет|
|
 Скачать 2.97 Mb. | Название | 1 билет | | Анкор | Ответы на вопросы по химии 1 курс | | Дата | 11.01.2023 | | Размер | 2.97 Mb. | | Формат файла |  | | Имя файла | Экзамен ХИМИЯ.docx | | Тип | Закон
#881327 | | страница | 2 из 30 |
|
 6 билет 6 билет
HCl. Объяснение: Чем больше разность электроотрицательностей элементов, тем более полярной будет ковалентная связь.
7 билет
Насыщаемостьпроявляется в способности атома иметь максимальная ковалентность. Максимальная ковалентность это число связей, которое может дать атом за счет неспаренных электронов с учетом возбужденных состояний, с учетом ионизациии и с учетом донорно-акцепторного механизма образования связи. Так максимальная ковалентность атомов элементов первого периода равна единице (одна s-орбиталь), второго периода равна четырем (одна s-орбиталь и три p-орбитали). У атомов элементов третьего периода она увеличивается за счет свободных 3d-орбиталей до шести или девяти. Предела ковалентности не найдено.
Направленность объясняется тем, что электронные облака имеют определенную форму и ориентированы друг относительно друга под определенными углами. Молекулы, в связи с этим, имеют определенную геометрическую форму. В связи могут участвовать чистые орбитали и гибридные.
В молекуле следует различать центральный атом, вокруг которого координируются другие атомы (периферийные).
Если валентные возможности центрального атома в обычном состоянии позволяют образовать необходимое число сигма- и пи-связей электронами одного подуровня, то в связи участвуют чистые либо s-, либо p-орбитали.
В этом случае молекулы имеют линейную (участвуют в связи s-или p-орбитали), уголковую (участвуют две p-орбитали) или пирамидальную форму (участвуют три p-орбитали) молекул, с углом связи 1800 и 900 (Cl2, HCl, H2S, PH3 и т.д.).
Если в связи участвуют электроны разных подуровней, то вместо разных орбиталей возникают гибридные (концепция гибридизации Полинга).
Гибридизация это усреднение электронных облаков по форме и по энергии. Происходит гибридизация при приближении к центральному атому периферийных атомов. При этом гибридизации подвергаются орбитали центрального атома и вместо двух, трех, четырех, пяти и т.д. разных орбиталей возникают две, три, четыре, и т.д. гибридные орбитали. Гибридизация становится невозможной, если орбитали сильно отличаются по энергии. Поэтому по группам ПС сверху вниз склонность к гибридизации уменьшается.
Типы гибридизации:
sp-гибридизация (гибридная орбиталь на 50% s и на 50% p), угол между орбиталями 1800 – форма расположения связей линейная (CO2, MgCl2 и т.д.);
sp2-гибридизация (гибридная орбиталь на 30% s и на 70% p), угол между орбиталями 1200 – форма расположения связей - плоский треугольник (BH3, AlCl3 и т.д.);
sp3-гибридизация (на 25% s и на 75% p), угол между связями 109,50 – форма расположения связей – тетраэдр (CH4, H2O, NH3 и т.д.);
sp3d-гибридизация, при этом образуются 5 гибридных орбиталей, три под углом 1200 в одной плоскости, а две под 900 перпендикулярно этой плоскости, форма расположения связей – тригональная бипирамида (PCl5, ClF3 и т.д.);
sp3d2-гибридизация, угол между орбиталями 900, форма расположения связей – октаэдр (SF6, PF6-) и т.д.
Правило определения типа гибридизации.
Тип гибридизации определяется числом сигма-связей + число неподеленных электронных пар. В гибридизации, таким образом, могут участвовать орбитали, содержащие неподеленные электронные пары ( H2O, NH3 и т.д.). От типа гибридизации зависит геометрия молекулы.
Поляризуемость ковалентной связи. Это способность связи становиться полярной, либо более полярной, под действием внешнего электрического поля.
Этим объясняется способность к диссоциации ковалентных молекул при растворении в воде. Вода – это полярная жидкость, в которой происходит поляризация ковалентной связи молекул растворенного вещества, вплоть до гетеролитического распада. Так молекула HCl ковалентная, но в воде диссоциирует на ионы (HCl →H+ + Cl-). По ряду галогеноводородных кислот поляризуемость усиливается и, несмотря на уменьшение полярности связи, сила кислот растет от HF к HI.
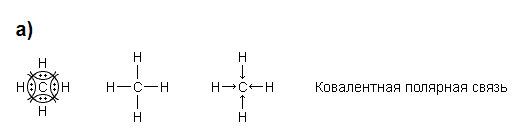 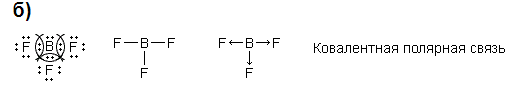
|
|
|
 Скачать 2.97 Mb.
Скачать 2.97 Mb.