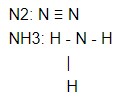|
|
Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет|
|
 Скачать 2.97 Mb. | Название | 1 билет | | Анкор | Ответы на вопросы по химии 1 курс | | Дата | 11.01.2023 | | Размер | 2.97 Mb. | | Формат файла |  | | Имя файла | Экзамен ХИМИЯ.docx | | Тип | Закон
#881327 | | страница | 5 из 30 |
|
11 билет
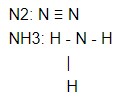
Схема образования химической связи в молекуле азота.
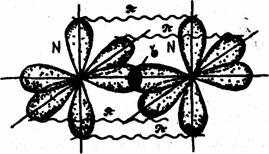
В молекуле азота связь осуществляется за счет перекрывания трех р-облаков, расположенных по оси х, у, z. Между атомами азота образуется одна сигма (σ) -связь и две пи – связи (π). Связь, образованная при перекрывании электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется сигма (σ) - связью. Связь, образованная за счет перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов, называется пи – связью.
 12 билет 12 билет
13 билет
Ионная связь– связь за счет электростатического взаимодействия противоположно заряженных ионов: катионов и анионов. Ионная связь возникает при взаимодействии атомов с разностью электроотрицательности > 2. В этом случае за счет смещения электронной плотности атомы превращаются в ионы (электронная пара полностью переходит во владение наиболее электроотрицательного атома) Rb + F → Rb+ : F-
NaCl; χ (Na)=0,9; χ (Cl)=3,1; χ =χ (Cl)- χ (Na)=3.1-0.9=-2,2.
Ионы-это заряженные частицы, превращающиеся в атомы путем принятия или отдачи электронов. Ионы принято рассматривать , как заряды со сферической симметрией силового поля, а взаимодействие таких зарядов ненасыщаемо и ненаправляемо.
Каждый ион в ионном кристалле окружает себя на близком расстоянии таким числом противо-ионов, которое может геометрически разместить.
Понятие молекулы для ионного соединения : из-за ненасыщенности и ненаправленности молекулы ионной связи носят условный характер.
Формула в молекуле ионного соединения показывает лишь простейшие соотношения между количествами катионов и анионов в макрокристалле вещества.
Строение
1 . Ионны в кристале упаковываются таким образом, чтобы одноименные находились как можно дальше (мин отталкивались), а различные как можно ближн (мах притяжение). . Ионны в кристале упаковываются таким образом, чтобы одноименные находились как можно дальше (мин отталкивались), а различные как можно ближн (мах притяжение).
По этой причине ионные кристалы характерезуются принципом плотнейшей упаковки.
Вокруг каждого ионна может располагаться ограниченное число противо-ионнов.
Это число называется координационным чилом (к.ч.) f (rкатион/rанион).
2. В ионном кристале нельзя выделить реально существующую структурную единицу (молекулу). Молекула для ионного вещества – условная формульная единица. Она лишь показывает соотношение кол-ва катионов и анионов в макрокристале вещества. NaCl AlCl3
1:1 1:3
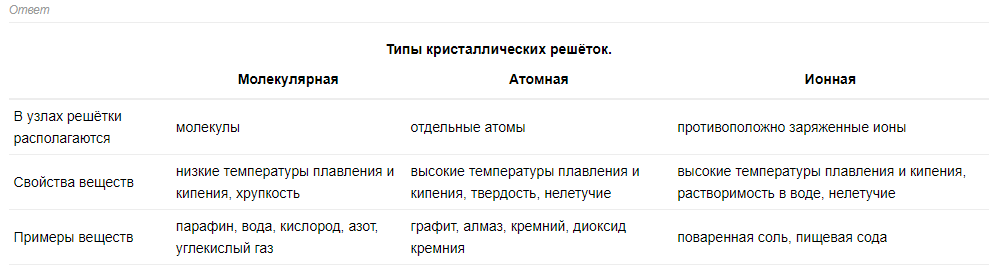
Свойства веществ с ионной связью
1) Прочные и Твердые, Есв = 500÷1000 кДж/моль;
2) Хрупкие - не выдерживают воздействий, приводящих к смещению ионных слоев;
3) Не проводят эл ток и тепло (с твердом состоянии), т.к нет свободных электронов

Примеры веществ с ионной связью.
К веществам с ионной связью относятся все соли, образованные органически и неорганически,
соединения между наиболее активными Ме и НеМе,
Если НеМе более активен чем Ме => между ними ионная связь.
Ионная связь образуется в том случае, когда валентный электрон от одного атома переходит к другому. А в результате образуются два иона. Но для этого нужно, чтобы один из атомов был типичный неметалл, а другой типичный металл. И больше всего подходят к этому случаю соединения сильных неметаллов и щелочных металлов. А конкретно из пояснения для ответа подходит NaF. Именно здесь фтор является сильным электроотрицательным элементом, и он присоединяет к себе электрон от натрия. А именно натрий легко отдает электрон и становится положительным ионом.
14 билет

CH4 - ковалентная полярная; валентность углерода = IV, валентность водорода = I; степень окисления углерода -4, водорода +1
|
|
|
 Скачать 2.97 Mb.
Скачать 2.97 Mb.