Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет
 Скачать 2.97 Mb. Скачать 2.97 Mb.
|
15 билет 16 билетХлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия. Вид связи в кристалле хлорида натрия – ионная, в кристалле натрия – металлическая. Для веществ с металлической связью образуется металлическая кристаллическая решетка (в узлах КР находятся атом-ионы натрия, а между ними располагаются делокализованные общие электроны, принадлежащие сразу всем атом-ионам - электронный газ). В случае металлического натрия кристаллическая решетка кубическая гранецентрированная. Вещества с ионной химической связью обладают ионной кристаллической решеткой (в узлах находятся ионы Na⁺ и Cl⁻, при этом они чередуются между собой через один). Тип кристаллической решетки в этом случае кубическая. Таким образом один атом натрия в обоих случаях координирует 8 соседних частиц. Значит, координационное число натрия равно 8. Наиболее типичны металлы, в которых валентная зона заполнена не нацело. Таковы щелочные и щелочноземельные металлы, у которых р-состояния валентной оболочки полностью или частично свободны. И в этом случае зона проводимости может перекрываться с валентной зоной, и тогда даже при самых низких температурах электроны коллективизируются всем кристаллом и передвигаются по свободным квантовым состояниям зоны проводимости при наложении электрического поля, что приводит к высокой электропроводности таких металлов. Коллективизацию электронов в металлическом кристалле часто представляют следующим образом: положительно заряженные остовы атомов «плавают» или, точнее, «висят» в отрицательно заряженной «электронной жидкости» (модель «желе»), оставаясь, однако, в узлах кристаллической решетки. Поэтому структура типичного металла не обнаруживает признаков направленности связи и либо подчиняется законам плотнейших упаковок, либо приближается к ним. Действительно, из 60 типичных металлов Периодической Системы 40 кристаллизуются в плотнейших кубической (рис. 39 а, б) или гексагональной (рис. 39 д, е) структурах с КЧ=12, а еще 15 - в объемноцентрированной кубической с КЧ=8+6, которая приближается к первым по компактности упаковки (68% по сравнению с 74%) (рис. 39 в, г). Расстояние до шести вторых соседей только на 15% больше расстояния до восьми первых в ОЦК-структуре. Ненаправленность связей от данного атома к его ближайшим соседям сближает структуры металлов со структурами ионных кристаллов, где кулоновские силы между соседями также имеют центральный характер, т.е. сферическую симметрию. Поэтому вторые соседи, т.е. одноименные ионы, обычно анионы, образуют в ионных кристаллах те же плотнейшие упаковки. Разница, однако, состоит в том, что в ионных кристаллах ближайшие соседи разного знака (катионы и анионы) имеют различные размеры и поэтому разнообразие структур ионных кристаллов гораздо больше, чем металлических, и не сводится к трем плотнейшим и плотным упаковкам. Переходные металлы также, как правило, обладают типичными металлическими свойствами (электро- и теплопроводность, ковкость и т. п.) и структурами, которые описываются одной из плотнейших или плотных упаковок. Но существует группа простых веществ, свойства которых указывают на их переходный характер между чисто металлическими и чисто ковалентными соединениями (полуметаллы, металлоиды). Очень сложными структурами обладают кубические полиморфные модификации β-W, α- и β-Mn (α-W имеет ОЦК, γ-Mn – ГЦК-структуры). В структуре β-W разные атомы W имеют КЧ 12 и 14. В структуре α-Mn существуют четыре, а в структуре β-Mn – два сорта атомов Mn, отличающихся по координации и размерам. Это можно объяснить различным электронным строением (валентным состоянием) кристаллохимически различных сортов атомов. 17 билетПолярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем. Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой Дипольный момент связи (m) - векторная величина, характеризующая полярность связи. Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = lЧ q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы. 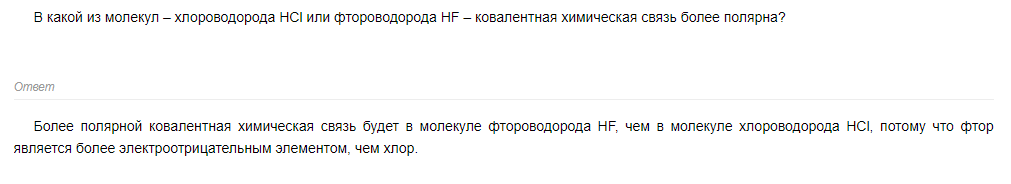 HF Потому что F - самый электроотрицательный элемент |
