Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет
 Скачать 2.97 Mb. Скачать 2.97 Mb.
|
19 билетЭлементы химической термодинамики. Первый закон термодинамики. Термодинамические функции состояния системы – энтальпия и внутренняя энергия. Тепловой эффект реакции. Закон Гесса. Термохимические расчеты. Элементы химической термодинамики. На прошлой лекции мы закончили рассмотрение темы «Строение вещества» и теперь переходим к рассмотрению закономерностей протекания химических процессов. Практически наиболее важными являются два типа закономерностей – энергетические и временные. Первые изучает химическая термодинамика, вторые – химическая кинетика. Изначально термодинамика – это наука о «движении тепла». Она возникла в начале XIX века как теоретическая база создания тепловых машин (в основном, паровых котлов), послуживших основой промышленной революции. Сейчас стало ясно, что термодинамика описывает энергетические состояния и их изменения в системах, состоящих из огромного числа элементов (тела состоят из атомов!) и находящихся в состоянии равновесия. Химическая термодинамика – это обобщение термодинамики на случай, когда в системе протекают химические процессы. Для нас важно осознать термодинамическое описание двух задач: Энергетические характеристики термодинамических систем. Возможности предсказания направлений протекания самопроизвольных химических процессов и способов осуществления целенаправленных химических превращений. Основные понятия термодинамики. Понятие энергии – одно из основных физических понятий и потому не имеет исчерпывающего определения. Для наших целей примем, что энергия - это такая характеристика движения и взаимодействия тел, которая связана с их способностью совершать изменения в состоянии системы и внешней среды. Видов энергии очень много – механическая, тепловая, электромагнитная, ядерная и т.д. Каждая из них может только видоизменяться, т.е. превращаться в другие виды энергии. Термодинамическая система и ее состоянияТермодинамическая система – это ограниченная область пространства, занятая ее элементами. Важно, что ограниченная. Граница может быть и физической (стенки сосуда) и мысленной. Все, что вне системы – окружающая среда Термодинамические системы бывают трех видов: Изолированные (нет обмена ни веществом, ни энергией с окружающей средой). Пример – герметичный сосуд с газом с теплоизоляционной оболочкой, Вселенная в целом. Замкнутые (нет обмена веществом с окружающей средой). Пример – герметичный сосуд. Открытые (есть и энерго- и массообмен с окружающей средой). Пример – костер, человек. В химической термодинамике изучаются только изолированные и замкнутые системы. Различают равновесные и стационарные состояния систем. Равновесные системы самопроизвольно не изменяют своих состояний. Стационарные системы самопроизвольно не изменяют свою структуру. Параметры термодинамической системыСостояния систем характеризуются параметрами состояния и функциями состояния. Параметры состояния системы – это набор независимых свойств, полностью характеризующих систему. Например, для идеального газа достаточно любых трех из четырех параметров – давления P, объёма V, температуры T и количества молей . Выбрав три, мы по уравнению состояния (в данном случае это будет уравнение Менделеева-Клапейрона) найдем четвертый: PV= RT Для более сложных систем могут появиться дополнительные параметры состояния – например, химический состав. Параметры делятся на интенсивные и экстенсивные. Интенсивные параметры не зависят от количества вещества в системе (давление, температура, напряженность электрического поля и др.), а экстенсивные – зависят (объем, масса, заряд и др.) Функци состояния термодинамической системыПараметры состояния определяют функции состояния, тем или иным образом однозначно характеризующие энергию этого состояния. Однозначность проявляется в том, что функции состояния не зависят от истории системы, т.е. от того, как она попала в данное состояние. Отметим пока в качестве примера такую функцию состояния системы как внутренняя энергия U. Термодинамические процессыОсобую форму в термодинамике имеет время. Оно лишено такого своего качества, как длительность и проявляется только как изменение. В термодинамике не рассматривается ход процесса, а только его результат. Событие в термодинамике – это изменение равновесных параметров в ходе термодинамического процесса. По разным признакам в термодинамике процессы классифицируются так: По конечному результату – разомкнутые и циклические, в результате которых параметры приобретают исходные значения. По характеру взаимодействия с окружающей средой: обратимые и необратимые. Обратимые процессы не оставляют изменений в окружающей среде. По местонахождению причины: самопроизвольные (причина – в самой системе) и вынужденные (причина – в окружающей среде) По пути проведения процесса: изотермический (при постоянной температуре), изобарический или изобарный (при постоянном давлении), изохорический (при постоянном объеме). Нулевой закон (Нулевое начало) термодинамики – понятие о температуре. Остановимся на параметре T. Это – абсолютная температура в Кельвинах. Она характеризует среднюю кинетическую энергию хаотического движения, приходящуюся на 1 степень свободы частицы системы: где i – число степеней свободы, k – постоянная Больцмана, i= 3 для одноатомных молекул (три направления свободного движения), i=5 (свободное движение плюс два вращения) для двухатомных, i=6 (свободное движение плюс три вращения) для трехатомных и более. С точки зрения термодинамики температура – особый параметр. Она является индикатором направления передачи тепла – самопроизвольно тепло передается от более горячего тела к более холодному. Нулевой закон термодинамики гласит: Две системы, находящиеся в тепловом равновесии с третьей, находятся в равновесии и друг с другом. При этом все три системы характеризуются одинаковым значением определяющего это равенство параметра - температуры. Сформулирован Ральфом Говардом Фаулером в 1931 году. (1899-1944, Англ. физик, член Лондонского королевского общества, создатель теории нейтронных звезд). Первый закон (Первое начало) термодинамики. Внутренняя энергия системы и энтальпия. Сформулируем два понятия, характеризующие механизм передачи энергии от системы к окружающей среде и в обратном направлении. Теплота (тепло) Q – энергия, передающаяся за счет хаотического движения элементов системы и окружающей среды. Работа W – энергия, передающаяся за счет упорядоченного поступательного движения потока большого числа элементов системы или окружающей среды. Ни теплота, ни работа с точки зрения Первого начала термодинамики, не являются функциями состояния системы. Они зависят не только от параметров системы, но и от пути проведения процесса. Дадим определение внутренней энергии системы U. Внутренняя энергия системы U – это суммарная энергия всех составных частей системы и их взаимодействий. Она НЕ ВКЛЮЧАЕТ кинетической и потенциальной энергии системы как целого. Что же она ВКЛЮЧАЕТ? Это кинетическая энергия хаотического теплового движения частиц системы, потенциальная энергия их взаимодействия, обусловленная структурой системы, энергия электронов на атомных и молекулярных орбиталях, энергия связи в атомных ядрах, энергия элементарных частиц. В термодинамических процессах изменяются только кинетическая энергия хаотического теплового движения частиц системы, потенциальная энергия их взаимодействия, обусловленная структурой системы и энергия электронов на атомных и молекулярных орбиталях. Первое начало термодинамики формулируется так: Тепло, переданное системе, может изменять ее внутреннюю энергию и совершать работу как в системе, так и в окружающей среде: Q= U+W Это – одна из формулировок закона сохранения энергии. Она запрещает, в частности, процессы, в которых W 0 при Q= U=0, т.е. получение работы без затраты тепла и изменения внутренней энергии. (Запрет на вечные двигатели первого рода). В дальнейшем всегда будет пониматься, что (разность) чего бы то ни было, это разность между конечным и начальным состояниями. Важно также договориться о знаках тепла и работы. В термодинамике знаки рассматриваются с точки зрения системы. То, что «входит» в систему – имеет знак «+», что «покидает» её – знак «-». Т.е. работа, совершаемая НАД системой положительна (+W), а совершаемая системой НАД окружающей средой – отрицательна (-W). Аналогично, тепло, поступающее в систему (отнимаемое от окружающей среды в эндотермическом процессе) – положительно (+Q), а тепло, отдаваемое системой (выделяющееся в окружающей среде в экзотермическом процессе) – отрицательно (-Q). Когда изменение внутренней энергии бесконечно мало, оно является полным дифференциалом внутренней энергии dU, и Первое начало термодинамики записывается в виде: Q=dU+ W Здесь введено специальное обозначение для обозначения бесконечно малых изменений тепла и работы, чтобы подчеркнуть, что Q и W являются параметрами пути процесса, а U – параметром состояния системы. Ни тепло, ни работа по отдельности таковыми не являются. (Полный дифференциал выражается через производные и приращения независимых переменных, в данном случае – параметров системы) Рассмотрим изобарический процесс P=const. Система переходит из состояния 1 в состояние 2 с тепловым эффектом QP Для него: Q = QP; U = U2 – U1; W=P(V2 – V1) Отсюда: QP = U2 – U1+ P(V2 – V1)=( U2 + PV2) - ( U1 + PV1) Выражения в скобках являются выражениями новой функции состояния, которая называется энтальпия и обозначается H: H=U+PV Из проведенного анализа ясно, что: QP = H Т.е. энтальпия – это функция состояния термодинамической системы, определяющая тепловой эффект изобарического процесса. Энтальпия – экстенсивная и аддитивная функция состояния. Тепловой эффект реакции. Закон Гесса. Термохимические расчеты. Тепловым эффектом химической реакции называется количество теплоты, выделяющейся (экзотермические процессы) или поглощающееся (эндотермические процессы) при осуществлении реакции при постоянном давлении или постоянном объёме и равенстве температур начального и конечного состояний системы. Изучением тепловых эффектов реакций занимается термохимия. Наиболее распространенным является метод работы и расчётов при постоянном давлении. В дальнейшем мы будем говорить только о таких процессах. В термохимии, в отличие от химической термодинамики, процессы рассматриваются с точки зрения окружающей среды, а потому знаки тепловых эффектов обратные – «+» для экзотермических и «-» для эндотермических процессов. Иными словами: Qх.р. = - Hх.р. (или Qr = - Hr) Индекс r- от reaction, реакция При записи стехиометрических уравнений в термохимии обязательно указывается агрегатное состояние реагентов и продуктов реакции, а также тепловой эффект: 2H2Oж + 2Naтв = 2NaOHр-р + H2 г + Qх.р.а ( - Hх.р.а.) (а) Поскольку энтальпия – функция аддитивная, то при изменении стехиометрических коэффициентов меняется и тепловой эффект химической реакции: H2Oж + Naтв = NaOHр-р + ½ H2 г + Qх.р.б ( - Hх.р.б.) (б) И Qх.р.а = 2 Qх.р.б В термохимии введено важное понятие о теплоте образования химического соединения. Теплота образования химического соединения – это удельный тепловой эффект реакции образования химического соединения из простых веществ, находящихся в стабильном состоянии при стандартных условиях. Стандартное состояние – это состояние чистого вещества при давлении 1,013*105Па (1 атм) и определенной температуре (обычно - 298К). Например, для реакции Cграфит + O2 г. = CO2 + Qх.р, проведенной в стандартных условиях, Qх.р = Qобр. CO2. В результате большого объёма экспериментальных исследований составлены таблицы теплот образования для огромного количества веществ. Они представлены в виде стандартных энтальпий образования, имеющих вид: fH0298 A где индекс f означает formation – образование, индекс 0 – стандартное состояние, 298 – температуру, A –указывает на вещество (скажем, А). Последний индекс часто опускают, вынося указание на формулу вещества в шапку таблицы. Величина fH0298 имеет размерность кДж/моль и относится к образованию одного моля данного вещества А. Она – величина интенсивная. Тепловые эффекты химических реакций подчиняются закону Гесса (см. о нем http://ru.wikipedia.org/wiki/%D0%93%D0%B5%D1%81%D1%81%2C_%D0%93%D0%B5%D1%80%D0%BC%D0%B0%D0%BD_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87 ) Он гласит: тепловой эффект химической реакции определяется только начальным и конечным состоянием реакционной системы и не зависит от пути протекания процесса. Под путем процесса понимается количество промежуточных реакций. Так, например, сгорание графита можно провести двумя путями. Прямое взаимодействие: Cграфит + O2 г. = CO2 г. + Qх.р.1 (1) 2.Через промежуточное окисление графита до монооксида углерода (угарного газа): Cграфит + ½ O2 г. = CO г. + Qх.р.2 (2) CO г. + ½ O2 г. = CO2 г. + Qх.р.3 (3) В соответствии с законом Гесса, если просуммировать уравнения (2) и (3), и сравнить результат с уравнением (1), мы получим: Qх.р.2 + Qх.р.3 = Qх.р.1 Закон Гесса позволяет вычислять тепловые эффекты химических реакций, которые сложно осуществить экспериментально, исходя из данных по более простым реакциям. Важным следствием из закона Гесса является утверждение о том, что тепловой эффект химической реакции может быть вычислен как разность сумм теплот образования продуктов реакции и теплот образования реагентов. Так, для реакции: aA + bB = cC + dD + Qх.р. Hх.р.. = (c fH0298 C + d fH0298 D) – (a fH0298 A + b fH0298 B) Или: Hх.р. = 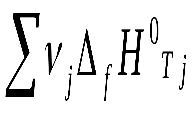 - - 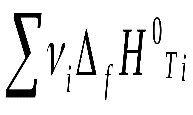 Где - стехиометрические коэффициенты, а индекс i относится к реагентам, а индекс j – к продуктам реакции. Кроме таблиц (баз данных) по энтальпиям (теплотам) образования химических соединений составлены также (особенно для органических веществ) аналогичные таблицы по теплотам (энтальпиям) сгорания. ( сH0298 A Индекс с – от combustion, сгорание) Таким образом, мы рассмотрели первую задачу, которую поставили при начале обсуждения темы – задачу об энергетике химических реакций. На следующей лекции мы рассмотрим вторую задачу – о направлении протекания химических реакций. |
