|
|
Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет|
|
 Скачать 2.97 Mb. | Название | 1 билет | | Анкор | Ответы на вопросы по химии 1 курс | | Дата | 11.01.2023 | | Размер | 2.97 Mb. | | Формат файла |  | | Имя файла | Экзамен ХИМИЯ.docx | | Тип | Закон
#881327 | | страница | 23 из 30 |
|
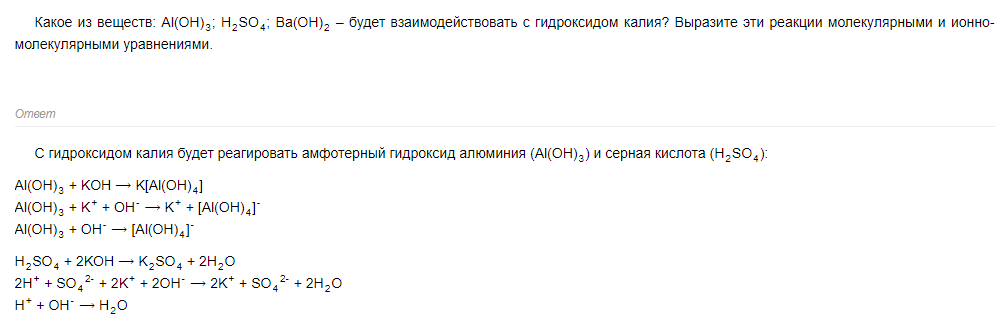 59 билет 59 билет
60 билет
NiSO4 + H2SO4 ⟶ Ni(HSO4)2
Ni2+ + SO42- + 2H+ + SO42- ⟶ Ni2+ + 2HSO4- SO42- + H+ ⟶ HSO4-
Na2S + H2SO4 ⟶ Na2SO4 + H2S↑
2Na+ + S2- + 2H+ + SO42- ⟶ 2Na+ + SO42- + H2S↑
2H+ + S2- ⟶ H2S↑
Молекулярное: 2Al(OH)3 + 3H2SO4 -> Al2(SO4)3 + 6H2O
Полное ионное: 2Al(OH)3 + 6H(+)+3SO4(-2) -> 2Al(+3)+3SO4(-2) + 6H2O
Сокращенное ионное: Al(OH)3 + 3H(+) -> Al(+3) + 3H2O
61 билет
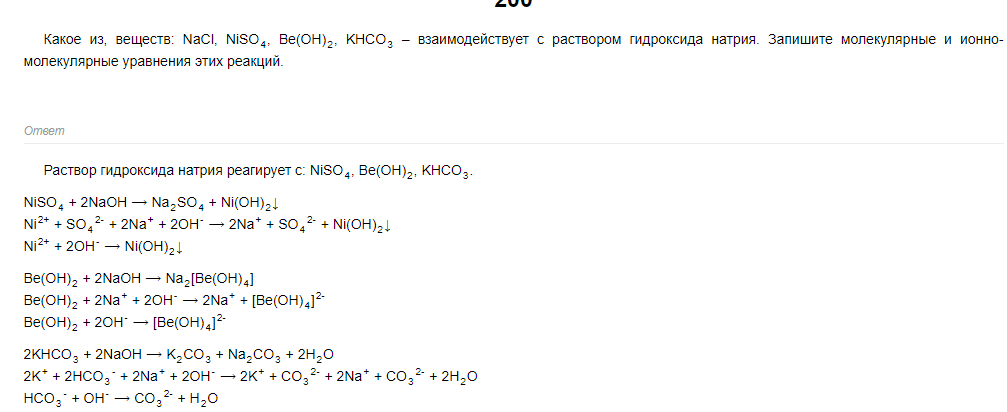 62 билет 62 билет
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом,кальция и магния (так называемых «солей жёсткости»).
Различают следующие виды жесткости.
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Итак, как уменьшить жесткость воды кипячением?
Считается, что кипячение (термоумягчение) – один из основных методов борьбы с жесткостью. На самом деле, с помощью повышенных температур можно избавиться только от временной жесткости.
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
При этом сульфаты и хлориды кальция и магния так и остаются в растворе.
Реагентные способы устранения жесткости воды
Метод реагентного умягчения основан на добавлении в воду гашеной извести или кальцинированной соды. При этом активные компоненты переводят соли магния и кальция в нерастворимые соединения, которые и выпадают в осадок.
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
На сегодняшний день самым эффективным реагентом является ортофосфат натрия, который входит в состав многих умягчителей.
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Реагентные методы можно считать наиболее эффективными среди существующих способов устранения жесткости. Однако данные методики оправдывают себя только при относительно большом расходе воды, поскольку необходимо точно рассчитывать дозировку реагента и регулярно утилизировать отфильтрованный осадок.
Реагентное устранение жесткости воды – одно из основных направлений развития и изучения ионообменной технологии умягчения. Подробнее про ионообменные фильтры. Специальные загрузки заменяют ионы кальция и магния на ионы натрия и водорода. Таким образом, можно понизить жесткость до 0,05 °Ж. Мы уже писали о допустимых нормах жесткости воды.
Безреагентные способы устранения жесткости воды
Мембранные, термические и электрические методы устранения жесткости воды не предполагают использование химических реактивов. В процессе ультра- и нанофильтрации, а также обратного осмоса полупроницаемые мембраны задерживают ионы магния и кальция. К недостаткам метода следует отнести необходимость регулярной промывки или замены мембраны.
Устранение жесткости воды с помощью электродиализа основано на удалении солей кальция и магния под действием электрического поля. Данный метод, как и технология работы магнитных преобразователей, находится еще на этапе подробного изучения. Подробнее про принцип работы магнитного умягчителя.
Дистилляцию тоже можно отнести к безреагентным способам устранения жесткости. Однако выпаривание - скорее универсальный, чем специальный метод обессоливания водопроводной воды.
|
|
|
 Скачать 2.97 Mb.
Скачать 2.97 Mb.