Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет
 Скачать 2.97 Mb. Скачать 2.97 Mb.
|
48 билетДавление насыщенного пара над раствором. Закон рауля.Растворы нелетучих веществ в летучих растворителях. 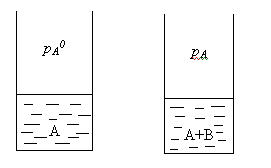 рA0– давление насыщенного пара над чистым растворителем. рA– давление насыщенного пара над раствором. Давление насыщенного пара рA0над растворителем или жидкостьюопределяется межмолекулярным взаимодействием внутри жидкости. Чем больше сила взаимодействия fA-A между молекулами, тем меньше пара над жидкостью, и соответственно, тем меньше давление этого парарA0 <<<. Давление насыщенного пора над раствором рAпри нелетучем растворенном веществе В отличается от давления насыщенного пара над чистым растворителемрA0. Для нахождения этого отличия в зависимости от состава идеального раствора рассмотрим условия равновесияi-го компонента в растворе и в парообразном состоянии. Это равновесие определяется равенством химических потенциалов: Химический потенциал можно выразить через парциальное давление: Если i-й компонент подчиняется законом идеальных газов, то дифференцируя это уравнение, получим: Теперь из уравнений Проведем интегрирование этого уравнения от рA0дорAи отNA=1 доNA, изменяющегося в пределах 0 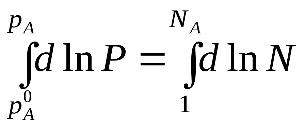 После интегрирования получаем: Давление насыщенного пара над растворомрA равно произведению его давления над чистым растворителем рA0 на его мольную долюNA. Если раствор состоит из двух компонентов А(р-ль) и В(в-во), то мольная доля растворенного вещества равна NB=1-NA. Тогда уравнение (*) трансформируется: Если NВ – мольная доля растворенного вещества, то 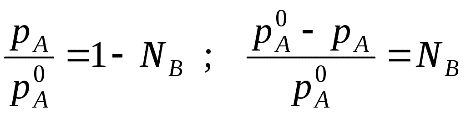 (2) (**) (2) (**)Формулы (*) и (**) отражают различные способы выражениязакона Рауля. Разность (рA0- рA) характеризует понижение давления насыщенного пара над раствором, а отношение (рA0- рA)/ рA0 – относительное понижение давления насыщенного пара. Тогда закон Рауля формулируется следующим образом:относительное понижение давления пара над раствором равно мольной доле растворенного вещества в растворе. 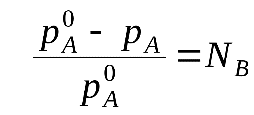 Закон Рауля применим к идеальным и сильно разбавленным растворам. Максимальноедавление пара, создаваемое жидкостью – давление её насыщенного пара при данной температуре. ДНП растет с температурой. Когда ДНП становится равным внешнему давлению, жидкость закипает. Пример.Вычислим давление пара при 373 К (1000С) над водным раствором сахарозы, мольная доля которой составляетNB=1,01∙10-3, для воды рA0=1,013∙105 Па. Согласно уравнению (**) Как следует из полученных данных, над раствором сахарозы происходит весьма незначительное снижение давления насыщенного пара воды по сравнению с чистой водой. Идеальные растворы из двух летучих компонентов. А В А+В рA0рВ0 рA+ рВ Общее давление пара над раствором рбудет равно сумме парциальных давлений его компонентов; для раствора, содержащего компоненты А и В, общее давление р=рА+рВ. На основании уравнения (*), как для компонента А, так и для компонента В, можно считать Общее давление будет равно: (3) (***) Это уравнение характеризует линейную зависимость давления от мольной доли компонента В, что можно отобразить графически. 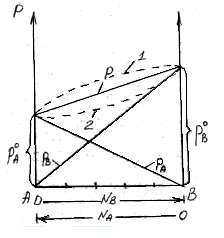 На рисунке по оси ординат слева отложены парциальные давления компонента А, которые изменяются от 0 до рA0, а справа – изменения парциального давления компонента В. Общее давлениеризменяется отрA0 дорВ0.Линейная зависимостьобщего и парциальных давлений от состава растворахарактерна для идеальных и разбавленных растворов(ΔV=0; ΔH=0; ΔS=ΔSи.г). Практически, идеальными свойствами обладает раствор бензола в толуоле, что объясняется незначительностью сия межмолекулярного взаимодействия между молекулами всех компонентов раствора. Поэтому общее давление над раствором бензола в толуоле равно сумме парциальных давлений каждого из компонентов. В случае предельно разбавленных растворов, концентрация растворенного вещества в которых бесконечно мала, давление пара (газа) растворителя выражается в соответствии сзаконом Рауля: Давление паров растворенного вещества, которого в предельно разбавленном растворе ничтожно мало, не подчиняется закону Рауля. В этом случае давление пара над раствором описывается законом Генри, который формулируется так:при постоянной температуре парциальное давление растворенного вещества рГ пропорционально его мольной доле: где КГ – коэффициент пропорциональности, называемыйконстантой Генри(справочная величина), которая зависит от температуры и природы компонентов раствора, но не зависит от давления. Для неидеальных растворов линейная зависимость общего давления от состава раствора нарушается: наблюдается положительное и отрицательное отклонения. Причем, как правило, эти отклонения одного знака как для общего давления р, так и для парциальных давленийрAирВкомпонентов раствора. Положительное отклонениеот закона Раулянаблюдается в том случае, когда в растворе идет диссоциация молекул компонентов в растворе. Такие растворы образуются с поглощением теплоты (ΔH>0), т.е. процесс растворения будет эндотермическим. ΔH>0, fA-A > fA-В 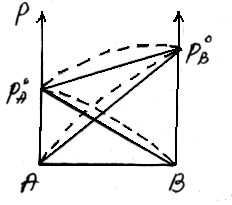 Отрицательное отклонениеот закона Раулянаблюдается в случае ассоциации (укрупнения) частиц, формирующих раствор, и образования более прочных связей. При этом растворение идет с выделением теплоты (ΔH<0), т.е. процесс экзотермический. ΔH<0, fA-A < fA-В 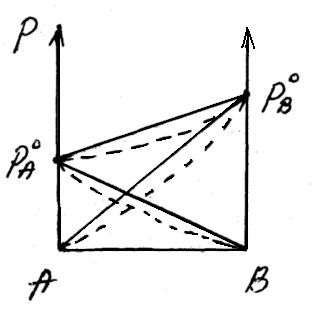 Любая жидкость закипает, когда давление ее пара становится равным атмосферному давлению. Так как, согласно закону Рауля, давление пара над раствором ниже давления пера над чистым растворителем, то для того, чтобы раствор закипел, его надо нагреть до более высокой температуры, чем растворитель. Замерзает раствор тогда, когда давление насыщенного пара его становится равным давлению насыщенного пара твердого растворителя (льда). Таким образом, раствор кипит при более высокой температуре, а замерзает при более низкой температуре, чем чистый растворитель. Повышение температуры кипения (ΔТкип) и понижение температуры замерзания (∆Тзам) раствора прямо пропорционально моляльной концентрации растворенного вещества (следствие закона Рауля): ∆Тзам = КТ ∙ сm(B); ∆Ткип = ЭТ ∙ cm(B), где ∆Тзам – понижение температуры замерзания; ∆Ткип – повышение температуры кипения; КТ - криоскопическая константа; ЭТ – эбулиоскопическая константа; cm(B) – моляльная концентрация раствора. Заменив в уравнениях cm(B) его выражением по формуле для моляльной концентрации получим: ∆Тзам = М (С6 Н12 О 6) = 180 г/моль. По формуле (5.1.2) определим моляльность раствора: с m = 54•1000/180•250 = 1,2 моль / 1000 ã в оды. По формуле: ∆t крист = К кр •с m находим: ∆tкрист = 1,86•1,20 = 2,23°. Следовательно раствор будет кристаллизоваться при - 2,23 °С |
