Ответы на вопросы по химии 1 курс. Экзамен ХИМИЯ. 1 билет
 Скачать 2.97 Mb. Скачать 2.97 Mb.
|
38 билет если исходные концентрации [СО] = 3 моль/л, [Н2O] = 2 моль/л. 39 билетV=k[H2O] чтобы скорость возросла в 100 раз надо давление увеличить в 100 раз при условии что вода в виде паров , если в жидком состоянии , то давление не влияет на скорость реакции. 40 билетКр=[CO2]^2 / ( [CO]^2 * [O2]) = 0,1^2 / (0,2^2 *0,1) =... Сисх= С равн + С реаг. в момент равновесия [CO2=0,1 моль/л, значит СО прореагировало 0,1 моль, а О2 0,05 моль ( см.стех. к-ты) Сисх(СО)=0,2+0,1=0,3 моль/л Сисх(О2)=0,1+0,05=0,15 моль/л 41 билетhttp://buzani.ru/zadachi/khimiya-glinka/1145-konstanta-ravnovesiya-reaktsii-zadachi-366-368 вместо 10 градусов 50 градусов 42 билетI Теоретическая часть
На поверхности раздела фаз наблюдается различные поверхностные явления.
Фаза – однородная часть гетерогенной системы, которая имеет одинаковый химический состав и одинаковые значения термодинамических параметров. Границы раздела фаз бывают: 1. подвижные – газ– жидкость и жидкость – жидкость 2. неподвижные газ- – твердое тело, жидкость – твердое тело, твердое тело – твердое тело. 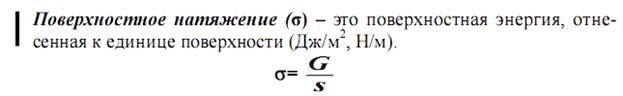 G – свободная поверхностная энергия. Сорбция и ее виды Сорбция (от латин. «sorbeo» - поглощаю, втягиваю)– гетерогенный процесс самопроизвольного поглощения твердым телом или жидкостью (сорбентом) веществ (сорбтива) из окружающей среды. В зависимости от степени прочности связывания сорбтива сорбентом сорбция может быть обратимой и необратимой. Если она является обратимой (что бывает чаще), то в системе устанавливается равновесие, которое характеризуется константой сорбционного равновесия (Кс). 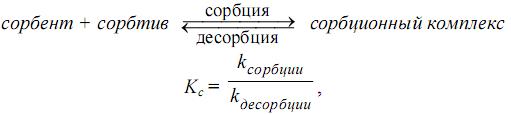 В зависимости от механизма сорбции различают: - адсорбцию (поглощение поверхностью). Адсорбция уменьшается с повышением температуры. Адсорбироваться могут любые вещества. - абсорбцию (поглощение в объеме). Примером процесса абсорбции являются растворение газов в жидкостях. - хемосорбцию (поглощение, сопровождаемое протеканием химических реакций). Например, поглощение NH3 или хлористого водорода водой, поглощение влаги и кислорода металлами с образованием оксидов и гидроксидов, поглощение диоксида углерода оксидом кальция. - капиллярную конденсацию – переход поглощаемого газа или пара в жидкое состояние в узких порах адсорбента (т.е. ожижение паров в микропористых сорбентах). - Во многих случаях все эти виды сорбции наблюдаются одновременно. В качестве сорбента используют твердые фазы с высокоразвитой поверхностью – активированный уголь, кремнезем (силикагель), оксиды и гидроксиды металлов, их соли, синтетические полимерные вещества и др. ПАВ – поверхностно-активные вещества – это вещества,, понижающие поверхностное натяжение или согласно уравнению Гиббса, обладающие положительной адсорбцией. Их молекулы дифильны, т.е. содержат одновременно полярную группу (-ОН, - СООН, -NH2, -SO3H и др.) и неполярную углеводородную цепь (с тр. 244 Зеленин) Адсорбция зависит от природы и удельной поверхности адсорбента, концентрации и природы адсорбтива, природы растворителя, а также температуры (стр.781, Попков). 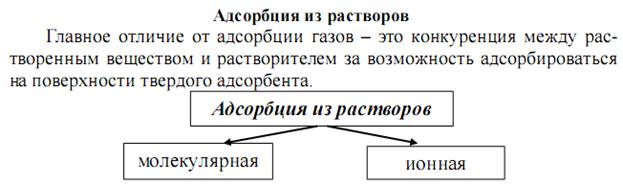 Слесарев стр. 692.   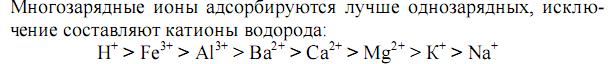   Слесарев стр. 695  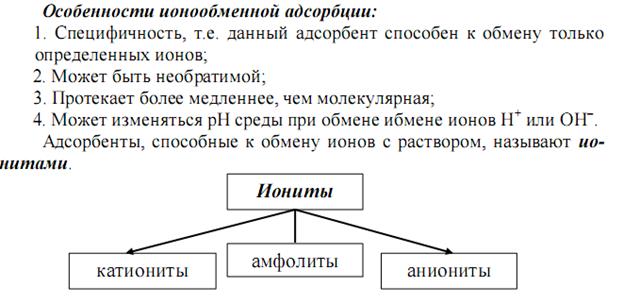  Ионнобменные реакции выражается уравнениями6 Для катионита - Для анионита - Активность ионитов –поглощающая способность, характеризующаяся обменной ёмкостью, -количеством ионов (моль), связанных 1 г сухого ионита из раствора в равновесных условиях. |

