практические навыки по микробиологии. 1. микроскопические методы исследования цели задачи виды микроскопии и их применение в микробиологической диагностике
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
15.2 Основные задачи РДП: –обнаружение в сыворотке крови S антител, гомологичных данному антигену AS (например, вирусу), производится при помощи схемы РДП, показанной на рисунке 52. Если в сыворотке S содержатся антитела к антигену AS, между лунками S и AS образуется полоса преципитации, отсутствующая между лунками с контрольными компонентами SN и AS; – обнаружение в материале антигена AS, гомологичного известным антителам сыворотки SS, производится по аналогичной схеме РДП (рис. 53). При наличии в исследуемом материале антигена, гомологичного антителам сыворотки SS, между А и SS должна образоваться полоса преципитации, отсутствующая между остальными лунками; Рисунок 33. Схема РДП для идентификации вируса 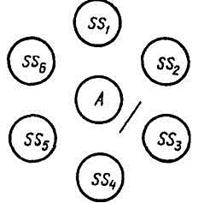 15.2 Основные задачи РДП: –обнаружение в сыворотке крови S антител, гомологичных данному антигену AS (например, вирусу), производится при помощи схемы РДП, показанной на рисунке 52. Если в сыворотке S содержатся антитела к антигену AS, между лунками S и AS образуется полоса преципитации, отсутствующая между лунками с контрольными компонентами SN и AS; – обнаружение в материале антигена AS, гомологичного известным антителам сыворотки SS, производится по аналогичной схеме РДП (рис. 53). При наличии в исследуемом материале антигена, гомологичного антителам сыворотки SS, между А и SS должна образоваться полоса преципитации, отсутствующая между остальными лунками; Постановка РДП.Техника постановки состоит в следующем. Обезжиренные предметные стекла укладывают горизонтально на холодную поверхность (можно на стол). Пипеткой набирают 1,5– 2 мл агара, нагретого до 60 °С, и зигзагообразным движением выливают его сначала по периметру предметного стекла, а потом быстро заполняют его середину, следя за тем, чтобы не образовывались пузыри и волны. Стекла с налитым агаром, слой которого должен быть 1,5–2 мм, оставляют лежать 5–10 мин для'затвердения агара (превращения золя в гель). В слое застывшего агара вырезают лунки. Их количество и взаимное расположение определяются целью, с которой ставят РДП, но диаметр лунок должен быть около 5 мм, а расстояние между соседними лунками – 3–4 мм. Наиболее часто используют два типа расположения лунок. Для вырезания лунок можно использовать готовый штамп, представляющий собой трубочки с острыми краями, жестко скрепленные в соответствии с типом расположения и количеством лунок. Если готового штампа нет, можно воспользоваться любой трубкой подходящего диаметра, например гильзой от патрона к мелкокалиберной (калибр 5,6) винтовке. В этом случае целесообразно нарисовать карандашом на бумаге количество и взаимное расположение лунок и, подложив этот трафарет под стекло с агаром, по нему вырезать лунки. Остающийся в лунках агар можно извлечь иглой, ученическим пером или пастеровской пипеткой. У образовавшихся лунок дном служит стекло, а стенками – слой агара. Чтобы избежать подтекания жидкостей под агар, рекомендуют лунки заплавить, с тем чтобы они были полностью в слое агара. Для этого можно воспользоваться разными приемами. Один из них состоит в том, что пастеровской пипеткой в лунку вносят горячий (50–60 °С) агар и тотчас отсасывают его обратно. Соприкасаясь на короткое время с холодным дном и стенками лунки, агар успевает частично застыть и покрыть тонким слоем дно и стенки лунки. Схематически это выглядит так, как показано на рисунке 34. Однако если стекла хорошо обезжирены и застывший слой агара прочно сцеплен со стеклом (не «плывет» при наклоне), то и без дополнительной заливки лунок полосы преципитации образуются нормально. В подготовленные лунки заливают компоненты РДП (антигены и сыворотки). Нужно следить, чтобы компоненты ни в коем случае не переливались через край лунок, а только заполняли объем каждой. Для этого их лучше заливать мелкими каплями с помощью тонко оттянутых пастеровских пипеток. После заливки компонентов РДП предметные стекла помещают во влажную камеру, чтобы предотвратить высыхание агара. В качестве влажной камеры можно использовать любую закрывающуюся емкость (эксикатор, чашку Петри и т. п.), в которую положены намоченные водой вата или фильтровальная бумага. Влажную камеру оставляют при комнатной температуре или ставят в термостат (в термостате диффузия идет быстрее, но незначительно). Предварительный учет результатов РДП производят через 8–10 ч, основной – через 24 и окончательный – через 48 ч. Постановка РДП в чашках Петри по технике принципиально не отличается от постановки на предметных стеклах, только тогда слой агара наливают толщиной до 3 мм, лунки делают большего диаметра и на большем расстоянии. Но в этом случае время учета отодвигается до 5–7 дней. Методика РДП в капиллярах не нашла широкого применения в практике, и на ней мы останавливаться не будем. Препараты РДП на предметных стеклах можно через. 48–72 ч высушить и окрасить раствором амидного черного. Это позволяет сохранять препарат неопределенно долго и улучшает возможности фотографировать полосы преципитации. Достоинства РДП следующие: простота техники постановки, быстрота получения ответа, нетребовательность к чистоте компонентов, не требуется стерильной работы, минимальная потребность в компонентах, пригодность для работы с любыми растворимыми антигенами, возможность документирования результата путем фотографирования. Но все эти достоинства существенно умаляются ее основным недостатком – низкой чувствительностью. Тем не менее РДП д В подготовленные лунки заливают компоненты РДП (антигены и сыворотки). Нужно следить, чтобы компоненты ни в коем случае не переливались через край лунок, а только заполняли объем каждой. Для этого их лучше заливать мелкими каплями с помощью тонко оттянутых пастеровских пипеток. Рисунок 34. Схема зливки агара После заливки компонентов РДП предметные стекла помещают во влажную камеру, чтобы предотвратить высыхание агара. В качестве влажной камеры можно использовать любую закрывающуюся емкость (эксикатор, чашку Петри и т. п.), в которую положены намоченные водой вата или фильтровальная бумага. Влажную камеру оставляют при комнатной температуре или ставят в термостат (в термостате диффузия идет быстрее, но незначительно). Предварительный учет результатов РДП производят через 8–10 ч, основной – через 24 и окончательный – через 48 ч. Постановка РДП в чашках Петри по технике принципиально не отличается от постановки на предметных стеклах, только тогда слой агара наливают толщиной до 3 мм, лунки делают большего диаметра и на большем расстоянии. Но в этом случае время учета отодвигается до 5–7 дней. Методика РДП в капиллярах не нашла широкого применения в практике, и на ней мы останавливаться не будем. Препараты РДП на предметных стеклах можно через. 48–72 ч высушить и окрасить раствором амидного черного. Это позволяет сохранять препарат неопределенно долго и улучшает возможности фотографировать полосы преципитации. Достоинства РДП следующие: простота техники постановки, быстрота получения ответа, нетребовательность к чистоте компонентов, не требуется стерильной работы, минимальная потребность в компонентах, пригодность для работы с любыми растворимыми антигенами, возможность документирования результата путем фотографирования. Но все эти достоинства существенно умаляются ее основным недостатком – низкой чувствительностью. Тем не менее РДП достаточно широко пользуются в лабораторной диагностике вирусных болезней животных. остаточно широко пользуются в лабораторной диагностике вирусных болезней животных. 3  3. реакция связывания комплемента 3. реакция связывания комплемента 33. РСК используется чаще для серодиагностики (обнаружения антител к возбудителю заболевания в сыворотке крови больного) гонореи, сифилиса, коклюша, сыпного тифа и др. риккетсиозов и многих вирусных заболеваний.РСК также используется для сероидентификации. Компоненты РСК. 1. Антиген– экстракты микробов, гаптены, реже – взвесь микробов, т.е. антиген может быть как корпускулярным (нерастворимым), так и молекулярным (растворимым). 2. Антитело – сыворотка крови больного человека (при серодиагностике) или иммунная диагностическая сыворотка, содержащая известные антитела (при сероидентификации). 3. Эритроциты барана – антигены гемолитической реакции. 4. Гемолитическая сыворотка – сыворотка, содержащая антителак эритроцитам барана. Сыворотку получают путем иммунизации кролика эритроцитами барана. 5. Комплемент– свежеприготовленная сыворотка крови морских свинок (жидкая или лиофильно высушенная). 6. Электролит – изотонический раствор хлорида натрия. Постановка РСК. Перед постановкой опыта антиген, сыворотка больного, гемолитическая сыворотка и комплемент титруются (определяется их титр). Сыворотка больного прогревается при 56°С в течение 30 мин. РСК проводят в 2 фазы. I фаза – специфическая: в одной пробирке готовят специфическую систему - смешивают равные количества известного антигена, сыворотки больного и комплемента, в другой пробирке готовят гемолитическую систему – смесь эритроцитов барана и гемолитической сыворотки, пробирки ставят в термостат при 37°С на 30 мин. Одновременно готовят контроли на антиген, комплемент и гемосистему, контрольные пробы с сывороткой заведомо больного человека (положительная сыворотка) и заведомо здорового человека (отрицательная сыворотка) и также помещают в термостат на 30 мин. II фаза – индикаторная: в исходную смесь и во все контрольные пробирки добавляют одинаковые количества гемолитической системы и учитывают результаты реакции после выдерживания в термостате 30 мин. Учет результатов РСК проводят при безупречных результатах в контролях. Положительная реакция(человек болен и в его сыворотке имеются соответствующие антитела к возбудителю заболевания - антигену): в I фазе в специфической системе образуются комплексы антиген-антитело, с которыми связывается комплемент, после добавления гемолитической системы во II фазе гемолиз не наблюдается, так как комплемент связан 1-ой специфической системой. Видимый эффект– образование осадка эритроцитов. Отрицательная реакция(человек здоров и в его сыворотке нет антител к возбудителю заболевания): комплексов антиген-антитело не образуется и комплемент в I фазе остается свободным, после добавления гемолитической системы во II фазе комплемент связывается с обязательно имеющимися здесь комплексами антиген-антитело (это комплексы эритроциты-антиэритроцитарные антитела) и вызывает гемолиз эритроцитов. Видимый эффект – гемолиз эритроцитов – "лаковая кровь". 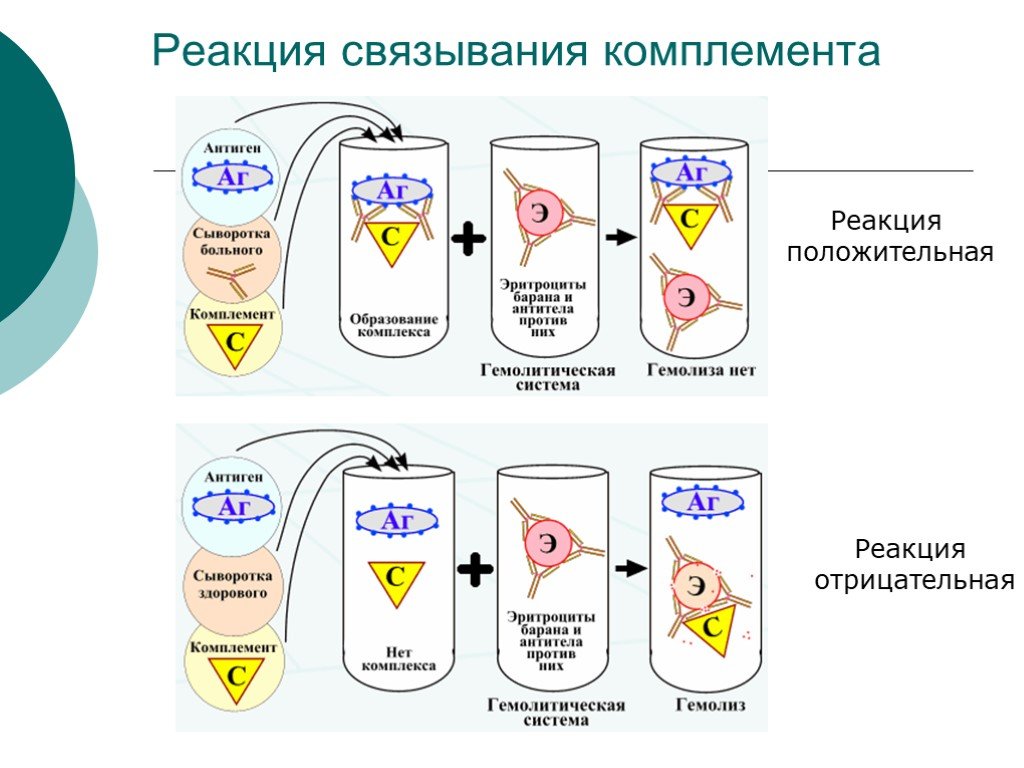 34. Реакция иммунофлюоресценции. Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических АГ с помощью АТ, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью. Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения АТ и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток. Различают три разновидности метода: прямой, непрямой, с комплементом. Исследуемый материал(в нем ищут АГ) Люминисцирующая сыворотка(АТ к АГ,меченные ФИТЦ) Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе. АГ бактерий(диагностикум) Сыворотка пациента(АТ) Антиглобулиновая сыворотка, меченная ФИТЦ Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими антителами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии. 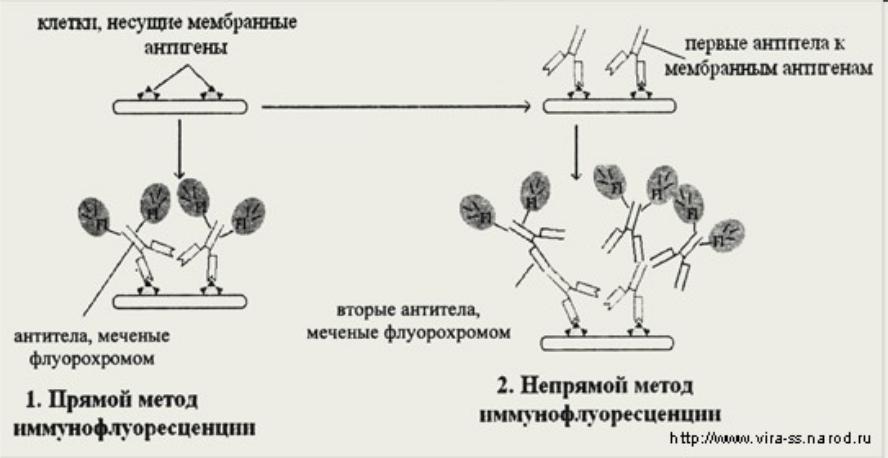 35. Полимеразная цепная реакция Полимеразная цепная реакция – метод, позволяющий провести многократное увеличение (амплификацию) количества определенных молекул ДНК в анализируемом образце (в том числе в биологическом материале или чистой культуре). Главные преимущества ПЦР как диагностического метода в микробиологии – очень высокая чувствительность, позволяющая обнаружение крайне малых концентраций возбудителей в образцах, а также регулируемая специфичность, позволяющая обнаруживать или идентифицировать возбудителей на родовом, видовом или субвидовом уровне. Проведение ПЦР. Готовится реакционная смесь, содержащая следующие компоненты: Выделенную ДНК из исследуемого образца, Буферный раствор, Ионы Mg2+ (необходимы для работы фермента), Два праймера – одноцепочечныекороткие молекулы ДНК (длина чаще всегоот 18 до 24 нуклеотидов), комплементарные концам разных цепей обнаруживаемой последовательности ДНК. Смесь дезоксинуклеотидтрифосфатов. Термостойкую ДНК-полимеразу (чаще всего используется Taq-полимераза – полимераза, выделенная из Thermus aquaticus ). Затем данная реакционная смесь помещается в амплификатор, который фактически представляет собой программируемый термостат. В амплификаторе проводится 30-40 циклов смены температур. Каждый из этих циклов состоит из трех этапов (см. Рис. 1): Денатурация (температура 94оС) – разрываются водородные цепи, и цепочки ДНК расходятся. Отжиг праймеров (температура обычно в районе 50-60оС) – к концам цепей ДНК присоединяются праймеры. Вообще, при снижении температуры энергетически выгоднее воссоединение исходных цепей ДНК из исследуемого образца (ренатурация), однако концентрация праймеров в реакционной смеси на много порядков больше концентрации ДНК из образца (по крайней мере, на начальных циклах ПЦР), поэтому реакция отжига праймеров протекает быстрее ренатурации ДНК. Температура отжига выбирается в зависимости от температур плавления (денатурации) праймеров. Элонгация (температура обычно 72оС) – ДНК-полимераза достраивает праймеры по матрице длинных цепей ДНК. Температура соответствует оптимальной температуре работы используемой ДНК-полимеразы. Детекция результатов отличается в различных вариантах постановки ПЦР и описана в разделе «Разновидности ПЦР». Динамика ПЦР +На ранних циклах ПЦР количество двухцепочечных молекул ДНК, размер которых определяется расстоянием между местами посадки праймеров, удваивается с каждым циклом. Также образуется малое количество более длинных молекул ДНК, которым можно пренебречь (см. Рис 2). Таким образом, на ранних циклах количество продукта ПЦР описывается формулой m*2n, где m – исходное количество искомой ДНК в пробе, n – число циклов. Затем реакция выходит на плато. Это происходит из-за накопления продукта реакции, снижения концентрации праймеров и дезоксинуклеотидтрифосфатов, а также за счет повышения концентрации пирофосфата (см. Рис 3). Разновидности ПЦР Конвенциональная ПЦР В данном варианте постановки ПЦР реакция идет заранее выбранное число циклов (30-40), после чего анализируется, произошло ли накопление двуцепочечных молекул ДНК в реакционной смеси. Положительная реакция свидетельствует о наличии хотя бы следовых количеств искомых молекул ДНК в образце. Отрицательная реакция свидетельствует об их отсутствии. Количественная оценка содержания исходных молекул ДНК в образце невозможна из-за выхода реакции на плато. Основным методом выявления наличия продукта является электрофорез в агарозном или полиакриламидном геле. Продукты ПЦР разделяются в геле под действием электрического поля в соответствии с их молекулярной массой. В гель добавляется интеркалирующий краситель (флуоресцирующий в связанном с двухцепочечной ДНК состоянии - чаще всего бромистый этидий). Таким образом, при облучении ультрафиолетом можно будет увидеть наличие или отсутствие полоски, соответствующей ДНК необходимой молекулярной массы. При проведении ПЦР в диагностических целях всегда ставятся положительный и отрицательный контроли реакции, с которыми сравниваются образцы (см. Рис. 4). ПЦР в реальном времени В данном варианте постановки ПЦР количество продукта ПЦР в реакционной смеси регистрируется постоянно в ходе протекания реакции. Это позволяет построить кривую протекания реакции (см. Рис. 3) и, исходя из неё, рассчитать количество искомых молекул ДНК в образцах. |
