практические навыки по микробиологии. 1. микроскопические методы исследования цели задачи виды микроскопии и их применение в микробиологической диагностике
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Один из видов проведения ПЦР в реальном времени – с использованием интеркалирующегокрасителя, который добавляется прямо в реакционную смесь (чаще всего используется SYBRGreen). Другой вид – с использованием одного из видов флуоресцирующих зондов, связывающихся с участком внутри ПЦР-продукта, что позволяет повысить специфичность обнаружения (см. Рис 5).Детекция флуоресценции происходит непосредственно в приборе в ходе протекания реакции. Помимо возможности количественного обнаружения, существуют и другие достоинства ПЦР в реальном времени по сравнению с конвенциональной. Данный вариант ПЦР более прост, быстр, а также не требует открывания пробирок с продуктами ПЦР, что уменьшает вероятность загрязнения других образцов. Основной недостаток – более высокая стоимость амплификатора со встроенной возможностью детекциифлуоресценции по сравнению с обычным. Цифровая количественная ПЦР Новый, дорогостоящий и пока малораспространенный вариант ПЦР, позволяющий более точно определять количество ДНК в образце.В данном варианте реакционная смесь, содержащая флуоресцентный краситель, разбивается на огромное число микроскопических объемов (например, капелек в эмульсии). После протекания ПЦР анализируется, в какой доле капелек реакция оказалась положительной и, соответственно, наблюдается флуоресценция. Эта доля будет пропорциональна числу искомых молекул ДНК в образце. ПЦР с обратной транскрипцией В 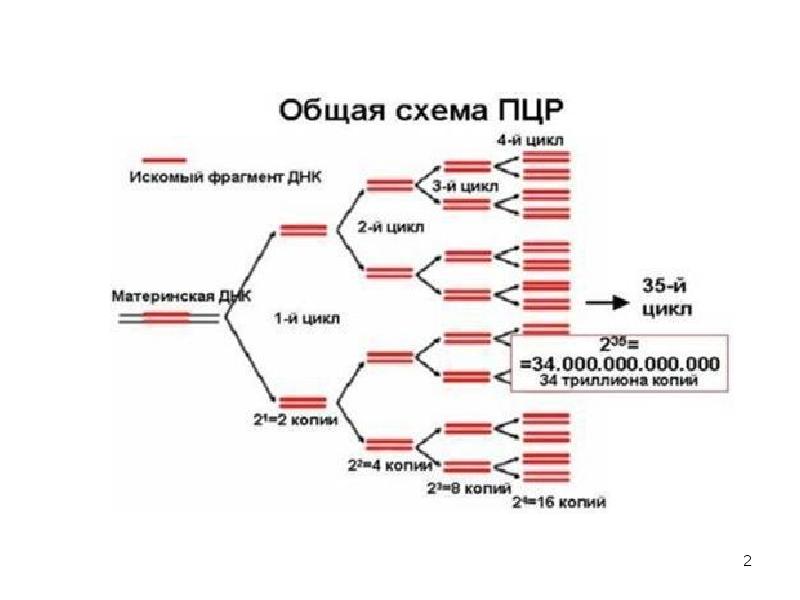 данном случае перед тем или иным вариантом ПЦР производится реакция обратной транскрипции (РНК в ДНК) с использованием фермента ревертазы. Таким образом, этот метод позволяет проводить качественное или количественное обнаружение молекул РНК. Это может использоваться для детекции РНК-содержащих вирусов или определения уровня транскрипции (количества мРНК) того или иного гена. данном случае перед тем или иным вариантом ПЦР производится реакция обратной транскрипции (РНК в ДНК) с использованием фермента ревертазы. Таким образом, этот метод позволяет проводить качественное или количественное обнаружение молекул РНК. Это может использоваться для детекции РНК-содержащих вирусов или определения уровня транскрипции (количества мРНК) того или иного гена.36. Реакция нейтрализации основана на способности специфических вируснейтрализующих антител блокировать инфекционные, гемагглютинирующие, гемадсорбирующие, цитопатические, бляшкообразующие и др. свойства вирусов. Она применяется в двух направлениях: 1) для идентификации вирусов;2) для серодиагностики вирусных инфекций, т.е. для определения нарастания титра вируснейтрализующих антител в «парных» сыворотках. Компоненты:1. Исследуемый вирус (при идентификации выделенною вируса) или исследуемая сыворотка (при серодиагностике инфекции). Диагностическая сыворотка (при идентификации вируса) или известный вирус — диагностикум (при серодиагностике). Индикаторный объект: животные, куриные эмбрионы, культуры тканей или эритроциты. Реакции нейтрализации ставят в культурах клеток, куриных эмбрионах и на лабораторных животных!. Принцип. Смесью вирус (исследуемый или известный) + сыворотка (диагностическая или исследуемая), Смеси инкубируют в термостате при температуре 37 °С в течение 1—2 ч. После этого смесями заражают культуру клеток, куриный эмбрион или лабораторное животное. При (+} реакции, т.е. при нейтрализации вируса антителами индикаторные объекты продолжают нормально существовать, устранению летального действия вируса на животных. в контроле — гибель или характерные изменения.развития патологических изменений на хорионаллантоисной оболочке; нейтрализации вирусных гемагглютининов в жидкостях эмбриона; В серодиагностике вирусных инфекций РН определяют вируснейтрализующие антитела в сыворотке больных по известному вирусу. Ставят ее в динамике с парными сыворотками, одну из которых берут в разгаре заболевания, а вторую — спустя 2—3 недели, и по четырехкратному нарастанию титра антител в этой последней подтверждают диагноз. 37. реакция торможения гемагглютинации (РТГА)-метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови. Реакция торможения гемагглютинации. Механизм и практическое использование. Для обнаружения в материале больных или культурах клеток, эмбрионов и животных ставят реакцию гемагглютинации (РГА). Для этого в лунках планшетов готовят двукратно возрастающие разведения вируссодержащих материалов и жидкостей, добавляя к ним отмытые изотоническим раствором взвеси NaCl эритроцитов. Для контроля спонтанной агглютинации эритроциты смешивают ещё с равным объемом изотонического раствора NaCl. Смеси инкубируют в термостате при температуре 37°С или при комнатной температуре. Результаты РГА учитывают по характеру агглютинации эритроцитов через 30–60 мин, когда они обычно полностью осаждаются в контроле. Положительная реакция обозначается плюсами. «++++» –осадок в виде «зонтика», «+++» – осадок с просветами, «++» – осадок с большими просветами, «+» –хлопьевидный осадок, окруженный зоной скомкованных эритроцитов, и Отрицательная реакция» – такой же резко очерченный осадок эритроцитов в виде «пуговицы», как и в контроле Являясь группоспецифической, РГА не дает возможности определить видовую принадлежность вирусов. Их идентифицируют с помощью реакции торможения гемагглютинации(РТГА). Вирусоседержащая жидкость Специфическая противовирусная жидкость эритроциты Механизм.Для ее постановки используют заведомо известные иммунные противовирусные сыворотки, которые в двукратно снижающихся концентрациях разводят в изотоническом растворе натрия хлорида и разливают по лункам. К каждому их разведению добавляют равное количество вируссодержащей жидкости. Контролем является взвесь вируса в изотоническом растворе натрия хлорида. Планшеты со смесью сывороток и вируса выдерживают в термостате 30 мин или при комнатной температуре 2 ч, затем в каждую из них добавляют взвесь эритроцитов. Спустя 30 мин определяют титр вируснейтрализующей сыворотки (т.е. максимальное ее разведение), вызвавшей задержку агглютинации эритроцитов. Используют РТГА в серологической диагностике вирусных болезней, в частности гриппа и аденовирусных инфекций. Ставить ее лучше так же, как и РН, с парными сыворотками. Четырехкратное нарастание титра антител во второй сыворотке подтверждает предполагаемый диагноз.Серологическое исследование позволяет поставить диагноз в случае обнаружения специфических антител в сыворотке больных. 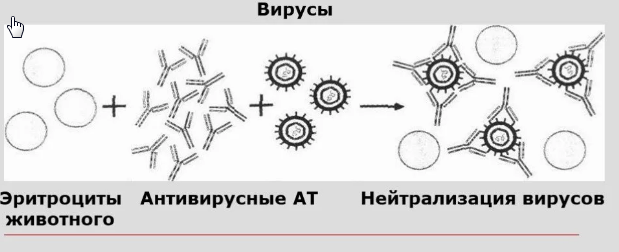 38. Принцип радиоиммунологического анализа (РИА) -основан на выявлении комплекса АГ-АТ, в котором один из иммунореагентов был мечен радиоактивным изотопом. Обычно используют изотопы йода (125I или131I). Учет реакции проводят по убыванию или по возрастанию радиоактивности (в зависимости от методики РИА) с помощью специальных счетчиков- или-излучения. Метод высокочувствителен, но постепенно вытесняется иммуноферментным анализом, учитывая небезопасность работы с радиоактивными изотопами и необходимость в сложном регистрирующем оборудовании. Однако там, где в качестве АГ выступает низкомолекулярный гаптен (например, лекарственные препараты, стероидные и пептидные гормоны и др.) РИА используется весьма широко. Существуют его гетерогенные варианты, аналогичные ИФА, а также конкурентные варианты. Компоненты: Антиген(материала) Меченный Стандартный антиген Антитело Механизм.В последнем случае на твердую фазу (например, полистироловые шарики) сорбируют известные АТ в комплексе с радиоактивно меченым АГ (например, лекарственным препаратом) в известной концентрации. К этому комплексу добавляют исследуемый материал, содержащий неизвестную концентрацию изучаемого лекарственного препарата-АГ. Он вытесняет из комплекса меченый АГ пропорционально своей концентрации. Радиоактивность вытесненного АГ измеряют с помощью счетчика и определяют концентрацию неизвестного АГ. 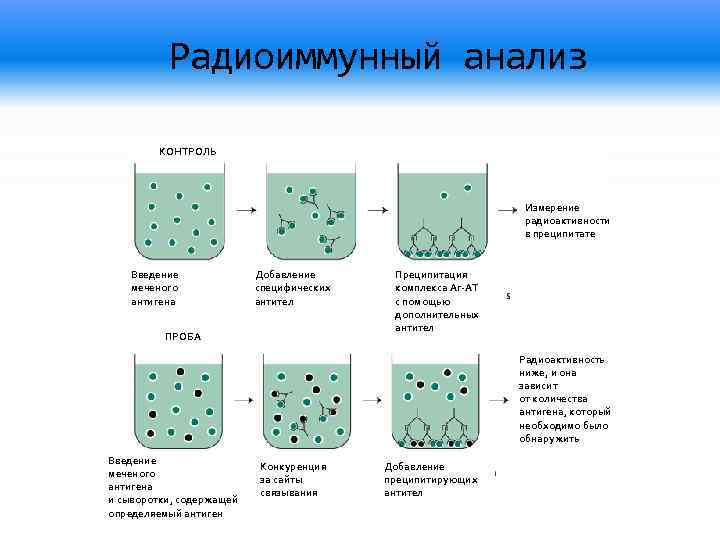 39.Иммуноферментный анализ Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов конъюгирован с ферментом, в результате реакции с соответствующим хромогенным субстратом образовывается окрашенный продукт, количество которого можно определить спектрофотометрически. Компоненты: Антитела Исследуемая сыворотка с АГ АТ меченные ферментом (пероксидазой) Перекись водорода и хромоген Сначала на стенках полистироловых пробирок сорбируют АТ против определенного АГ. В эту же пробирку вносят исследуемую сыворотку (или другой биологический субстрат). Если там содержатся искомые АГ, они взаимодействуют с АТ и вместе с ними фиксируются на стенках пробирки. После этого в пробирку вводят АТ к данному АГ, меченные ферментом, которые также присоединяются к образовавшемуся иммунному комплексу и остаются на стенках пробирки. Для обнаружения и количественной оценки этих комплексов в пробирку добавляют перекись водорода (Н202) и хромогены. Фиксированный к стенке пробирки фермент (пероксидаза) разлагает Н202 с выделением кислорода. Последний окисляет хромоген, который приобретает желтый цвет. Интенсивность окрашивания и количество искомого АГ оценивают спектрофотометрически или визуально. Наиболее распространен твердофазный ИФА основанный на том, что один из компонентов иммунной реакции (АГ или АТ) сорбирован на твердом носителе. Компоненты: Сыворотка с АГ Антиглобулиновая сыворотка.меченная ферментом Перекись с хромогеном (иммунная сыворотка,меченная ферментом) В 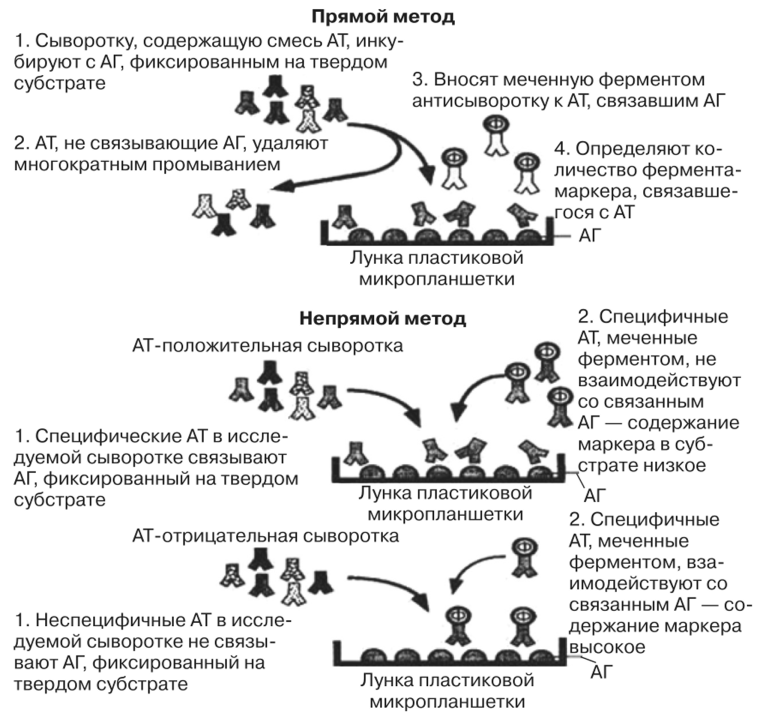 качестве твердого носителя используются микропанели из полистирола. При определении АТ в лунки с сорбированным АГ последовательно добавляют сыворотку крови больных, антиглобулиновую сыворотку, меченную ферментом, и смесь растворов субстрата для фермента и хромогена. Каждый раз после добавления очередного компонента путем тщательного промывания из лунок удаляют не связавшиеся реагенты. При положительном результате изменяется цвет раствора хромогена. Твердофазный носитель можно сенсибилизировать не только АГ, но и АТ. Тогда в лунки с сорбированными АТ вносят искомый АГ, добавляют иммунную сыворотку против АГ, меченную ферментом, а затем смесь растворов субстрата для фермента и хромогена. ИФА применяют для диагностики заболеваний, вызванных вирусными и бактериальными возбудителями. качестве твердого носителя используются микропанели из полистирола. При определении АТ в лунки с сорбированным АГ последовательно добавляют сыворотку крови больных, антиглобулиновую сыворотку, меченную ферментом, и смесь растворов субстрата для фермента и хромогена. Каждый раз после добавления очередного компонента путем тщательного промывания из лунок удаляют не связавшиеся реагенты. При положительном результате изменяется цвет раствора хромогена. Твердофазный носитель можно сенсибилизировать не только АГ, но и АТ. Тогда в лунки с сорбированными АТ вносят искомый АГ, добавляют иммунную сыворотку против АГ, меченную ферментом, а затем смесь растворов субстрата для фермента и хромогена. ИФА применяют для диагностики заболеваний, вызванных вирусными и бактериальными возбудителями. 40.Реакция иммунного болтинга Иммуноблотинг [от англ. blot, пятно] — метод идентификации Аг (или AT) с помощью соответствующих известных сывороток (или Аг). На практике применяют для идентификации Аг ВИЧ. Компоненты: Полоски с «блотами» антигенов Сыворотка больного Антииммунноглобулиновая сыворотка,меченная ферментовм хромоген Первоначально электрофорезом в полиакриловом геле выделяют Аг вируса (на практике эту процедуру не проводят, а используют коммерческий реагент). Затем на полосы преципитата накладывают носитель (нитроцеллюлозную плёнку или активированную бумагу) и продолжают электрофорез. После чего на плёнку наносят сыворотку пациента и инкубируют. После отмывания несвязавшихся AT (при их наличии) проводят ИФА — на плёнку наносят антисыворотку к Ig человека, меченную ферментом, и хромогенный субстрат, изменяющий окраску при взаимодействии с ферментом. При наличии комплексов Аг-АТ-антисыворотка к lg на носителе появляются окрашенные пятна. |
