Биохимия итоговая. Итоговая работа 2 по БХ (занятие 10). 1. Общая схема распада нуклеиновых кислот пищи, ферменты, субстраты, продукты
 Скачать 1.5 Mb. Скачать 1.5 Mb.
|
|
ДНК-полимераза δ – олигонуклеотид, синтезированный ДНК-полимеразой α и образующий небольшой двухцепочечный фрагмент с матрицей, позволяет присоединиться ДНК-полимеразе δ и продолжить синтез новой цепи в направлении от 5'- к 3'-концу по ходу раскручивания репликативной вилки. ДНК-полимераза δ последовательно наращивает цепь, шаг за шагом присоединяя к ней соответствующие дезоксинуклеотиды. Выбор ДНК-полимеразой δ очередного нуклеотида определяется матрицей. Включение дезоксирибонуклеозидмонофосфатов в растущую цепь ДНК сопровождается гидролизом макроэргических связей соответствующих нуклеозидтрифосфатов и отщеплением пирофосфата (Н4Р2О7). Энергия макроэргических связей расходуется на образование 3',5'-фосфодиэфирной связи между последним нуклеотидом растущей цепи ДНК и присоединяемым нуклеотидом. В каждой репликативной вилке идёт одновременно синтез двух новых (дочерних) цепей. Направление синтеза цепи ДНК совпадает с направлением движения репликативной вилки лишь для одной из вновь синтезируемых цепей (лидирующая цепь). На второй матричной цепи синтез дочерней ДНК осуществляется двумя ферментами: ДНК-полимеразой α и ДНК-полимеразой ε в направлении 5'→3', но против движения репликативной вилки. Поэтому вторая цепь синтезируется прерывисто, короткими фрагментами, которые называют "фрагменты Оказаки" (по имени открывшего их исследователя). Дочерняя цепь ДНК, синтез которой происходит фрагментами, называют отстающей цепью. Каждый фрагмент Оказаки, примерно 100 нуклеотидных остатков, содержит праймер. Праймеры удаляет ДНК-полимераза β, постепенно отщепляя с 3'-конца фрагмента по одному ри-бонуклеотиду. К ОН-группе на 3'-конце предыдущего фрагмента ДНК-полимераза β присоединяет дезоксирибонуклеотиды в количестве, равном вырезанному праймеру и таким образом заполняет брешь, возникающую при удалении рибонуклеотидов. Фермент ДНК-лигаза катализирует образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы одного фрагмента цепи ДНК и 5'-фосфатом следующего фрагмента. Реакция протекает с затратой энергии АТФ. Таким образом, из множества фрагментов Оказаки образуется непрерывная цепь ДНК. 11. Теломерная ДНК. Синтез теломерной ДНК. 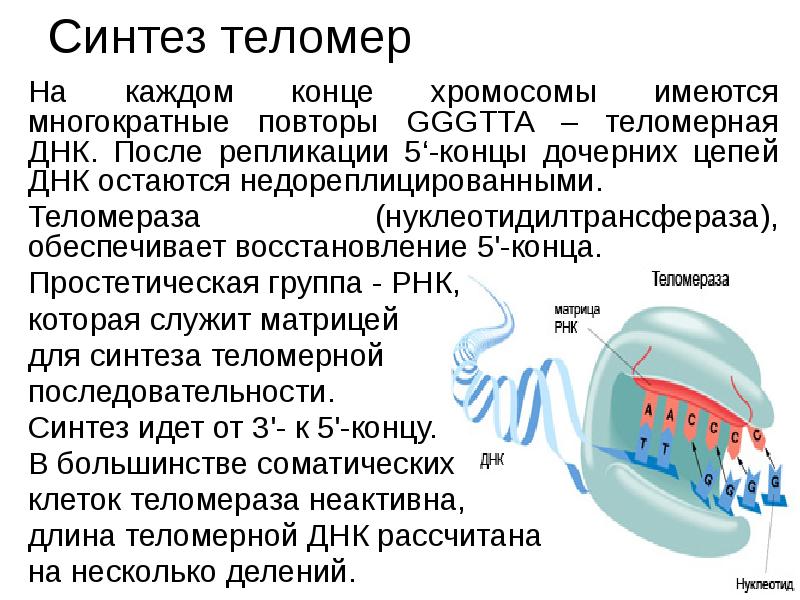 12. Повреждения и репарация ДНК. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни. Процесс, позволяющий живым организмам восстанавливать повреждения, возникающие в ДНК, называют репарацией. Все репарационные механизмы основаны на том, что ДНК - двухцепочечная молекула, т.е. в клетке есть 2 копии генетической информации. Если нуклеотидная последовательность одной из двух цепей оказывается повреждённой (изменённой), информацию можно восстановить, так как вторая (комплементарная) цепь сохранена. Процесс репарации происходит в несколько этапов. На первом этапе выявляется нарушение комплементарности цепей ДНК. В ходе второго этапа некомплементарный нуклеотид или только основание устраняется, на третьем и четвёртом этапах идёт восстановление целостности цепи по принципу комплементарности. Однако в зависимости от типа повреждения количество этапов и ферментов, участвующих в его устранении, может быть разным. Очень редко происходят повреждения, затрагивающие обе цепи ДНК, т.е. нарушения структуры нуклеотидов комплементарной пары. Такие повреждения в половых клетках не репарируются, так как для осуществления сложной репарации с участием гомологичной рекомбинации требуется наличие диплоидного набора хромосом. А. Спонтанные повреждения Нарушения комплементарности цепей ДНК могут происходить спонтанно, т.е. без участия каких-либо повреждающих факторов, например в результате ошибок репликации, дезаминирования нуклеотидов, депуринизации. Ошибки репликации Точность репликации ДНК очень велика, но примерно один раз на 105-106 нуклеотидных остатков происходят ошибки спаривания, и тогда вместо пары нуклеотидов А-Т, G-С в дочернюю цепь ДНК оказываются включёнными нук-леотиды, некомплементарные нуклеотидам матричной цепи. Однако ДНК-полимеразы δ, ε способны после присоединения очередного нук-леотида в растущую цепь ДНК делать шаг назад (в направлении от 3'- к 5'- концу) и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной цепи ДНК. Этот процесс исправления ошибок спаривания (или коррекция) иногда не срабатывает, и тогда в ДНК по окончании репликации остаются некомплементарные пары, тем более, что ДНК-полимераза а лишена корректирующего механизма и "ошибается" чаще, чем другие полимеразы. При неправильном спаривании в первичной структуре дочерней цепи ДНК необычные основания не появляются, нарушена только ком-плементарность. Система репарации некомплементарных пар должна происходить только на дочерней цепи и производить замену некомплементарных оснований только в ней. Ферменты, участвующие в удалении неправильной пары нуклеотидов, распознают матричную цепь по наличию метилированных остатков аденина в последовательностях -GATC-. Пока основания нуклеотидных остатков в дочерней цепи неметилированы, ферменты должны успеть выявить ошибку репликации и устранить её. Распознавание и удаление (первый этап) некомплементарного нуклеотида происходят при участии специальных белков mut S, mut L, mut H. Каждый из белков выполняет свою специфическую функцию. Mut S находит неправильную пару и связывается с этим фрагментом. Mut Н присоединяется к метилированному (по аденину) участку -GATC-, расположенному вблизи некомплементарной пары. Связующим между mut S и mut Н служит белок mut L, его присоединение завершает образование активного фермента. Формирование комплекса mut S, mut L, mut Н на участке, содержащем ошибку, способствует проявлению у белка mut Н эндонуклеазной активности. Ферментативный комплекс гидролизует фосфоэфирную связь в неметилированной цепи (рис. 4-21). К свободным концам цепи присоединяется экзонуклеаза (второй этап). Отщепляя по одному нуклеотиду в направлении от 3'- к 5'- концу дочерней цепи, она устраняет участок, содержащий некомплементарную пару. Брешь застраивает ДНК-полимераза β (третий этап), соединение основного и вновь синтезированного участков цепи катализирует фермент ДНК-лигаза (четвёртый этап). Для успешного функционирования экзонуклеазы, ДНК-полимеразы р и ДНК-лигазы необходимо участие в репарации хеликазы и SSB-белков. Депуринизация (апуринизация) ДНК каждой клетки человека теряет за сутки около 5000 пуриновых остатков вследствие разрыва N-гликозидной связи между пурином и дезоксирибозой. Тогда в молекуле ДНК на месте этих оснований образуется участок, лишённый азотистых оснований, названный АП-сайтом (AP-site, или апуриновый сайт). Термин "АП-сайт" используют также в тех случаях, когда из ДНК выпадают пиримидиновые основания и образуются апиримидиновые сайты (от англ, apurinic-apyrimidinic site). Этот тип повреждений устраняет фермент ДНК-инсертаза (от англ, insert - вставлять), который может присоединять к дезоксирибозе основание в соответствии с правилом компле-ментарности. В этом случае нет необходимости разрезать цепь ДНК, вырезать неправильный нуклеотид и репарировать разрыв. Дезаминирование Реакции дезаминирования цитозина и превращение его в урацил, аденина в гипоксантин, гуанина в ксантин происходят значительно реже, чем депуринизация, и составляют 10 реакций на один геном в сутки. Исправление этого вида спонтанного повреждения происходит в 5 этапов. В репарации принимает участие ДНК-N-гликозилаза, гидролизующая связи между аномальным основанием и дезоксирибозой (первый этап), в результате образуется АП-сайт, который распознаёт фермент АП-эндонуклеаза (второй этап). Как только в цепи ДНК возникает разрыв, в работу вступает ещё один фермент - АП-экзонуклеаза, который отщепляет от цепи дезоксирибозу, лишённую основания (третий этап). В цепи ДНК появляется брешь размером в один нуклеотид. Следующий фермент ДНК-полимераза р к З'-концу разорванной цепи присоединяет нуклеотид по принципу комплементарности (четвёртый этап). Чтобы соединить два свободных конца (3'-конец встроенного нуклеотида и 5'-конец основной цепи), требуется ещё один фермент - ДНК-лигаза (пятый этап). Нерепарйруемо и поэтому опасно дезаминирование метилированного цитозина. Продукт его спонтанного дезаминирования - тимин, нормальное для ДНК основание, которое не распознаётся ДНК-N-гликозилазой. Б. Индуцируемые повреждения Индуцируемые повреждения возникают в ДНК в результате воздействия разнообразных мутагенных факторов как радиационной, так и химической природы. Образование димеров пиримидиновых оснований Под действием УФО двойная связь между С5 и С6 атомами углерода в составе пиримидиновых оснований (тимине и цитозине) может разрываться. Атомы углерода остаются связанными одной связью. Расстояние между параллельными плоскостями оснований полинуклеотидной цепи, в которых произошёл разрыв., равно примерно 3,4 . Это расстояние позволяет освободившимся валентностям между С-С атомами пиримидиновых оснований, расположенных последовательно в цепи ДНК, сформировать циклобутановое кольцо (рис. 4-25). В зависимости от того, какие основания соединены в димер, их называют димерами тимина, цитозина или ти-мин-цитозиновыми димерами. Удаление пиримидиновых димеров происходит под действием фотолиазы Фермент расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. В фотолиазе есть участок, либо сам поглощающий фотоны (в синей части спектра), либо связывающийся с кофакторами, адсорбирующими свет. Таким образом, свет активирует фотолиазу, которая распознаёт димеры в облучённой ДНК, присоединяется к ним и разрывает возникшие между пиримидиновыми кольцами связи. После этого фермент отделяется от ДНК. Повреждения оснований ДНК химическими мутагенами Азотистые основания в ДНК могут подвергаться разнообразным повреждениям: алкилированию, окислению, восстановлению или связыванию основания с формамидными группировками. Репарация начинается с присоединения ДНК-N-гликозилазы к повреждённому основанию. Существует множество ДНК-М-гликозилаз, специфичных к разным модифицированным основаниям. Ферменты гидролитически расщепляют N-гликозидную связь между изменённым основанием и дезоксирибозой, это приводит к образованию АП-сайта в цепи ДНК (первый этап). Репарация АП-сайта может происходить или только при участии ДНК-инсертазы, которая присоединяет к дезоксирибозе основание в соответствии с правилом комплементарности, или при участии всего комплекса ферментов, участвующих в репарации: АП-эндонуклеазы, АП-экзонуклеазы, ДНК-полимеразы β и ДНК-лигазы. В. Дефекты репарационных систем и наследственные болезни Репарация необходима для сохранения нативной структуры генетического материала на протяжении всей жизни организма. Снижение активности ферментов репарационных систем приводит к накоплению повреждений (мутаций) в ДНК. Причиной многих наследственных болезней человека выступает нарушение отдельных этапов процесса репарации. Пигментная ксеродерма У больных в системе репарации снижена активность ферментов, ответственных за удаление неправильных оснований, "застройку" бреши и другие функции. Дефект репарационной системы проявляется в сверхчувствительности к УФ-свету, что приводит к появлению красных пятен на коже, переходящих в незаживающие коросты и нередко в рак кожи. Трихотиодистрофия Заболевание связано с повышенной фоточувствительностью ДНК, вызванной снижением активности фермента, участвующего в удалении димеров тимина. Симптомы заболевания: ломкость волос вследствие нехватки серы в белках волос и их луковиц; часто умственная д физическая отсталость; аномалии кожи и зубов. 13. Транскрипция у прокариот. Характеристика компонентов системы синтеза РНК. Структура ДНК-зависимой РНК-полимеразы: роль субъединиц (a2ВВ′d). Инициация процесса. Транскрипция - первая стадия реализации генетической информации в клетке. В ходе процесса образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции. Транскрипция у эукариотов происходит в ядре. В основе механизма транскрипции лежит тот же структурный .принцип комплементарного спаривания оснований в молекуле РНК (G ≡ C, A=U и Т=А). ДНК служит только матрицей и в ходе транскрипции не изменяется. Рибонукле-озидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ) -субстраты и источники энергии, необходимые для протекания полимеразной реакции, образования 3',5'-фосфодиэфирной связи между рибонуклеозидмонофосфатами. Синтез молекул РНК начинается в определённых последовательностях (сайтах) ДНК, которые называют промоторы, и завершается в терминирующих участках (сайты терминации). Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции -транскриптон. У эукариотов в состав транскриптона, как правило, входит один ген (рис. 4-27), у прокариотов несколько. В каждом транскриптоне присутствует неинформативная зона; она содержит специфические последовательности нуклеотидов, с которыми взаимодействуют регуляторные транскрипционные факторы. Транскрипционые факторы - белки, взаимодействующие с определёнными регуляторными сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транскриптонах эукариотов составляет в среднем 1:9 (у прокариотов 9:1). Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК. Разделение ДНК на множество транскриптонов позволяет осуществлять с разной активностью индивидуальное считывание (транскрипцию) разных генов. В каждом транскриптоне транскрибируется только одна из двух цепей ДНК, которая называетсяматричной, вторая, комплементарная ей цепь, называется кодирующей. Синтез цепи РНК идёт от 5'- к З'-концу, при этом матричная цепь ДНК всегда антипараллельна синтезируемой нуклеиновой кислоте (рис. 4-28). Транскрипция не связана с фазами клеточного цикла; она может ускоряться и замедляться в зависимости от потребности клетки или организма в определённом белке. РНК-полимеразы Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая пре-рРНК;РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК. РНК-полимеразы - олигомерные ферменты, состоящие из нескольких субъединиц - 2α, β, β', σ. Субъединица о (сигма) выполняет регуляторную функцию, это один из факторов инициации транскрипции, РНК-полимеразы I, II, III, узнающие разные промоторы, содержат разные по строению субъединицы σ. А. Стадии транскрипции В процессе транскрипции различают 3 стадии: инициацию, элонгацию и терминацию. Инициация Активация промотора происходит с помощью большого белка - ТАТА-фактора, называемого так потому, что он взаимодействует со специфической последовательностью нуклеотидов промотора -ТАТААА- (ТАТА-бокс) (рис. 4-29). Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение кон-формации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка, в которой матрица доступна для инициации синтеза цепи РНК 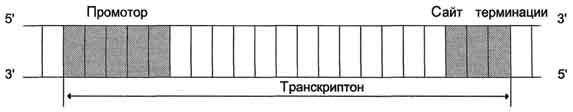 Рис. 4-27. Строение транскриптона. После того как синтезирован олигонуклеотид из 8-10 нуклеотидных остатков, σ-субъединица отделяется от РНК-полимеразы, а вместо неё к молекуле фермента присоединяются несколько факторов элонгации. 14. Элонгация, терминация транскрипции (ρ-независимая, ρ-зависимая терминация) 2. Элонгация– последовательное удлинение растущей цепи РНК. Перемещаясь вдоль двойной спирали ДНК, РНК-полимераза непрерывно раскручивает спираль впереди того участка, где происходит синтез РНК. На короткое время образуется так называемый открытый комплекс, внутри которого возникает РНК-ДНК-спираль длиной около 20 нуклеотидов (рис. 30). Затем фермент (с помощью специального сайта) вновь закручивает 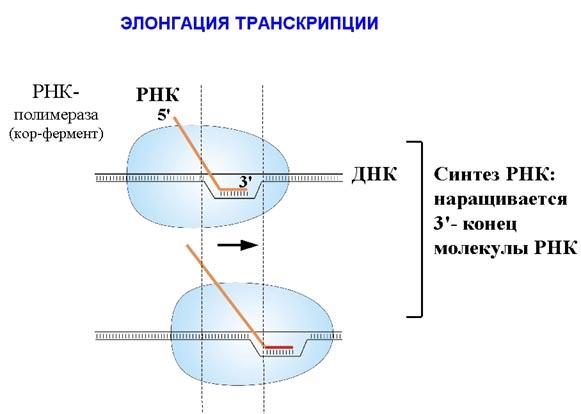 Рис. 30. Элонгация транскрипции ДНК позади участка полимеризации. РНК-транскрипт выводится из комплекса через особый канал, свойственный РНК-полимеразе. Скорость синтеза РНК у бактерий составляет около 30 нуклеотидовв секунду, однако она не постоянна и может несколько снижаться. Такие периоды называют паузами транскрипции. Показано, что еще до образования гибрида РНК-ДНК РНК-полимераза переводит ДНК из В-формы в А-форму. В ней плоскости азотистых оснований не перпендикулярны оси спирали, а наклонены на 200 к перпендикуляру. Вероятно, это облегчает разъединение двух соседних азотистых оснований в цепи ДНК. Параметры РНК-ДНК-спирали также практически полностью идентичны характеристикам А-формы ДНК. 3. Терминация (окончание транскрипции) определяется особой нуклеотидной последовательностью ДНК, расположенной в зоне терминатора оперона. В бактериальных оперонах выделяют два типа терминаторов: - ρ (ро) - независимые терминаторы (I типа); - ρ - зависимые терминаторы (II типа). 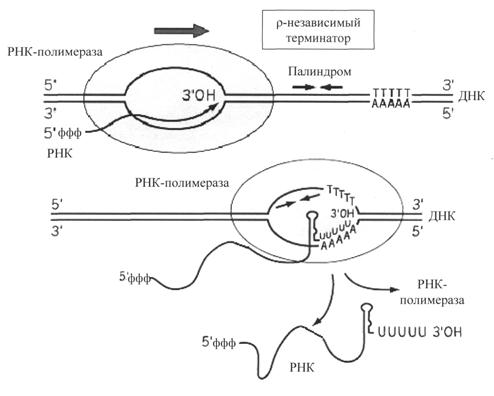 Рис. 31. ρ-независимая терминация транскрипции у бактерий ρ-независимые терминаторы состоят из последовательностей, представляющих собой инвертированный повтор – палиндром (рис. 31), и располагаются за 16-20 нуклеотидных пар от точки терминации. Палиндромы(последовательности, которые читаются одинаково слева направо и справа налево) ρ-независимых терминаторов содержат большое количество Г-Ц-повторов. За этим участком на матричной цепи расположена олиго (А) - последовательность (4-8 адениловых нуклеотидов подряд). Транскрипция в области палиндрома приводит к тому, что в получившемся РНК-транскрипте быстро образуется устойчивый элемент вторичной структуры – «шпилька» – спирализованная область, содержащая комплементарные Г-Ц-пары. «Шпилька» нарушает прочность связи ДНК-РНК в открытом комплексе. Кроме этого транскрипция олиго(А)-последовательности в матричной цепи ведет к образованию участка ДНК-РНК-гибрида, составленного из непрочных А-У пар, что также способствует разрушению контакта между ДНК и РНК. ρ-зависимые терминаторы. Одним из факторов транскрипции прокариот является белок ρ. ρ-фактор – это имеющий четвертичную структуру белок, обладающий АТФ-азной активностью. Он способен связываться с 5-концом синтезируемой РНК длиной около 50 нуклеотидов. ρ-фактор движется по РНК с такой же скоростью, с которой РНК-полимераза движется по ДНК. Вследствие того что в терминаторе много Г-Ц-пар (с тремя водородными связями), РНК-полимераза в области терминатора замедляет ход, ρ-фактор ее догоняет, изменяет конформацию фермента, и синтез РНК прекращается 15. Особенности транскрипции у эукариот. Структура белков, регулирующих процесс транскипции. |
