Биохимия итоговая. Итоговая работа 2 по БХ (занятие 10). 1. Общая схема распада нуклеиновых кислот пищи, ферменты, субстраты, продукты
 Скачать 1.5 Mb. Скачать 1.5 Mb.
|
|
Особенности транскрипции у эукариот. Транскрипция - первая стадия реализации генетической информации в клетке. В ходе процесса образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные РНК. Транскрипция у эукариотов происходит в ядре. В основе механизма транскрипции лежит тот же структурный .принцип комплементарного спаривания оснований в молекуле РНК (G ? C, A=U и Т=А). ДНК служит только матрицей и в ходе транскрипции не изменяется. Синтез молекул РНК начинается в определённых последовательностях ДНК- промоторах, и завершается в сайтах терминации. Участок ДНК, ограниченный промотором и сайтом терминации- единицу транскрипции -транскриптон. В каждом транскриптоне присутствует неинформативная зона. Транскрипционые факторы - белки, взаимодействующие с определёнными регуляторными сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транскриптонах эукариотов составляет в среднем 1:9 (у прокариотов 9:1). В каждом транскриптоне транскрибируется только одна из двух цепей ДНК, которая называетсяматричной, вторая называется кодирующей. Синтез цепи РНК идёт от 5'- к З'-концу, при этом матричная цепь ДНК всегда антипараллельна синтезируемой нуклеиновой кислоте. РНК-полимеразы. Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая пре-рРНК;РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК. РНК-полимеразы - олигомерные ферменты, состоящие из нескольких субъединиц - 2б, в, в', у. Субъединица сигма выполняет регуляторную функцию, это один из факторов инициации транскрипции, РНК-полимеразы I, II, III, узнающие разные промоторы, содержат разные по строению субъединицы у. В процессе транскрипции различают 3 стадии: инициацию, элонгацию и терминацию. Инициация. Активация промотора происходит с помощью большого белка - ТАТА-фактора, называемого так потому, что он взаимодействует со специфической последовательностью нуклеотидов промотора -ТАТААА- (ТАТА-бокс). Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение кон-формации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка, в которой матрица доступна для инициации синтеза цепи РНК. Элонгация. Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение цепей ДНК. Синтез молекулы РНК идёт от 5'- к З'-концу комплементарно матричной цепи ДНК. На стадии элонгации, в области транскрипционной вилки, одновременно разделены примерно 18 нуклеотидных пар ДНК. Растущий конец цепи РНК образует временную гибридную спираль, около 12 пар нуклеотидных остатков, с матричной цепью ДНК. По мере продвижения РНК-полимеразы по матрице в направлении от 3'- к 5'-концу впереди неё происходит расхождение, а позади - восстановление двойной спирали ДНК. Терминация. Раскручивание двойной спирали ДНК в области сайта терминации делает его доступным для фактора терминации. Завершается синтез РНК в строго определенных участках матрицы - терминаторах (сайты терминации). 16. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль. Ковалентная модификация (процессинг) матричной РНК Первичные транскрипты мРНК, прежде чем будут использованы в ходе синтеза белка, подвергаются ряду ковалентных модификаций. Эти модификации необходимы для функционирования мРНК в качестве матрицы. Модификация 5'-конца Модификации пре-мРНК начинаются на стадии элонгации. Когда длина первичного транскрипта достигает примерно 30 нуклеотидных остатков, происходит кэпирование его 5'-конца. Осуществляет кэпирование гуанилилтрансфераза. Фермент гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифосфатный остаток 5'-фосфатной группой к 5'-концу синтезированного фрагмента РНК с образованием 5', 5'-фосфодиэфирной связи. Последующее метилирование остатка гуанина в составе ГТФ с образованием N7-метилгуанозина завершает формирование кэпа (рис. 4-31). 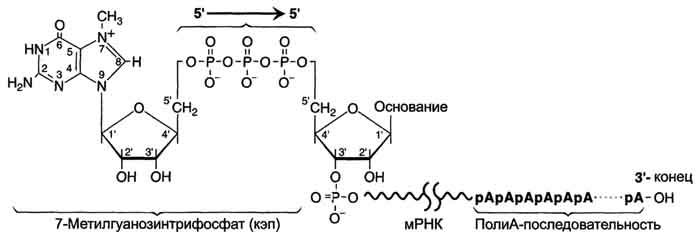 Рис. 4-31. Ковалентная модификация концевых нуклеотидных остатков первичного транскрипта мРНК. Модифицированный 5'-конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая её от действия 5'-экзонуклеаз в цитоплазме. Кэпирование необходимо для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также необходимо для работы сложной ферментной системы, обеспечивающей удаление нитронов. Модификация 3'-конца 3'-Конец большинства транскриптов, синтезированных РНК-полимеразой II, также подвергается модификации, при которой специальным ферментом полиА-полимеразой формируется полиА-последовательность (полиА-"хвост"), состоящая из 100-200 остатков аде-ниловой кислоты. Сигналом к началу полиаденилирования является последовательность -AAUAAA- на растущей цепи РНК. Фермент полиА-полимераза, проявляя экзонуклеазную активность, разрывает 3'-фосфоэфирную связь после появления в цепи РНК специфической последовательности -AAUAAA-. К 3'-концу в точке разрыва полиА-полимераза наращивает по-лиА-"хвост", Наличие полиА-последовательности на 3'-конце облегчает выход мРНК из ядра и замедляет её гидролиз в цитоплазме. Ферменты, осуществляющие кэширование и полиаденилирование, избирательно связываются с РНК-полимеразой II, и в отсутствие полимеразы неактивны. Сплайсинг первичных транскриптов мРНК С появлением методов, позволяющих изучать первичную структуру молекул мРНК в цитоплазме и последовательность нуклеотидов кодирующей её геномной ДНК, было установлено, что они не комплементарны, а длина гена в несколько раз больше "зрелой" мРНК. Последовательности нуклеотидов, присутствующие в ДНК, но не входящие в состав зрелой мРНК, были названы некодирующими, или интроны, а последовательности, присутствующие в мРНК, - кодирующими, или экзоны. Таким образом, первичный транскрипт - строго комплементарная матрице нуклеиновая кислота (пре-мРНК), содержащая как экзоны, так и интроны. Длина интронов варьирует от 80 до 1000 нуклеотидов. Последовательности интронов "вырезаются" из первичного транскрипта, концы экзонов соединяются друг с другом. Такую модификацию РНК называют "сплайсинг" (от англ, to splice - сращивать). Сплайсинг происходит в ядре, в цитоплазму поступает уже "зрелая" мРНК. Гены эукариотов содержат больше интронов, чем экзонов, поэтому очень длинные молекулы пре-мРНК (около 5000 нуклеотидов) после сплайсинга превращаются в более короткие молекулы цитоплазматической мРНК (от 500 до 3000 нуклеотидов). Процесс "вырезания" интронов протекает при участии малых ядерных рибонуклеопротеинов (мяРНП). В состав мяРНП входит малая ядерная РНК (мяРНК), нуклеотидная цепь которой связана с белковым остовом, состоящим из нескольких протомеров. В сплайсинге принимают участие различные мяРНП (рис. 4-32). Нуклеотидные последовательности нитронов функционально неактивны. Но на 5'- и З'-концах они имеют высокоспецифические последовательности - AGGU- и GAGG- соответственно (сайты сплайсинга), которые обеспечивают их удаление из молекулы пре-мРНК. Изменение структуры этих последовательностей влияет на процесс сплайсинга. На первой стадии процесса мяРНП связываются со специфическими последовательностями первичного транскрипта (сайты сплайсинга), далее к ним присоединяются другие мяРНП. При формировании структуры сплайсосомы 3'-конец одного экзона сближается с 5'-концом следующего экзона. Сплайсосома катализирует реакцию расщепления 3',5'-фосфодиэфирной связи на границе экзона с интроном. Последовательность интрона удаляется, а два экзона соединяются. Образование 3',5'-фосфодиэфирной связи между двумя экзонами катализируют мяРНК (малые ядерные РНК), входящие в структуру сплайсосомы. В результате сплайсинга из первичных транскриптов мРНК образуются молекулы "зрелой" мРНК. Альтернативный сплайсинг первичных транскриптов мРНЕ Для некоторых генов описаны альтернативные пути сплайсинга и полиаденилирования одного и того же транскрипта. Экзон одного варианта сплайсинга может оказаться интроном в альтернативном пути, поэтому молекулы мРНК, образованные в результате альтернативного сплайсинга, различаются набором экзонов. Это приводит к образованию разных мРНК и, соответственно, разных белков с одного первичного транскрипта. Так, в парафолликулярных клетках щитовидной железы (рис. 4-33) в ходе транскрипции гена гормона кальцитонина (см. раздел 11) образуется первичный транскрипт мРНК, который состоит из шести экзонов. Матричная РНК кальцитонина образуется путём сплайсинга первых четырёх экзонов (1-4). Последний (четвёртый) экзон содержит сигнал полиаденилирования (последовательность -AAUAAA-), узнаваемый полиА-полимеразой в парафолликулярных клетках щитовидной железы. Этот же первичный транскрипт в клетках головного мозга в ходе другого (альтернативного) пути сплайсинга превращается в мРНК кальцитонинподобного белка, отвечающего за вкусовое восприятие. Матричная РНК этого белка состоит из первых трёх экзонов, общих с кальцитониновои мРНК, но включает дополнительно пятый и шестой экзоны, не свойственные мРНК кальцитонина. Шестой экзон тоже имеет сигнал полиаденилирования -AAUAAA-, узнаваемый ферментом полиА-полимеразой в клетках нервной ткани. Выбор одного из путей (альтернативный сплайсинг) и одного из возможных сайтов полиаденилирования играет важную роль в тканеспецифической экспрессии генов. Сплайсинг РНК. В процессе сплайсинга принимают участие различные мяРНП, которые формируют сплайсосому. мяРНП, взаимодействуя с РНК и друг с другом, фиксируют и ориентируют реакционные группы первичного транскрипта. Каталитическая функция сплайсосом обусловлена РНК-составляющими; такие РНК называют рибозимами. Альтернативный сплайсинг гена кальцитонина. В клетках щитовидной железы сплайсинг первичного транскрипта приводит к образованию кальцитониновои мРНК, включающей 4 экзона и полиА-последовательность, которая образуется после расщепления транскрипта в первом участке сигнала полиаденилирования. В клетках мозга образуется мРНК, содержащая: экзоны 1, 2, 3, 5, 6 и полиА-последовательность, образованную после второго сигнала полиаденилирования. Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях на определённых стадиях их развития. 17. Регуляция транскрипции у прокариот. Теория оперона, регуляция по типу индукции и репрессии (примеры). Регуляция транскрипции у прокариот. 1. Теория оперона У прокариотов ДНК не отделена от цитоплазмы ядерной оболочкой. В процессе транскрипции образуются первичные транскрипты, не содержащие нитронов, а мРНК лишены "кэпа" и поли-А-конца. Синтез белка начинается до того, как заканчивается транскрипция. каждая клетка Е. coli содержит информацию о нескольких тысячах белков. Но многие гены не транскрибируются. Гены белков, функции которых в метаболических процессах тесно связаны, часто в геноме группируются вместе в структурные единицы (опероны). оперонами называют участки молекулы ДНК, которые содержат информацию о группе функционально взаимосвязанных структурных белков, и регуляторную зону, контролирующую транскрипцию этих генов. Структурные гены оперона экспрессируются согласованно. Когда оперон активен и все его гены транскрибируются, то синтезируется полицистронная мРНК, служащая матрицей для синтеза всех белков этого оперона. Транскрипция структурных генов зависит от способности РНК-полимеразы присоединяться к промотору, расположенному на 5'-конце оперона перед структурными генами. Связывание РНК-полимеразы с промотором зависит от присутствия белка-репрессора на смежном с промотором участке, который называют "оператор". Белок-репрессор синтезируется в клетке с постоянной скоростью и имеет сродство к операторному участку. Структурно участки промотора и оператора частично перекрываются, поэтому присоединение белка-репрессора к оператору создаёт стерическое препятствиедля присоединенияРНК-полимеразы. Большинство механизмов регуляции синтеза белков направлено на изменение скорости связывания РНК-полимеразы с промотором. Гены, осуществляющие синтез регуляторных' белков, могут быть удалены от оперона, транскрипцию которого они контролируют. 2. Индукция синтеза белков. Lac-оперон Теория оперона была предложена на основании данных, полученных при изучении свойств лактозного оперона Е. coli, т.е. оперона, в котором закодированы белки, участвующие в усвоении лактозы. Клетки Е. coli обычно растут на среде, используя в качестве источника углерода глюкозу. Если в среде культивирования глюкозу заменить на дисахарид лактозу, то клетки адаптируются к изменившимся условиям. Они продуцируют 3 белка, обеспечивающих утилизацию лактозы. Один из этих белков - фермент в-галактозидаза, катализирующий гидролитическое расщепление лактозы до глюкозы и галактозы. В присутствии глюкозы клетки Е. coli содержат менее 10 молекул этих ферментов на клетку. Перенос клеток на среду, содержащую лактозу, вызывает увеличение количества молекул каждого из ферментов до 5000. В отсутствие лактозы белок-репрессор связан с оператором. А поскольку участки оператора и промотора перекрываются, то присоединение репрессора к оператору препятствует связыванию РНК-полимеразы с промотором, и транскрипция структурных генов оперона не идёт. Когда в среде появляется индуктор, то он присоединяется к белку-репрессору и снижает сродство к оператору. РНК-полимераза связывается с промотором и транскрибирует структурные гены. 3. Репрессия синтеза белков. Снижение концентрации фермента в бактериальной клетке может осуществляться путём репрессии синтеза ферментов. когда клетки Е. coli растут на среде, содержащей соль аммония в качестве единственного источника азота, то им приходится синтезировать все азотсодержащие вещества. если добавить в среду культивирования одну из аминокислот, например триптофан или гистидин, то клетка перестанет вырабатывать весь набор ферментов, необходимых для синтеза этих аминокислот из аммиака. Репрессия синтеза ферментов, катализирующих последовательность реакции метаболического пути конечным продуктом, как это имеет место в случае ферментов синтеза гастидина или триптофана, называется репрессией конечным продуктом. при отсутствии в среде Гис или Три регуляторный белок-репрессор не имеет сродства к оператору и происходит синтез ферментов, осуществляющих образование этих аминокислот. Когда в среду добавляют, например, Гис, то эта небольшая "корепрессор", присоединяется к белку-репрессору. В результате конформационных изменений в молекуле репрессора комплекс белка-репрессора и корепрессора приобретает сродство к оператору, присоединяется к нему, и транскрипция оперона прекращается. 18. Механизмы регуляции экспрессии генов у эукариот.    19. Постранскрипционная регуляция у эукариот, обеспечивающая разнообразие белков: альтернативный сплайсинг. Редактирование РНК. Альтернативный сплайсинг. многие эукариотические гены образуют несколько вариантов зрелой мРНК в ходе процессинга первичного транскрипта. Наиболее часто промотор сохраняется на одном из концов транскрипта, а в ходе сплайсинга происходит "вырезание" одного или нескольких экзонов. В других случаях в зрелой мРНК сохраняется часть интрона и включается в состав экзона с 5' или 3'-конца. Сплайсинг может влиять на выбор промотора или участка полиаденилирования. С помощью альтернативного сплайсинга в процессе синтеза антител образуются мембраносвязанные и секреторные формы антител. Так, первоначально В-лимфоциты продуцируют транскрипты, полиаденилированные после второго стоп-кодона, а интрон, в котором имеется первый стоп-кодон, удаляется. В результате синтезируются IgM, связанные с клеточной мембраной, так как мРНК таких клеток содержит на 3'-конце экзон, кодирующий участок полипептидной цепи, состоящий из гидрофобных аминокислот. С помощью этого участка происходит "заякоривание" IgM в мембране. Когда В-лимфоциты превращаются в плазматические клетки, то в результате альтернативного сплайсинга образуется мРНК, в которой сохраняется интрон, содержащий первый стоп-кодон. Поэтому происходит более раннее полиаденилирование и исчезает экзон, кодирующий гидрофобный участок молекулы. Синтезируются укороченные молекулы антител, секретируемыев кровь. "Редактирование" РНК. первичная структура мРНК может изменяется после транскрипции. Последовательность нуклеотидов в таких генах одинакова, а транскрибируемая в разных тканях мРНК различается в результате появления вставок или выпадений нуклеотидов. Пример "редактирования" РНК - образование апопротеина В (апо-В) в клетках печени и тонкого кишечника. Апо-В - основной компонент липопротеинов, участвующих в транспорте триацилглицеринов. 20. Биосинтез белков (трансляция). Основные компоненты белоксинтезирующей системы: аминокислоты, т-РНК, рибосомы, источники энергии, белковые факторы, ферменты. Для синтеза полипептидной цепи необходимо большое количество компонентов, совместное и согласованное взаимодействие которых приводит к образованию белка. Аминокислоты. Функция: Субстраты для синтеза белков Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве(особенно)незаменимые (т.е. не синтезирующимся в организме) аминокислоты, так как недостаточное снабжение клетки хотя бы одной незаменимой аминокислотой приводит к снижению, а иногда и полной остановке синтеза белка на кодоне, требующем включения этой аминокислоты в белок. мРНК. Содержит информацию о структуре синтезируемого белка и используется в качестве матрицы. Т-РНК. тРНК выполняют функцию адаптеров. Они акцепторным концом взаимодействуют с аминокислотами, а антикодоном - с кодоном мРНК. В процессе синтеза белка на рибосоме связывание антикодонов тРНК с кодонами мРНК происходит по принципу комплементарности и антипараллельности. Число тРНК для каждой аминокислоты не совпадает с числом кодирующих её кодонов в мРНК -первые два основания кодона и последние два основания антикодона образуют обычные прочные пары (гуанинцитозин и аденинурацил) и вносят наибольший вклад в специфичность декодирования; -связывание третьего основания кодона с первым основанием антикодона происходит слабее, чем с первыми двумя, и это позволяет некоторым тРНК прочитывать больше чем один кодон. Гипотеза, объясняющая характер кодонан-тикодонового взаимодействия, получила название "гипотезы качания" (т.е. третье основание большинства кодонов имеет определённую степень свободы при образовании пары с соответствующим антикодоном и как бы "качается"). Аминоацил-тРНК синтетазы Ф-ция: Каждая аа-тРНК-синтетаза катализирует реакцию специфического связывания одной из 20 аминокислот с соответствующей тРНК В цитозоле клеток 20 различных аминокислот присоединяются б-карбоксильной группой к 3'-гидроксильному акцепторному концу соответствующих тРНК с образованием сложноэфирной связи. Эти реакции катализирует семейство ферментов, носящее название аминоацил-тРНК синтетаз (аа-тРНК-синтетаз). Каждый член этого семейства узнаёт только одну определённую аминокислоту и те тРНК, которые способны связываться с этой аминокислотой. Из этого следует, что в группу тРНК синтетаз входит 20 различных ферментов. Они осуществляют активацию аминокислот Рибосомы - Рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков. Белки входят в состав субъединиц рибосомы в количестве одной копии и выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой или пептидом. Белковые факторы инициации, элонгации, терминации -специфические внерибосомные белки, необходимые для процесса трансляции (12 факторов инициации: elF; 2 фактора элонгации: eEFl, eEF2, и факторы терминации: eRF) АТФ и ГТФ как источники энергии На включение одной аминокислоты в растущую полипептидную цепь клетка затрачивает 4 макроэргические связи: 2 из АТФ в ходе реакции, катализируемой аа-тРНК синтетазой (в процессе активации аминокислот АТФ расщепляется на АМФ и пирофосфат), и 2 молекулы ГТФ: одна используется на связывание аа-тРНК в А-центре рибосомы, а вторая затрачивается на стадию транслокации. К этому следует добавить использование ещё двух мак-роэргических связей молекул: АТФ и ГТФ на инициацию и терминацию синтеза полипептидной цепи. 21. Строение и функции рибосом. Связывающие и каталитическик центры рибосом.  |
