|
|
Шпора. Экзамен по химии. 1. Основные понятия в химии вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль
28.Углерод, его свойства и соединения. Круговорот углерода в природе.
Углерод(С)-главный из элементов органогенов т.к. образует скелеты всех органических молекул. В органических веществах углерод всегда четырёх валентен, что связано с наличием на внешнем уровне в возбуждённом состоянии четырёх не спаренных электронов на четырёх орбиталях.
С 1S2 2S2 2P2 ––> C * 1S2 2S1 2P3 *-возбуждённое состояние. Равенство числа электронов и число орбиталей на внешнем уровне а также уникальное сочетание заряда ядра и радиуса атома сообщается с рядом специфических свойств:
1 в зависимости от природы атома с которым реагирует атом углерода, он может как отдавать так и принимать электроны проявляя в соединениях степень окисления от -4до +4.
2.Атомные орбитали на внешнем энергетическом уровне могут легко претерпевать различные типы гибридизации- sp; sp2; sp3, что позволяет атому углерода образовывать кратные связи (двойные, тройные, бензольное кольцо) это в свою очередь приводит к огромному числу органических молекул.
Кислотно-основные свойства углерода. Углерод образует два основных оксида: СО(несолеобразующий)-оксид углерода
СО2(кислотный)-диоксид углерода.
Также существует С3О2 (О=С=С=С=О)-триоксид углерода.
СО2умеренно растворим в воде. При температуре 00С в одном объёме воды растворяется 1объём СО2. В растворах СО2 присутствует сложное равновесие:
СО2+Н2О↔Н2СО3↔Н++НСО3-↔2Н++СО32- (при увеличении рН равновесие смещается вправо ).
Н2СО3- очень слабая кислота, образует 2 типа солей: кислые гидрокарбонаты и средние карбонаты (раствори соли щелочных Ме кроме Li2CО3 и аммония (NH4)2CО3). Так как это соли очень слабой кислоты то в растворах они подвергаются гидролизу по аниону:
НСО3-+Н2О↔ Н2СО3+ОН-
СО32--+Н2О↔ НСО3-+ОН- -среда растворов щелочная.
В момент образования Н2СО3 разлагается на СО2 и Н2О,поэтому такие соли, как питьевая вода (NaHCO3), мел (CaCO3) и магнезия (4MgCO ∙ Mg(OH)2- Н2О) применяются как антоцидные (нейтрализующие кислату) средства. Для снижения повышенной кислотности желудочного сока: NaHCO3+НCl--->NaCl+СО2↑ + Н2О
CaCO3+2 НCl--->CaCl2 +СО2↑+ Н2О
Угольная кислота гидрокарбонат иона НСО3- образует карбонатную буферную систему, главную систему плазмы крови, обеспечивает постоянство рН на уровне 7,4±0,05.
Содержащие в природной воде гидрокарбонаты Ca и Mg обуславливают её временную (карбонатную) жёсткость, которая удаляется при кипячении:
Са(НСО3)2-t-->СаСО3↓ + СО2+ Н2О
Mg(НСО3)2-t--> Mg(OH)2↓+2СО3↑
Окислительно-восстановительные свойства углерода.
С Ме и Н2 углерод проявляет отрицательную степень окисления, а с атомами высокой электроотрицательности, галогенами, кислородом и азотом- положительную степень окисления. Таким образом степень окисления углерода может изменяться от -4(NН4) до +4 (СО2).
Соединения углерода в организме в различных процессах могут выступать как в качестве восстановителей (СО32-), так и окислителей. Восстановление может протекать как в частичной, так и в полной форме( при полном окислении конечными продуктами являются: СО2; Н2О, если присутствует азот, то N2)
CН3-CН2-ОН+ [О]--->CН3-СОН + Н2О
CН3-CН2-ОН+6 [О]--->2 СО2+3 Н2О
Окислительные свойства углерода проявляются при присоединении водорода по кратным связям.
Комплексообразовательные свойства углерода.
В возбуждённом состоянии у атома углерода на его четырёхатомных орбиталях располагаются по одному не спаренному электрону, поэтому в процессах комплексообразования могут принимать участия только такие соединения углерода (молекулы или ионы), которые содержат готовую не поделённую электронную пару. К таким высокореакционным лигандам относятся: угарный газ(СО)и цианид ионы (СN-). Данные частицы размещая свои электронные пары в свободных орбиталях переходных Ме (Fe2+; Сu2+) приводят к образованию сложных компонентом, с этим связана ядовитость данных частиц.
ННb+ СО---> ННb СО
ННbO2+ СО--->ННb СО+ O2
ННbO2+ СN---> ННb СN-+O2
Круговорот углерода в природе.
В основе круговорота углерода лежит окислительно-восстановительные реакции. Растения в результате реакции фотосинтеза( 6CO2+6Н2О=С6Н12О6+6O2) усваивают CO2 из атмосферы и литосферы. Животные поедают растения , а человек потребляет как растения, так и животных. В результате процессов дыхания в атмосферу выделяется CO2. CO2, а также СН4( при анаэробном окислении) выделяется в процессах гниения и разложения.
Кроме того часть углерода выводится из атмосферы при образовании угля, торфа, нефти, газа, а также связывается в виде средних, кислых и основных солей.
Са(ОН)2+ СО2----> СаСО3+ Н2О-средние
СаСО3+ СО2+ Н2О--->Са(НСО3)2 -кислые
2Сu(ОН)2+ СО2--->Сu(ОН)2 СО3+ Н2О. -основные
Основная реакция (р-я фотосинтеза) регулирует соединения СО2 в атмосфере, однако в результате деятельности человека, в атмосферу, за счёт сжигания топлива, попадает огромное количество СО2, которое в полном объёме не усваивается растениями, в связи с чем концентрация СО2 растёт, что может привести к парниковому эффекту, способному привести к глобальному изменению климата планеты.
29Азот, его свойства. Аммиак. Кислородные соединения азота. Круговорот азота в природе.
Азот-элемент, находящийся во втором периоде, пятой группе таблицы Менделеева. При нормальных условиях азот - бесцветный газ, без запаха и малорастворимый в воде. На внешнем электронном уровне имеет 5 электронов, 3 из которых не спарены. Именно поэтому молекула азота имеет двухатомное строение, каждый атом имеет по 3 неспаренных электрона и соединяясь они образуют три общие электронные пары.
Аммиак - бесцветный газ с резким характерным запахом нашатыря. Очень хорошо растворим в воде. Из химических свойств выделяют:
Взаимодействие аммиака с водой и образование NH4OH, раствор имеет слабощелочную среду.
С кислотами образует слои аммония
При нагревании горит в атмосфере кислорода и образует азот и воду, а при нагревании на платине образуется оксид аммиака NO
При 1000 градусов по Цельсию аммиак образует с метаном и кислородом синильную кислоту HCN с выделением воды.
В промышленности аммиак получают прямым взаимодействием азота и водорода.
К кислородным соединениям азота относят его оксиды. Всего их 5: N2O, N2O3, NO, NO2, N2O5.
N2O - несолеобразующий оксид. Также известный как веселящий газ. При нагревании распадается на азот и кислород. Используется как слабый наркоз в медицине.
NO – бесцветный газ, мало растворим в воде. Не взаимодействует с водой, растворами кислот, щелочей. При обычной температуре с кислородом образует NO2. Получают в промышленности каталитическим окислением азотной кислоты.
N2O3 – темно-синяя жидкость, неустойчив при обычных условиях, взаимодействует с водой образуя HNO2(азотистую кислоту).
NO2 – бурый газ, токсичен, тяжелее воздуха. Взаимодействует с водой образуя азотную и азотистую кислоты.
N2O5 – бесцветное кристаллическое вещество. Разлагается на NO2 и O2. Сильный окислитель. С водой образует азотную кислоту.
Круговорот:
Азот атмосферы в результате азотфиксации (усвоение азота клубеньковыми бактериями), преобразуется в белки этих бактерий. Мочевая кислота выделяемая птицами и рептилиями и выделения бактерий в результате жизнедеятельности под влиянием почвенных бактерий преобразуется в аммиак и углекислый газ. Образовавшийся аммиак идет на нитрификацию. Из него образуются нитриты и нитраты. Это происходит благодаря нитрифицирующим бактериям, которые делятся на 2 группы: одни окисляют аммиак до нитрита, а другие окисляют нитриты в нитраты. Затем происходит денитрификация. Процесс происходит благодаря денитрифицирующим бактериям. Они восстанавливают нитрат через нитрит в в азот и N2O.
30.Фосфор,его содинения
Как и азот, он находится в 5группе,на внешнем уровне у него 5 электронов, но в отличие от азота у фосфора имеется свободный 3d-подуровень, на кот.в возбуждённом состоянии переходит электрон с S-подуровня, таким образом, максимальное число неспаренных валентных электронов у фосфора достигает 5,максимал.валентность=5.
С.о.в соединениях у фосфора измеряется от -3(PH3) до + 5 (Н3РО4).В природе фосфор встречается только в форме фосфат ионов, кот. для соединения фосфора наиболее устойчива. В организме чел. фосфаты играют важную роль 1)служат структур. компонентами скелета клеточ. мембран и нуклеиновых к-та также содержатся в костной ткани в виде гидроксоапатитов кальция Ca5(PO4)OH. 2)Полифосфаты аккумулируют и переносят энергию в ор-ме. Для фосфора известны 3 аллотропные модификации: белый, красный, чёрный. Наиболее актив. формой явл. белый фосфор, молекула кот. состоит из 4-х атомов Р4(в р-ции пишется Р).В мол. фосфора как и все кислород к-ты фосфора имеют пирамидальное строение.
Н3РО4-ортофосфорная(фосфорная)к-та 3-х основная, средней силы, образует средние и кислые соли-гидро и дигидрофосфаты.Н4Р2О7 – дифосфорная (пирофосфор.)к-та,4-х основная, по первым двум ступеням-сильняя.При окислении фосфора в изб. О2 обр-ся фосфор.ангидридР4О10.(4Р+5О2→2Р2О5). Р2О5-обладает высоким сродством к воде, поэтому широко исп-ся для поглащения влаги из различных сред. При раст-ии Р2О5 в воде последовательно обр-ся след.фосфор.к-ты сначала ортофосфорная (Р2О5+3Н2О→2Н3РО4).При дальнейшем раст-ии происходит димилизация фосф.к-ты Н4Р2О7.При далн.раст-ии Р2О5 обр-ся полимерные формы метафосф.к-ты (НРО3)Х где х-3,4,6. (2Н4Р2О7→(НРО3)4+2Н2О).При гидролизе ангидридной группы ,например,мол. АТФ высвобождается приблизительно 30 кДж/моль энергии.
Основным компонентом костной ткани явл.гидроксилаппатит кальция.5Ca2++3HPO42-+4OH- →Ca5(PO4)OH+3H2O.Совокупность гидрофосфатов и дигидрофосфатов (Н3РО42++Н2РО4-)обр-ет фосф.буфер.с-му ,кот., в частности, ответственна за постоянство рН крови. Ортофосф.к-та и малораст. фосфат алюминия исп-ся для приготовления цемента. Фосфаты не обладают практич. окислит св-ми. Однако в опред. усл. при гниении и разложении биолог.материалов могут восс-ся до фосфина РН3 и дифосфина Р2Н4 крайне ядовитых соед. легко окис-ся на воздухе ,что обуславливает свечение над старыми могилами (РН3+2О2→Н3РО4)
32.Кислород его свойства. Озон. Пероксид водорода его свойства. Круговорот кислорода в природе.
Кислород- самый распространенный элемент на планете, около 50% . Без него не возможны многочисленные чрезвычайно важные физиологические процессы, дыхание окисление.
2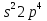 
Кислород «2-» по электроотрицательности. Исходя из электронного строения О2 его типичная степень окисления в соединении -2(исключения: в перекиси водорода и ее солях -1; в соединении с F положительный степень окисления)
В природе О2 встречается в виде 2-х модификациях амиотропных О2 и О3. В природе озон образуется при разряде молнии при ультрафиолетовом облучении смолы хвойных деревьев. Озон в микро количестве оказывает тонизирующее действие, в больших количествах очень ядовитый. Вызывает отек легких, вплоть до летального исхода. Макс. Содержание озона в атмосфере на высоте 22 км. Озоновый слой предохраняет планету от жесткого УФ облучения. В промышленности применяется для обеззараживания питьевой воды.
Пероксид водорода.
Н2О2. Широко применяется в медицинской практике в качестве наружного бактерицидного средства в виде 3% р-ра. Для окрашивания волос 6%. В лабораторию поставляется в виде 35% р-ра. Н2О2 термодинамический неустойчив. Самопроизвольно разлагается, особенно в присутствии катализаторов( MnO2 PbO2 )
2Н2О=2Н2О+О2
Удобной формой хранения являются таблетки гидропирита СО(NH2)2 * H2O2
Для приготовления р-ра H2O2 достаточно растворить таблетки.
Н2О2 находится в промежуточной степени окисления -1 поэтому Н2О2 в зависимости от условия р-ции может проявлять как окислительные свойства (наиб характерные) так и восстановительные, образуя молекулярный кислород( только с оч сильными растворителями подкисленные р-ры K2 Cr2O4 KMno4 и т д).
А) H2O2 окислитель
2KI+H2O I2+2KOH I2+2KOH
Б) H2O2 восстановитель
5H2O2+2KMnO4+3H2SO4 2MnSO4+K2SO4+SO2+8H2O 2MnSO4+K2SO4+SO2+8H2O
Н2О2 применяют для отбеливания тканей и как обеззараживающее средство. Н2О2 проявляет свойство оч слабой кислот поэтому все ее соли Na2O2 K2O2 так же обладают выраженными окислительными свойствами могут применяться для обеззараживания воды. Также используют для регенерации воздуха в замкнутых помещениях.
Na2O2+2CO2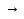 2Na2CO3+O2 2Na2CO3+O2
Чистый используется в качестве окислителя в торпедах и ракетных двигателях.
Окислительно-восстановительные свойства кислорода.
Главная химическая функция кислорода окисление веществ, которое всегда сопровождается выделением энергии. Для клетки важно, чтобы утилизация кислорода О2 происходила полностью
О2+4Н+4е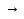 2Н2О 2Н2О
Если восстановление О2 произойдет не полностью то образуются различные активные форма кислорода: суперактивный анион-радикал: О2; гидропериксильный радикал НО2; гидроксильный радикал ОН; Н2О2. Защита от вредного действия активных форм О2 осуществляется с помощью антиоксидантной системы, которая включает фермент супероксидислипазу (нетр суперактивный анион, превращая его в Н2О2 и О2) и каталазу (осущ. разложение Н2О2)
2О2+2Н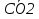 Н2О2+О2 Н2О2+О2
2Н2О 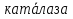 2Н2О+О2 2Н2О+О2
Образующийся кислород вовлекается в процессы окисления
Круговорот кислорода в природе.
В атмосфере содержится порядка 1.2*10^15 тонн кислорода участвует в реакции фотосинтеза, образуя примерно 2.5 * 10^11 тонн кислорода в процессе дыхания и разложения животных и растений остатков образуется в качестве конечных продуктов получается СО2 и Н2О которые вновь вовлекаются в процессы фотосинтеза, либо образуется практически тоже количество кислорода О2 которое было затрачено. То количество кислорода остается неизменным.
33.Сера
S 3s2 3p4
Из-за наличия свободного d –подуровня возможен переход s и p на d подуровень соответственно число неспаренных электронов может быть 2 4 6. Поэтом степень окисления в сере появляется с.о. +-2, +4, +6. В органических соединениях S с.о. (-2)Что обуславливает ее высокие восстановительные свойства. Особенно это характерно для соединений содержащих тиольную группу (R-Sh) которая легко окисляется в дисульфидную группу
2R-Sh -2е --- R-S-S-R + 2H+
В частности свободную тиольную группу содержат а-аминокислота цистеин, которая при окислении переходит в цистин , является природным антидотом нейтрализующий действие окислителей
HSCH2CH (NH2) COOH -2е ---- S –CH2-CH(NH2)-COOH +2 H+
S –CH2-CH(NH2)-COOH
Круговорот серы
Сера достаточно распространенный элемент, в природе встречается в самородном состоянии в виде сульфидов и сульфатов. Потребность живых организмов в S удовлетворяется за счет растений которые усваивают ее из почвы большую роль в круговороте S играют бактерии окисляющие и восстанавливающие сероводородсодержащие соединения.
Н2S
Бесцветный газ с характерным запахом тухлых яиц. Очень ядовит, поражает цнс. В 1 V Н2O растворяется 3V H2S . Раствор H2S является слабой двухосновной кислотой. Если в растворах подвергаются глубокому гидролизу, поэтому среда сильно щелочная.
N2S + Н2O NaHS + NaOH
S2- + Н2O HS- + OH-
Ряд сульфидов подвергается необратимому гидролизу.
AL2S3 + 6 H2O ---- 2AL(OH)3 осад +3 H2S газ
В H2S сера находится в низшей степени окисления ( -2) поэтому легко окисляется в зависимости от силы окисления до S, SO2, H2SO4
2H2S + O2 (нед) 2S + Н2O
2H2S + 3 O2 (из) 2 SO2 + 2Н2O
H2S +4Cl +4Н2O H2SO4 8HCl
Количественно сульфид ионы в растворе определяют йодометрическим методом , добавляют в раствор йод , избыток которого титруют раствором Na2S2O4
H2S + I2 (из) --- S +HI2 + I2 (ост)
I2(ост) +2 Na2S2O3 --- 2NaI + Na2S4O6 тетратионат натрия
Кислородные соединения серы
Сера образует 2 кислотных оксида SO2 ( сернистый газ) и SO3(серный ангидрид) При растворении SO2 в воде образуются существуют только в растворах 2-х основная средней силы сернистая кислота, соли которой сущ в индивидуальном виде (противоядия)
2NaOH + SO2 --- Na2SO3+ H2O
При кипячении концентрированных растворов сульфидов с порошкообразной серой обр. тиосульфаты, явл. универсальным антидотом (противоядия)
Na2SO3 +S --- Na2S2O3
SO3 представляет собой бесцветный кристалин, с температурой плавления в зависимости от модификации от +17 до +62 При растворении в воде образуется сильная 2х основная серная кислота Процесс сопровождается выделением большого количества тепла
SO3 + H2O--- H2SО4 +Q
При разбавлении H2SО4конц кислоту льют в воду !!!
Вода обладает высокой теплоемкостью . Многие сульфаты применяют в медицине : Na2SO4*7H20 – глауберова соль, MgSO4 *7H20 ---(горька соль) Оба вещества слабительные . CuSO4*5H20—медный купорос *дезинфекция) BaSo4- в качестве контрастного при рентгене пищевода и желудочка(хорошо поглощает рентгеновское излучение)
Na2S2O3 – тиосульфат натрия
Один атом серы находится в с.т. 0 , другой в +4 поэтому Na2S2O3 может проявлять как вост-е св-а (наиболее характерны), так и окислительные св-а При отравлении хлором необходимо выпить тиосульфата!!!
Na2S2O3 + 4CL +5 H2O---- Na2S04 + H2SО4 +8 HCl
S2O32- + 5 H2O – 8e --- 2 SO42- + 10 H+ 1
CL2 +2e ---2CL 4
Раствор I2 оттитровывают тиосульфатом в присутствии крахмала до исчезновения синей окраски. Na2S2O3 также используют при обработке кино- и фотопленки , рентгеновских снимков за счет протекания реакции
AgB2 + 2Na2S2O3 ---- Na3(Ag(S2O3)2) + NaB2
На всякий случай, мож пригодится !!!!
H2SО4
3.Физические свойства.
а) жидкость б) бесцветная в)тяжелая (купоросное масло) г)нелетучая
г) при растворении в воде происходит сильное разогревание (поэтому серную кислоту непременно нужно наливать в воду, а не наоборот!)
4. Химические свойства Серной кислоты.
Разбавленная H2SO4
|
Концентрированная H2SO4
|
Обладает всеми свойствами кислот
|
Обладает специфическими свойствами
|
1.Изменяет окраску индикатора:
H2SO4 H++HSO4-
HSO4- H++SO42-
2.Реагирует с металлами, стоящими до водорода:
Zn+ H2SO4 ZnSO4+H2
3.Реагирует с основными и амфотерными оксидами:
MgO+ H2SO4 MgSO4+H2O
4.Взаимодействует с основаниям (реакция нейтрализации)
2NaOH+H2SO4 Na2SO4+2H2O
при избытке кислоты образуются кислые соли
NaOH+H2SO4 NaHSO4+H2O
5.Реагирует с сухими солями, вытесняя из них другие кислоты (это самая сильная и нелетучая кислота):
2NaCl+H2SO4 Na2SO4+2HCl
6.Реагирует с растворами солей, если при этом образуется нерастворимая соль:
BaCl2+H2SO4 BaSO4 +2HCl -
белый осадок
качественная реакция на ион SO42-
7.При нагревании разлагается:
t
H2SO4 H2O+SO3
|
1.Концентрированная H2SO4- сильнейший окислитель, при нагревании она реагирует со всеми металлами (кроме Au и Pt). В этих реакциях в зависимости от активности металла и условий выделяется S,SO2 или H2S
Например:
0 +6 +2 +4
Cu+конц2H2SO4 CuSO4+SO2+H2O
2.конц. H2SO4 пассивирует железо и алюминий,
поэтому её можно перевозить в стальных и
алюминиевых цистернах.
3. конц. H2SO4 хорошо поглощает воду
H2SO4+H2O H2SO4*2H2O
Поэтому она обугливает органические вещества
|
5.Применение: Серная кислота -один из важнейших продуктов, используемых в различных отраслях промышленности. Основными её потребителями являются производство минеральных удобрений, металлургия, чистка нефтепродуктов. Серная кислота применяется при производстве других кислот, моющих средств, взрывчатых веществ, лекарств, красок, в качестве электролитов для свинцовых аккумуляторов. (Учебник стр.103).
Н2SO3
Серни́стая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Химическая формула .
Химические свойства
Кислота средней силы:
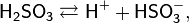
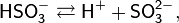
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
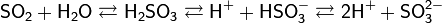
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфиты (в избытке щёлочи):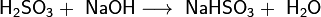
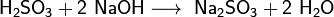
Применение
Сернистая кислота и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей. Гидросульфит кальция (сульфитный щелок, Са(HSO3)2) используют для переработки древесины в так называемуюсульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги)
|
|
|
 Скачать 0.55 Mb.
Скачать 0.55 Mb.
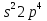
 I2+2KOH
I2+2KOH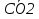 Н2О2+О2
Н2О2+О2
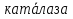 2Н2О+О2
2Н2О+О2