Шпора. Экзамен по химии. 1. Основные понятия в химии вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
17. Электролитическая диссоциация (ЭД). Механизм ЭД. Степень и константа диссоциации, их взаимосвязь. Закон разбавления Оствальда. По своей способности проводить электрический ток, все вещества можно разделить на электролиты – растворы или расплавы этих веществ проводят электрический ток, и неэлектролиты - растворы или расплавы этих веществ не проводят электрический ток. Основные положения теории ЭД: При растворении в воде молекулы электролитов распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. При пропускании постоянного электрического тока через растворы (расплавы) электролитов положительно заряженные ионы двигаются к отрицательно заряженному электроду (катоду) – катионы, отрицательно заряженные ионы к положительно заряженному электроду (аноду) – анионы. Диссоциация – обратимый процесс: одновременно с распадом молекул на ионы протекает обратный процесс – образование из ионов исходных нейтральных молекул. В основе электролитической диссоциации лежит взаимодействие ионного кристалла или поляризованных молекул с полярными молекулами растворителя (в частности, с молекулами воды). За счет электростатического направления диполи воды «вырывают» поверхностные ионы в объеме раствора. При этом ионы находятся в гидратированном состоянии. Если в растворе присутствуют полярные молекулы, то за счет электростатического напряжения диполей воды они подвергаются еще более глубокой поляризации и, в конечном итоге, распадаются на ионы. Реально ионы 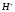 в водных растворах присутствуют в гидратированном состоянии в виде ионов гидроксония в водных растворах присутствуют в гидратированном состоянии в виде ионов гидроксония 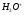 , образование которого можно представить как присоединение , образование которого можно представить как присоединение 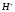 к к 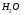 за счет донорно-акцепторной связи. за счет донорно-акцепторной связи.Количественно процесс диссоциации характеризуется степенью диссоциации 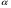 - отношение количества (концентрации) молекул, распавшихся на ионы к общему количеству исходной концентрации молекул растворенного вещества: - отношение количества (концентрации) молекул, распавшихся на ионы к общему количеству исходной концентрации молекул растворенного вещества: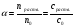 (1). (1).Молекулы сильных электролитов практически полностью диссоциируют в растворе ( 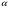 стремится к 1), молекулы слабых электролитов диссоциируют в очень незначительных степенях ( стремится к 1), молекулы слабых электролитов диссоциируют в очень незначительных степенях (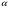 намного меньше 1). намного меньше 1).В растворах слабых электролитов имеет место равновесие, которое характеризуется своей константой равновесия – константой диссоциации (для раствора слабых кислот - 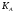 , для растворов слабых оснований - , для растворов слабых оснований - 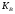 ). ).Т.к. степень диссоциации и константа диссоциации характеризуют один и тот же процесс – диссоциацию слабого электролита, то между ними существует связь. Определим ее на примере диссоциации 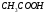 : : 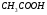 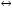  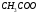  + +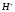 = =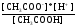 (2). Выразим концентрацию продиссоциировавших молекул через (2). Выразим концентрацию продиссоциировавших молекул через 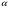 и исходную концентрацию: [ и исходную концентрацию: [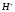 ]=[ ]=[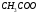  ]= ]=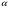 * *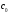 . Непродиссоциировавших молекул в растворе осталось: . Непродиссоциировавших молекул в растворе осталось: 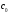 - - 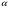 * *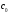 = = 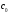 (1- (1- ). Подставим полученное выражение для равновесной концентрации: ). Подставим полученное выражение для равновесной концентрации: 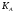 = =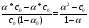 (3). (3).Так как для слабых электролитов 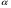 , то ее значением в знаменателе уравнения (3) можно пренебречь. Тогда , то ее значением в знаменателе уравнения (3) можно пренебречь. Тогда 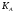 = =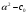 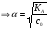 . .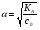 - закон разбавления Оствальда: при снижении концентрации в растворе слабого электролита (разбавление раствора) степень диссоциации возрастает. - закон разбавления Оствальда: при снижении концентрации в растворе слабого электролита (разбавление раствора) степень диссоциации возрастает.Константа диссоциации слабых электролитов - табличные данные, не зависят от концентрации ионов в растворе, а зависят только от температуры. Данное понятие применимо только для слабых электролитов, т.к. для сильных электролитов 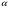 стремится к 1, знаменатель уравнения (3) = 0 и стремится к 1, знаменатель уравнения (3) = 0 и 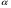 теряет смысл. теряет смысл.К сильным электролитам относятся: все растворимые основания – щелочи (гидроксиды щелочных и щелочноземельных металлов), кроме 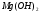 ; ;ряд минеральных кислот, все галогеноводородные (кроме HF): 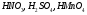 и т.д.; и т.д.;практически все соли (в том числе и малорастворимые). 18. Ионное произведение воды. Водородный и гидроксильный показатель (pH и pOH). Индикаторы. Расчет pH растворов слабых электролитов. Буферные растворы, расчет pH буферных систем. Вода является очень слабым электролитом: при комнатной температуре в чистой воде диссоциирует 1 из 10 молекул. H20↔H++OH- [H+]=[OH-]=10-7 моль/л при T=250(1) Как и для любого слабого элуктролита процесс диссоциации воды характеризуется своей константой равновесия: Kp= 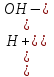 (2) (2)Но т.к. концентрация воды практически не изменяется, вносим конценрация воды под знак константы равновесия; произведения двух постоянных также является величиной постоянной, которая получила название ионного произведения воды (KW) Kw=Kp*[H2O]=[H+][OH-] Kw=[H+][OH-] Kw=[H+][OH-]=10-7*10-7=10-14(3) Kw не зависит от концентрации ионов H+ или OH-, зависит только от температуры. Зная концентрацию одного из ионов H+ или OH- через Kw легко определить концентрацию другого иона [OH-]= 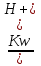 (4) (4)Для количественного отображения концентрации ионов H+ или OH- в растворе ввели понятие водородного показателя pH(аналогичным образом характеризуется и концентрация гидроксилиных ионов OH-=pOH) pH=-lg[H+](5) pOH=-lg[OH-](6) pH≈7 среда нейтральная pH<7 ([H+]>10-7 моль\л) среда кислая pH>7 ([H+]<10-7 моль\л) среда щелочная pH крови 7,35±0,05 слюны 6,35-6,75 желуд.сока 1-2 моча 5-8 кожные покровы 5,5 слезы 7 Определим связь между pH и pOH, для этого прологарифмируем (3) и результат умножим на -1 -lg [H+]-lg[OH-]=14 pH+pOH=14(7) Зная pH или pOH легко определить абсолютные концентрации ионов в расворе [H+]=10-pH [OH-]=10-pOH(15) Индикаторы Индикаторы – вещества, которые изменяют окраску растворов в зависимости от их среды. Как правило индикатор представляет собой сложные орг молекулы либо слабых кислот либо слабых оснований HInd↔H++Ind- Действие индикаторов основано на том, что их молекулярные и ионные формы поглощают видимый свет в разном спектральном диапазоне. При избытке в растворах H+ индикатор преимущественно находится в молекулярной форме(1 окраска). При избытке OH- преимущественно анионная форма(другая окраска).
Наиболее точно pH среды (с точностью до сотых единиц pH) опр инструментальными приборами (pH метрами, ионометрами) Расчет pH растворов слабых электролитов. А) растворы слабых кислот C(HCN)=10-2 M Ka=10-10 α= 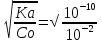 =10-4 =10-4[H+]=αCo=10-4*10-2=10-6M pH=-lg10-6=6 В случае многоосновной слабой кислоты (H2CO3,H3PO4) рассматривать диссоциацию только по 1 ступени, соответственно и константу диссоциации брать по 1 ступени Б) растворы слабых оснований C(NH4OH)=0,1 M Kb=10-5 α 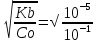 =10-2 =10-2[OH]=αCo=10-2*10-2=10-3M pOH=-lg10-3=3 pH=14-3=11 Буферные растворы Буферные растворы представляют собой смеси слабой кислоты и ее соли, слабого основания и его соли либо смеси солей слабых многоосновных кислот. CH3COOH+CH3COONa NH4Oh+NH4Cl NaH2PO4+Na2HPO4 Особенностью данных растворов явл то, что при прибавлении небольших количеств сильной кислоты или щелочи pH такого раствора практически не меняется. Механизм действия буферного раствора рассмотрим на примере ацетатного буфера CH3COOH+CH3COONa При появлении в растворе избытка H+ (+кислоты) они связываются с ацетат-ионами, обр при диссоциации соли молекулы слабого электролита – уксусной кислоты. При добавлении к раствору щелочи избыток OH- нейтрализуется в реакции с уксусной кислотой, обр молекулы слабого электролита – воды. CH3COO-+H+↔CH3COOH CH3COOH+OH-↔CH3COO-+H2O Главной характеристикой буферных растворов является их pH и буферная емкость. Рассчитаем pH ацетатного буфера. Расчет основан на константе диссоциации уксусной кислоты: CH3COOH↔CH3COO-+ H+(1) Ka= 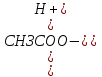 (2) (2)Выразим из ур(2) концентрацию [H+] [H+]=Ka 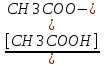 Т.к. соль – сильный электролит, то CH3COONa диссоциирует в растворе полностью и можно считать, что равновесная концентрация ацетат ионов = исходной концентрации соли в буферном растворе. Как следует из ур. Диссоциации (1) присутствие в растворе ацетат ионов смещает равновесие в сторону обр молекул кислоты, т.е. можно считать, что равновесная концентрация кислоты = исходной концентрации кислоты в буферном растворе, тогда ур(3) может быть записано в след виде: [H+]=Ka* 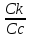 (4) (4)Прологарифмируем ур(4) и умножим на -1 -lg[H+]=-lgKa-lgCk+lgCc(5) pH=pKa+lg 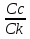 (6) (6)где pKa=-lgKa силовой показатель кислоты рассуждая аналогично для буферных растворов, представляющих смесь для слабого основания и его соли, можно вывести формулу pOH=pKb+lg 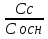 (7) (7)pKb силовой показатель слабого основания Рассчитаем pH ацетатного буфера Сk=Cc=0,1 M, Ka=1.175*10-5 Подставляем в формулу (6) pH=-lg(1.75*10-5)+lg 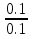 =5-lg1.75=4.76 =5-lg1.75=4.76соотношение компонентов бферного раствора(напр, кислоты и ее соли) как правило берется в соот не превыш 1:10 рассчитаем как измен pH буферного раствора объемом 1 л, с концентрациями кислоты и соли = 0,1 М, если к нему добавить 2 мл 1 молекулярного раствора HCl  (HCl)=2*10-3*1=2*10-3 моль (HCl)=2*10-3*1=2*10-3 мольданное кол-во H+ связывается с ацетат ионами в молекулы уксусной кислоты, при этом концентрация соли в буферном растворе уменьш на 0,002 моль в литре, а конц кислоты возраст на ту же величину. При равенстве конц компонентов буферного раствора, его pH=силовому показателю слабого электролита, т.е. pH=pK pH=pK+lg 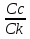 =4,76 +l =4,76 +l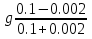 =4.76+lg =4.76+lg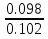 =4.74 =4.74ΔpH=4.76-4.74=0.02 Др важнейшей характеристикой буферного раствора явл его буферная емкость(В) – кол-во эквивалентов сильной кислоты или щелочи, кот можно дабавить к 1 л буферного раствора, чтобы изменить его pH на 1. Буферная емкость опр эквивалентно титрованием пробы буферного раствора сильной кислотой или щельчью известной концентрации, фиксируя при этом изменение pH. Рассчет буф емкости по кислоте и основанию ведут по формулам Ва= 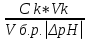 Ba= 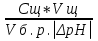 19. Гидролиз солей. Степень и константа гидролиза. Расчет рН растворов солей, образованных слабой кислотой и сильным основанием, сильной кислотой и слабым основанием. Гидролиз солей: В общем случае под гидролизом понимают взаимодействие любых веществ с водой. Рассмотрим частный случай гидролиза – взаимодействие солей с водой. Признаком протекания гидролиза солей является изменение среды раствора с нейтральной на кислотную или щелочную. Сущность гидролиза заключается в образовании слабых электролитов – кислоты или основания – с одновременным появлением в растворе избытка Н+ или ОН-. Если в результате гидролиза образуется слабое основание, то говорят, что гидролиз протекает по катиону, если слабая кислота – по анион, если одновременно и то и другое – то по катиону и по аниону. Соль образована слабым основанием и сильной кислотой: NH4Cl + H2O = NH4OH + HCl NH4+ + Cl- + H2O = NH4OH + H+ + Cl- NH4+ + H2O = NH4OH + H+ (1) При гидролизе данных солей в растворе образовался избыток ионов Н+, среда кислая (рН<7). Так как гидролиз процесс обратимый, то он характеризуется своей константой равновесия. Кр = [NH4OH]*[H+]/[NH4+]*[H2O] (2) При гидролизе концентрация воды практически не изменяется; вносим её под знак константы равновесия; произведение 2х постоянных, так же постоянное, которое обозначают Кг – константа гидролиза. Кг=Кр[H2O] = [NH4OH]*[H+]/[NH4+] Кг=[NH4OH]*[H+]/[NH4+] (3) Умножаем числа и знаменатель уравнения (3) на С(ОН-). Кг=Кw/Кв (4) Для количественной характеристики процесса гидролиза так же введено понятие степени гидролиза h – отношение С (прогидролизированной соли) к исходной С. h=Cгидр/C0 (5) [H+]=[NH4OH]=hC0 (6) [NH4+]=C0–hC0=C0(1–h) (7) Подставим уравнение (6) и (7) в уравнение (3): Кг=h2C0/(1–h) (8) При гидролизе данных солей h<<1 и её значением знаменателя уравнения (8) можно пренебречь и оно принимает вид: Кг=h2C0 (9) h2C0 = Kw/Kв h=корень из Кw/КвС0 (10) Рассчитав степень гидролиза и зная С0 из уравнения (6), мы рассчитываем [H+] и определяем рН раствора данной соли. Соль образована сильным основанием и слабой кислотой: NaCN + H2O = HCN + NaOH CN- + H2O = HCN + OH- pH>7, среда щелочная, избыток ОН-. Ход рассуждения: константа гидролиза, степень гидролиза и концентрация ионов ОН- полностью аналогичны рассмотренным в пункте 1. Кг = Kw/Ka H = Kw/C0Ka [OH-] = hC0 (11) | |||||||||||||||||||
