Шпора. Экзамен по химии. 1. Основные понятия в химии вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
25.Протеолитическая теория кислот и оснований. В основе данной теории лежит способность веществ отдавать или присоединять ион водорода Н+ (протон). Кислота - молекула или ион, способная отдавать протон (донор-протон). HCl Н+ + Cl- NH4+ NH3 + H+ Основание - молекула или ион способный присоединять протон (акцептор-протон). OH- + H+ H2O Кислоты отдавая протон превращаются в частицу стремящиеся его присоединить, которые называются - сопряженное основание. Основание принимающее протон превращается в частицу, стремящуюся его отдать, которая называется - сопряженной кислотой. Кислота сопряженное основание + Н+ Основание + Н+ сопряженная кислота. Совокупность кислоты и его сопряженного основания, а так же основания его сопряженной кислоты, образуют сопряженную кислотно-основную пару. Омфалиты - молекулы или ионы способный как отдавать, так и принимать протоны, способный вступить в реакции характерные как для кислот так и для и оснований. (Классический омфалит вода Н2О). Н2О + HCl H3O+ + Cl- H2O + NH3 NH4+ + OH- Омфалитами так же являются ряд гидроксидов металлов (амфотерные основания), которые растворяются как в кислотах так и в щелочах. Zn(OH)2 + 2HCl ZnCl + 2H2O Zn(OH)2 + 2NaCl Na2[Zn(OH)4] К омфалитам так же относятся ряд биологически активных органических молекул, которые одновременно содержат функциональные группы ответственные за основные и кислотные свойства (аминокислоты, белки и др). O H2N – CH2 - C O - H В молекуле глицина за основные свойства ответственны аминогруппа NH2, за кислотные - карбоксильная группа СООН. В зависимости от рН среды в растворе глицина существует равновесие: в кислой среде (принимаемый протон выступает в качестве основания): O H2N – CH2 – C + Н+ O–H О H3N+ - СН2 – С О – Н В щелочной среде (отдаваемый протон выступает в качестве кислоты): O H2N – CH2 – C + ОН+ O – H О H2N- - СН2 – С + Н2О О – Н Общая, активная и потенциальная кислотность. Содержание кислот в биологических жидкостях и в окружающей среде относятся к факторам влияющим на функционирование клеток, отдельных органов и организма в целом. Поэтому определение кислотности желудочного сока, крови, мочи относят к обязательным анализам, при диагностики заболевания. Охрана окружающей среды так же требует постоянного контроля кислотности почвы, водоемов, осадков. Кислотность подразделяется на: Общую - [Н+]общ Активную свободную - [Н+] акт Потенциальную (связанною) - [ Н +]пот, которая измеряется в молл/л, в клинической практике в титрационных единицах. Общая кислотность - концентрация ионов Н+ (свобод и связанных) присутствующих в растворе. Равна сумме нормальных концентраций всех кислот в растворе. Общую кислотность определяют титрованием щелочью, в присутствие индикатора, точка эквивалентности которой (точкам перехода окраски) лежит в диапазон рН= 8-10 (слабощелочная среда). В качестве индикатора как правило используют фенолфталеин. (Титрование ведут до появления устойчивой, слабо розовой окраски). Активные кислоты концентрации свободных ион Н+ присутствуют в растворах. Ионы Н+ появляются как в результате диссоциации сильных кислот так и слабых, однако слабые кислоты, диссоциируют в незначительной степени и кроме того в присутствие сильных кислот их диссоциация подавляется, т.к в соответствии с принципами Леша-Терье равновесие смещается в сторону образования молекул слабой кислоты: CH3COOH CH3COO- + H+ Поэтому под активной кислотностью, понимают суммарную нормальную концентрацию присутствующие в растворе сильных кислот. Эту кислотность определяет либо инструментальными методами (ионамеры, рН - метры), либо титрование сильной щелочью, в присутствии индикатора точка эквивалентности которая лежит в диапазоне рН 2-4. Если в качестве индикатора использовать метилоранж то титрование ведут до перехода окраски с розовой на желтый. Потенциал (связанная) кислотность - концентрация ионов Н+ связанных с молекулами или ионами, слабых кислот. Определяют, как разность между общей и активной кислотностью, равна суммарной нормальной концентрации слабых кислот. Для определения всех типов кислотности титрование проводят сил щелочью в присутствие двух индикаторов (метиловокрасный (активная кислотность), фенолфталеина (общая кислотность)). Отмечают 2 точки эквивалентности: При рН 2-4 определяет активную кислотность; При рН 8-10 определяет общую кислотность. По разности между общей и активной кислотностью определяют потенциальную (связанную кислотность): [H+]пот = [H+]общ – [H+]акт рН В биохимических исследования при определении кислотности желудочного сока в качестве сильных кислот выступает НСl в качестве связанной кислоты - соли белкового происхождения, нейтрализация которой протекает по уравнению: [R-NH3+]Cl- + OH- R*NH2 + H2O + Cl- При определении концентрации белковых солей для нахождения общей кислотности используют индикатор ализаминсульфоновокислый точка перехода окраски которого лежит в диапазоне рН 5-6,8. Концентрацию солей находят по разности между общей и активной кислотностью. К клинической практике. Кислотность желудочного сока выражают в клинических (титрационных (т.е)) единицах - число мл 0,1 молярного раствора (NaOH) которое необходимо затратить на титрование 100 мл отфильтрованного желудочного сока. При выполнении лабораторных работ для перехода от объема щелочи затраченного на титрование к титрационным единицам необходимо затраченный объем умножить на 10. В норме общая кислотность желудочного сока должна составлять 40-60 т.е. При язве повышенная кислотность, при инфекционных заболеваниях, гастрите, раке - пониженная. В норме активных кислот - 20-40 т.е 26.Протолитический баланс. Важнейшим фактором гомеостаза живых организмов явл. Поддержание кислотноосновного (протеолитического баланса) баланса на необходимом уровне. В результате жизнедеятельности человека в организме образуется большое кол-во различных кислот, больше всего угольной-до 13 моль/сутки которое выделяется при дыхании. Помимо СО2 в организме образуется ряд нелетучих кислот(серной, фосфорной, молочной) в количестве от 0,03 до 0,о8 моль/сутки. Однако при ряде заболеваний это количество может возрастать. Пример:при сахарном диабете до 1 моль/сутки. Большинство биожидкостей в организме способно сохранять постоянным значение pH при незначительном воздействии, т.к. в них присутствует буферная система. Расчет pH буфнрных систем проводят по уравнению (ендерсона-Хассельбаха (1)pH=pKa+LgCa/Ck (для кислотных буф.сист)(2) pOH=pKb+LgCc/Cосн (для основных буф. сист) наиболее эффективное действие буфюсист. Наблюдается при соотношении компонентов (донор-акцептор протонов) не привышающим 10, при этом pH р-ра изменяется не больше чем на единицу. Буферные сист. организма. Основными буф. сист. явл. : гидрокарбонатная, фосфатная, гемоглобиновая, белковая (протеиновая). Гидрофосфатная буф.сист. Содержится как в крови так и в клеточной жидкости других тканей (особенно в почках). В в клеточной жидкости представлена в виде солей калия (H2PO4+K2HPO4)а в плазме крови-в виде солей натрия (NaH2PO4+Na2HPO4)В качестве донора протонов (кислоты)вступают дигидрофосфат ионы H2PO4- в кач. Оснований (акцепторы протонов) HPO42-. Эти 2 аниона образуют сопряженную кислотноосновную пару. H2PO4- 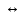 H++HPO42-(d)Константа равновесия обратима р-ции d представляет собой константу диссоциации H3PO4 по второй ступени: Ka2= H++HPO42-(d)Константа равновесия обратима р-ции d представляет собой константу диссоциации H3PO4 по второй ступени: Ka2= 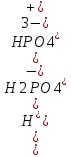 =1,58* =1,58*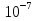 (7)Из уравнения (7) выразим соотношение фосфатных форм (с учетом конц. Ионов H+ в плазме крови уравнение (5) (7)Из уравнения (7) выразим соотношение фосфатных форм (с учетом конц. Ионов H+ в плазме крови уравнение (5)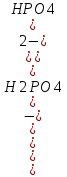 = =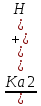 = =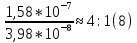 Из полученного соотношения (8) следует что фосфатная буф.сист. так же имеет большую емкость по кислоте чем по основанию (в 4 раза). В Случае появления во внутриклеточной жидкости избытка ионов H+ протекает реакция 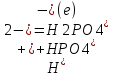 Образовавшийся дигидрофосфат ион H2PO4- выводится почками при этом pH мочи понижается, что имеет место при избыточном употреблении мяса. При употреблении растительной пищи во внутриклеточной жидкости образуется избыток гидроксильных ионов OH-, которые нейтрализуются по реакции Образовавшийся дигидрофосфат ион H2PO4- выводится почками при этом pH мочи понижается, что имеет место при избыточном употреблении мяса. При употреблении растительной пищи во внутриклеточной жидкости образуется избыток гидроксильных ионов OH-, которые нейтрализуются по реакции 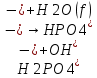 Образующийся гидрофосфат ионы так же выводятся почками,при этом pH мочи возрастает. Поэтому кислотность мочи изменяется в широком пределе (4,8-7,5) Образующийся гидрофосфат ионы так же выводятся почками,при этом pH мочи возрастает. Поэтому кислотность мочи изменяется в широком пределе (4,8-7,5) Гемоглобиновая буферная система. ГБС-важнейшая система в эритроцитах. В качестве доноров протонов вступают 2 слабые к-ты HHb и HHbO2. В качестве акцепторов протонов выступают сопряженные им основания-анионы этих кислот. HHb↔ 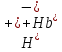 ,pK=8,2(K) ,pK=8,2(K)HHbO2↔ 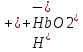 ,pK=6,96(L)Из пространственных силовых показателей видно, что HHb является более слабой к-ой, поэтому при наличии избытка ионов H+ их акцептором в первую очередь будет вступать анион Hb- (в следствии равновесия в системе смещается в сторону образования более слабого электролита) ,pK=6,96(L)Из пространственных силовых показателей видно, что HHb является более слабой к-ой, поэтому при наличии избытка ионов H+ их акцептором в первую очередь будет вступать анион Hb- (в следствии равновесия в системе смещается в сторону образования более слабого электролита)При избытке гидроксильных ионов OH- они в первую очередь будут нейтрализоваться оксигемоглобином как более сильной к-той HHbO2+ 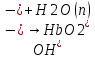 Гемаглобиновая буф.сист. участвует в важнейших физиологических процессах одновременно:дыхание,транспорт кислорода в ткани, поддержание постоянства pH в эритроцитах и плазме крови. Эффективное функционирование гемоглоб. буф. сист. возможно только в сочетании с другими буф.сист. Гемаглобиновая буф.сист. участвует в важнейших физиологических процессах одновременно:дыхание,транспорт кислорода в ткани, поддержание постоянства pH в эритроцитах и плазме крови. Эффективное функционирование гемоглоб. буф. сист. возможно только в сочетании с другими буф.сист.Гидрокарбонатные буф.сист. В организме чел. Присутствует сложное углекислотное равновесие CO2 +H2O↔H2CO3↔H++HCO3-(a)В этой буф.сист. донором протонов явл. HCO3,акцептором HCO3-(гидрокарбонат ион). Т.к в физиологических жидкостях все формы H2CO3 (растворены CO2 и молекулы H2CO3) рассматривался как единое целое, то кислота диссоциации H2CO3(по первой ступени) отличается ее термодинамического значения. (3)Ka=[H+][HCO3-] =7,95 *10-7 (pK=6,1) [CO2]+[H2CO3] (4)Ka=[H+][HCO3-] =4,45 *10-7 (pK=6,36) [H2CO3] гидрокарбонатная буф.сист.-основная буф.сист плазмы крови, также содержится в эритроцитах, в межклеточной жидкости и почечной ткани. В норме ph крови -7,4±0.05 соответственно [H+]=10-pH=10-7,4=3,98*10-8 моль/л (5) Из уравнения (3) найдем соотношение гидрокарбонатной и молекулярной форм угольной к-ты9приняв концентрацию ионов H+ из уравнения (5) 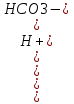 Из соотношения (60 следует: емкость гидрокарбонатного буфера по кислоте 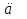 буферной емкости по основанию,что отвечает особенностям метаболизма человеческого организма.избыток ионов H+ нейтрализуется HCO3- ,при этом образуется CО2.которое выводится из организма при дыхании. буферной емкости по основанию,что отвечает особенностям метаболизма человеческого организма.избыток ионов H+ нейтрализуется HCO3- ,при этом образуется CО2.которое выводится из организма при дыхании.HCO3-+H+  CO2+H2O(b)Избыток гидроксильных ионов нейтрализуется собственно угольной кислатой с образованием гидрокарбонат-ионов H2CO3+OH-→HCO3-+H2O(c)Реакции (и) и (с) отражают работу гидрокарбонатной буферной системы, основное предназначение которой нейтрализация кислот. Гидрокарбонатная буф.сист. эффективного и быстрого действия, нарушение протеолитического баланса нейтрализуется за 10-15 мин. А восстановление осуществляется за 10-18 мин. CO2+H2O(b)Избыток гидроксильных ионов нейтрализуется собственно угольной кислатой с образованием гидрокарбонат-ионов H2CO3+OH-→HCO3-+H2O(c)Реакции (и) и (с) отражают работу гидрокарбонатной буферной системы, основное предназначение которой нейтрализация кислот. Гидрокарбонатная буф.сист. эффективного и быстрого действия, нарушение протеолитического баланса нейтрализуется за 10-15 мин. А восстановление осуществляется за 10-18 мин.Ацидоз. Алкалоз. Все буф.сист. в организме характеризуются в соотношении 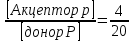 Т.е все буф.сист обладают повышенной емкостью по кислоте. Что соответствует метаболизму генов. Ацидоз-уменьшение Ba физиологической системы в сравнение с нормой. Алкалоз - увеличение Ba(Кислотно буф.емкость)Ацидоз(алкалоз) может быть экзогенного и эндогенного характера. В случае экзогенного ацидоза к-ты ввод. В орг. Из вне (пища и т.д) В случ. эндогенного - нарушение протеолитического баланса наступает в следствии наруш скорости синтеза и вывода к-ты и оснований. В зависимости от глубины пат. изменений различают комплементарный и некомплементарный ацидоз (алкалоз). При комплементарном несмотря на отклонение от нормы кислотно-буф емкости pH крови ост. В пределах 7,35-7,45. При некомплементарном ацинозе.ph снижается до значений 6,8-7,35,при алкалозе pH крови повыш до 7,35-7,9. Снижение ph называется-ацидемией, повышение - алколимией. Отклонение pH от нормы 0,6-летальный исход. При ацидозе в кач экстренной формы используют внутреннее вливание NaHCO3-100-200мл 4% р-ра. Для устранения алкалоза использ. 5% р-р аскорбиновой к-т частично нейтрализованной гидрокарбонатом Na до pH 6-7 Т.е все буф.сист обладают повышенной емкостью по кислоте. Что соответствует метаболизму генов. Ацидоз-уменьшение Ba физиологической системы в сравнение с нормой. Алкалоз - увеличение Ba(Кислотно буф.емкость)Ацидоз(алкалоз) может быть экзогенного и эндогенного характера. В случае экзогенного ацидоза к-ты ввод. В орг. Из вне (пища и т.д) В случ. эндогенного - нарушение протеолитического баланса наступает в следствии наруш скорости синтеза и вывода к-ты и оснований. В зависимости от глубины пат. изменений различают комплементарный и некомплементарный ацидоз (алкалоз). При комплементарном несмотря на отклонение от нормы кислотно-буф емкости pH крови ост. В пределах 7,35-7,45. При некомплементарном ацинозе.ph снижается до значений 6,8-7,35,при алкалозе pH крови повыш до 7,35-7,9. Снижение ph называется-ацидемией, повышение - алколимией. Отклонение pH от нормы 0,6-летальный исход. При ацидозе в кач экстренной формы используют внутреннее вливание NaHCO3-100-200мл 4% р-ра. Для устранения алкалоза использ. 5% р-р аскорбиновой к-т частично нейтрализованной гидрокарбонатом Na до pH 6-727.Биогенные элементы- элементы ответственные за построение и жизнедеятельность клеток организма. Важнейшие биогенные элементы: 1. Элементы-органогены 2. Металлы жизни 3. Различные макро- и микроэлементы Элементы-органогены- главные химические элементы, входящие в состав организма, составляющие основу жизнедеятельности живых организмов. К ним относятся: углерод (С), водород (Н), кислород (О), азот (N), фосфор (Р), сера (S) О- 62,4% С-21% Н- 9,7% N- 3,1% Р- 0,95% S-0,16% Активное участие в процессах жизнедеятельности принимают 10 элементов металлов ( «металлы жизни» ) Кальций- 1700г Натрий- 70г Калий- 250г Магний-42г Марганец- 12мг Железо- 5г Кобальт- 1,5 мг Медь- 0,2г Цинк- 3г Молибден- 9мг На долю этих элементов приходится 2,4 от массы тела ( расчеты на 70 кг) Кальций и Магний в основном находятся в костных тканях, остальные в виде биокомплексов. Элементы, содержание которых >10-3 % называются макроэлементами. Их главная функция заключается в построении ткани и поддержании осмотического водно-электролитного, кислотно- основного, окислительно-восстановительного гомеостаза. (напр: Фтор, Бром, Кремний..) Элементы, содержание которых в организме от 10-6 до 10-4 % называются микроэлементы. Они входят в состав ферментов, гормонов, витаминов в основном в качестве комплексообразователя (активаторы обменных процессов) Элементы-токсиканты - ряд элементов, опасных для жизнедеятельности живых организмов (т.к. обладают токсичностью вплоть до летального исхода). Бериллий, Барий, Мышьяк, Свинец, Кадмий итд. Микроэлементы жизненно необходимые для организма должны находится в организме в строго определенном содержании. В противном случае наблюдается нарушение жизнедеятельности вплоть до летального исхода Оптимальное содержание Селена в организме для сердечно-сосудистой системы примерно 14мг. Если больше, то это уже яд для организма. Водород и его свойства Его содержание на планете примерно 1%, массовое содержание во вселенной порядка 50% (самый распространенный элемент). Половина массы солнца приходится на водород. Энергия солнца, доходящая в виде светового излучения выделяется приемущественно в результате термоядерных реакций между изотопами* водорода. За 1с на солнце сгорает 4 млн.тон вещ-ва. * Изотоп- атом химического элемента, отличающийся от другого атома того же элемента своей массой В природе водород представлен двумя изотопами: Протий - необычный элемент, так как в ядре его нет нейтронов. Если в ядре появляется нейтрон, то такой водород называется дейтерий. Также есть искусственно полученный радиоактивный изотоп тритий На 1 атом дейтерия приходится 6800 атомов протия. Распространенность в природе: - основной минерал H2O - углеводороды (нефть, газ) - живая природа (флора, фауна) Физические свойства Бесцветный газ, без вкуса, запаха, мало растворим в H2O, tкип= -2530С. На внешнем энергетическом уровне 1ê, принимая один электрон до завершения своего энергетического уровня, проявляет окислительные свойства. В реакциях с активными Ме. Сa+ H2= CaH2 Отдавая электрон проявляет восстановительные свойства. Водород реагирует с большинством неметаллов. Н2 + Br2 = 2HBr (при t). Вода и ее свойства Бесцветная прозрачная жидкость без вкуса и запаха, tкип=1000С при давлении 1 атмосфера. Удельная теплоемкость 4190 Дж/кг. На H2O приходится 60 % от массы тела. Потребность чел-ка в воде 35г на 1кг. Свойства: Взаимодействует с активными Ме и их оксидами 2Na + H2O = 2NaOH + H2 CaO + H2O = Ca(OH)2 С кислотными оксидами SO3 + H2O = H2SO4. Образование кристаллогидрата CuSO4 + 5H2O= CuSO4·5H2O Реакция фотосинтеза 6СО2 + 6Н2О → С6Н12О6 + 6О2 ( при условии хлорофилла и солнечного света) Вода за счет неподеленных электронных пар на атоме О является активным лигандом, образуют комплекты с переходными Ме. [Cr(H2O)6]3+ Тяжелая вода (D2O). В обычной H2O≈0,02 D2O в чистом виде. D таксично по отношению к обычной воде. Тяж.вода обладает меньшей реакционной способностью. В частности при электролизе H2O разлагается, а D2O накапливается.(многократный электролиз H2O способ получения D2O) Физические свойства: tплавления=3,80С, tкипения=101,40С, плотность 1,1 г\см3 при t=250C Апирогенная вода (вода для инъекций)- препарат, не содержащий пирогенных веществ(Вещества бактериального происхождения и продукты их жизнедеятельности вызывающие нарушение сердечно –сосудистой деятельности, озноб, головные боли) Получают ее двойной дистилляцией(перегонкой). Используется для приготовления лекарственных форм |
