Шпора. Экзамен по химии. 1. Основные понятия в химии вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
20 .ОВР. Основные понятия. Метод электронного баланса. Метод полуреакций. Классификация ОВР. ОВР – реакции, происходящие с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается. В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается Степень окисления – условный заряд атомов в молекуле или сложном ионе, вычисляется, исходя из предположения, что молекулы состоят только из ионов, причем сумма степени о-ния в молекуле равна 0, а в сложном ионе – заряду иона. Правило определения С.О. : С.О. атомов в простых в-вах (Н2, О2, металлы) равна 0 С.О. Н2 в соединениях всегда +1, за исключением соединений с металлами (NaH, CaH2) С.О. О2 в соединениях всегда -2, за исключением Н2О2 и ее солей металлы в соединениях проявляют только положительную С.О., причем у металлов с постоянной валентностью (щелочные/щелочноземельные металлы, Zn, Al) С.О. равна номеру их группы Восстановитель – вещество, которое отдает электроны; Окислитель – вещество, принимающее электроны; Восстановление – процесс присоединения электронов; Окисление – процесс отдачи электронов При протекании ОВР должен соблюдаться баланс зарядов – число отданных и принятых электронов должно быть равно. На этом основан подбор коэффициентов в уравнениях ОВР. Применяют 2 метода: метод электронного баланса; метод полуреакций Алгоритм метода электронного баланса: определяем С.О. атомов, изменивших свою С.О. в ходе реакции; составляем схемы перехода электронов для восстановителя и окислителя; находим наименьшее общее кратное между числом отданных и принятых электронов; разделив полученное число на количество отданных электронов, находим коэффициент к восстановителю, разделив на кол-во принятых электронов – к окислителю; переносим полученные коэффициенты к восстановителю и окислителю и к их продуктам в основное уравнение реакции; для остальных участников реакции коэффициент находим на основании материального баланса – число атомов каждого элемента в левых и правых частях уравнения должно быть равно. Окончательная проверка правильности ОВР – баланс по кислороду. Метод полуреакций для уравнивания ОВР. Метод полуреакций является удобным и универсальным методом уравнивания окислительно-восстановительных реакций. Рассмотрим на примере реакции: Fe + 2HCl = FeCl2 + H2 определим степени окисления каждого элемента в каждом соединении в левой и правой частях уравнения. Fe0 → Fe+2 - элемент потерял электроны, повысил степень окисления (окислился); H+1 → H0 - элемент получил электроны, понизил степень окисления (восстановился); Cl-1 → Cl-1 - степень окисления элемента не изменилась. Полуреакцией восстановления называется реакция, описывающая превращение элемента-окислителя, записанная в ионном виде: 2H+ +2e- = H2 Полуреакцией окисления называется реакция, описывающая превращение элемента-восстановителя, записанная в ионном виде: Fe = Fe2+ + 2e- Суммарное уравнение и является уравнением ОВР, записанном в ионном виде. При "сложении" полуреакций окисления и восстановления каждую полуреакцию следует умножить на соответствующий коэффициент таким образом, чтобы в левой и правой части уравнения было одинаковое количество электронов. В данном случае и в левой, и в правой части по два электрона, поэтому умножать не нужно. (Точнее, эти коэффициенты равны единице). Fe + 2H+ = Fe2+ + H2 - уравнение ОВР в ионном виде. Для перехода в стандартный вид добавим противоионы - в нашем случае хлорид-ионы Cl-. Fe + 2HCl = FeCl2 + H2 Классификация ОВР: Межмолекулярные – атомы окислителя и восстановителя содержатся в молекулах разных веществ. 2FeCl2 + Cl2 = 2FeCl3 Внутримолекулярные – атомы окислителя и восстановителя содержатся в молекуле одного и того же вещества (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O К этому типу реакций относят случаи, когда атомы одного и того же элемента и с разной С.О. содержатся в молекуле одного и того же вещества. Реакции диспропорционирования – атомы одного и того же элемента, находясь в одной степени окисления одновременно повышают и понижают свою С.О. 4KClO3 = 3KClO4 + KCl 21. Перманганатомерия; иодометрия: определение концентрации Н2О2 и активного хлора в хлорной извести. Эквивалент в ОВР. Перманганатометрия – относится к ОВ методам титрования. Титрантом метода является перманганат калия – KMnO4 – сильный окислитель и вступает в реакции со многими восстановителями. Определение проводится в кислой среде, в щелочной и нейтральной. MnO4 (роз – чисто фиолет) => (pH<7) H+ Mn2+ (бесцв), … =>(pH=0, H2O) MnO2 (бурый), … => (pH>7) MnO42- (зел) Одним из преимуществ перманганатометрии является титр – возможность фиксирования точки эквивалентности без использования индикатора (розовая окраска проходит в конце титрования – избыточная капля). Прямым перма. Методом можно определить большинство восстановителей. Определение солей железа 2 5Fe2+ + MnO4- + 8H+ => 5Fe3+ + Mn2+ + 4H2O Йодометрия. Косвенно для определения индифферентных в ОВ плане веществ: Ca2+ + C2O42- => CaC2O4↓ Косвенный метод – в котором в качестве вспомогательного реагента применяется иодид калия, а титрантом является Na2S2O3. Йодометрический метод – основан на ОВ процессах, связанных с реакцией восстановления J2 + 2e => J- или с реакцией окисления 2J- - 2e => J2 Иодометрия используется для: 1)определения восстановителей окислением их раствором иода: 2Na2S2O3 + J2 => 2NaJ + Na2S4O6 2S2O32- - 2e => S4O62- J2 + 2e =>2J- 2) для определения окислителей восстановлением иодид-ионами 2KMnO4 + 10KJ + 8H2SO4 => 5J2 + 2MnSO4 + 6K2SO4 + 8H2O 3) для определения кислот (косв мет титр) HCI + KJ + KJO3 => J2 + H2O + KCI 2JO3- + 12H+ + 10e => J20 + 6H2O 2J- - 2e => J20 JO3- + 5J- + 6H+ => 3J2 + 3H2O Определение активного хлора в хлорной извести. Белильная известь – один из самых сильных окислителей. Представляет собой смесь хлоридов (CaOCI2). В кислой среде она выделяет свободный активный хлор, который при обработке белильной извести KJ окисляет иодид ионы. CaOCI2 + 2H+ => Ca2+ + CI2 + H2O CI2 + 2J- => 2CI- + J2 Количество выделившегося йода эквивалентно количество и активного хлора: выделившийся йод затем оттитровывают тиосульфатом натрия: J2 + 2S2O3 => 2J- + S4O62- Затраченное количество тиосульфата натрия косвенно эквивалентно количеству активного хлора. n(CI2)=n(J2)=n(Na2S2O3) Эквивалент ОВР: М ок-вос делить на число принятых или отданных е Cu + 2H2SO4 => CuSO4 + SO2 + 2H2O Э(Cu) = M/2 = 32г/экв Сu0 – 2e => Cu2+, SO4 + 4H+ + 2e => SO2 + 2H2O Э(H2SO4) = M/2=49г/экв 22.Растворы, их классификация. Способы выражения концентрации растворов, массовая доля, норм концентрация, молярная концентрация, титр. Коэффициент растворимости, зависимость от температуры для твердых веществ и газов. Раствор - однородная смесь, состоящая из частиц растворенного вещества ,растворителя и продуктов их взаимодействия. Классификация растворов: -по агрегатному состоянию – твердые, жидкие, газообразные. -по размеру частиц – коллоидные и истинные. В истинных растворах размер частиц менее 1·10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10−9 м — 5·10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа. - По наличию или отсутствию электролитической диссоциации растворы подразделяют на два класса – растворы электролитов и неэлектролитов. Растворы электролитов – растворы диссоциирующих на ионы солей, кислот, оснований. Электрическая проводимость растворов электролитов выше, чем растворителя. Растворы неэлектролитов – растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электрическая проводимость растворов неэлектролитов мало отличается от растворителя. Концентрацию веществ можно выразить различными способами. Наиболее часто встречается массовая доля растворенного вещества, нормальная (эквивалентная) , молярная и моляльная концентрации. Массовая доля - безразмерная величина, характеризующая отношение растворенного вещества к общей массе раствора. Находится по формуле – 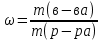 Нормальная концентрация - количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль - экв. /л или г - экв./л (имеется в виду моль эквивалентов).Эквивалент – реальная или условная частица вещества, которая в данной кислотно-основной реакции (не ОВР!) эквивалента одному иону водорода. Молярная концентрация - количество растворённого вещества (число моль) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л .Находим по формуле - 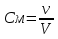 . .Моляльная концентрация — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в моль/кг. Находится по формуле 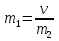 . .Титр раствора — масса растворённого вещества в 1 мл раствора. Находится по формуле – 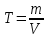 . .Коэффициент растворимости – отношение массы безводного растворенного вещества к массе воды. Находится по формуле - 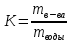 . .Растворимость вещества имеет непосредственную зависимость от температуры. Как правило, растворение твердых тел сопровождается поглощением теплоты (т.к. необходимо затратить энергию на разрыв связей в кристалле). Поэтому при повышении температуры растворимость возрастает. Растворение газа в жидкости можно формально представить уравнением "реакции": газ + жидкость = жидкий раствор + Q . Применяя к нему принцип Ле Шателье, который говорит что, при повышении температуры равновесие смещается в сторону эндотермического процесса (в данном случае влево). Т.е. при повышении температуры растворимость газа уменьшается. 23.Коллигативные свойства, законы Рауля, закон Вант-Гоффа Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят: 1) понижение давления насыщенного пара растворителя над раствором, 2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей. 3) осмотическое давление. 1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя. ДОПЕЧАТАТЬ СЮДА ФОРМУЛЫ где Р – давления насыщенного пара растворителя над раствором, Па; Р0 – давления насыщенного пара над растворителем, Па; (р-ля) – мольная доля растворителя; (раств. в-ва) – количество растворенного вещества, моль; (р-ля) – количество вещества растворителя, моль. Иногда закон Рауля определяют следующим образом. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. где (раств. в-ва) – мольная доля растворенного вещества. 2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества: ДОПЕЧАТАТЬ СЮДА ФОРМУЛЫ где tкип – повышение температуры кипения раствора, С; tзам – понижение температуры замерзания раствора, С; Кэ – эбуллиоскопическая константы растворителя, (кгС)/моль; Кк – криоскопическая константы растворителя, (кгС)/моль; b – моляльная концентрация, моль/кг; (раств. в-ва) – количество растворенного вещества, моль; m(р-ля) – масса растворителя, кг; m(раств. в-ва) – масса растворенного вещества, г; М(раств. в-ва) – молярная масса растворенного вещества, г/моль. Зная температуры кипения и замерзания чистых растворителей и t можно рассчитать температуры кипения и замерзания растворов: tкип.(р-ра) = tкип.(р-ля) + tкип. tзам.(р-ра) = tзам.(р-ля) – tзам. Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора. ДОПЕЧАТАТЬ СЮДА ФОРМУЛЫ где Росм – осмотическое давление, кПа; с – молярная концентрация растворенного вещества, моль/л; R – универсальная газовая постоянная, 8,314 Дж/(мольК); Т – абсолютная температура, К; V(р-ра) – объем раствора, л. Осмос – односторонняя диффузия вещества через полупроницаемую мембрану. Осмотическое давление – сила, обуславливающая осмос. Оно равно внешнему давлению, при котором осмос видимо прекращается. Указанные законы справедливы для разбавленных растворов неэлектролитов. Их можно применять и к растворам электролитов, но в этом случае необходимо вводить изотонический коэффициент Вант-Гоффа (i). Это поправочный коэффициент, который учитывает увеличение числа частиц в растворе электролита из-за диссоциации на ионы. ДОПЕЧАТАТЬ СЮДА ФОРМУЛЫ Значение изотонического коэффициента Вант-Гоффа рассчитывают как частное от деления экспериментальных и теоретических значений осмотического давления, изменения температур кипения и замерзания растворов и понижения давления растворителя над раствором. 24 . Комплексные соединения, классификация, структура, номенклатура. Химическая связь в КС. - вещества, молекулы которых содержат комплексный ион. Структура комплексных соединений: [Ag(NH3)2]CL, где Ag – ион – комплексообразователь; (NH3)2 – лиганд; 2- координационное число; CL – ион внешней сферы; [Ag(NH3)2] – комплексный ион. В качестве ионов комплексообразователей, как правило, выступают катионы переходных Ме ( d – элементы) 1, 2, 7,8 групп. В качестве лигандов могут выступать : 1)простые ионы(Fˉ,Clˉ..) 2)сложные ионы( СNˉ,S2O3ˉ) 3)нейтральные молекулы( Н2О, NH3..) 4)органические молекулы сложного состава( комплексон 3=трилон Б=ЭДТА=динатриевая соль этилендиаминтетрауксусной кислоты) В зависимости от заряда комплексного иона различают: катионные, анионные,нейтральные комплексы. Номенклатура. Прежде чем дать название комплексному соединению необходимо определить степень окисления иона комплексообразователя. Определяется на основании баланса зарядов в молекуле – суммарный заряд всех частиц, образующих молекулу, должен быть равен 0. С.о иона комплексообразователя в названии комплексных соединений указывается в скобках римскими цифрами. 1) Название катионных комплексов. К названию анионов внешней сферы добавляется название комплексного катиона, которая образуется путем перечисления лигандов с указанием их количества, далее одно слово следует название Ме – комплексообразователя с указанием его с.о. [Ag(NH3)2]Cl – хлорид диаминсеребра. При нескольких лигандах в комплексном ионе первыми перечисляются те, которые несут заряд. При этом все лиганды связываются с названием комплексообразователя через букву «О», кроме молекулы аммиака ( название –«амин») и молекул воды( «аква») 2)Анионные комплексы. Сначала следует название комплексного аниона, который образуется путем перечисления лигандов с указанием их количества, после чего следует название Ме, заканчивающихся на суффиксе «-ат», в скобках указывается с.о комплексообразователя и окончательно следует название катионов внешней сферы. В названиях комплексообразователей в комплексных анионах используют латинские названия Ме: Fe – феррат; N- никелат; Co – кобальтат. Образование связи комплексных соединений. Отличительной особенностью К.С. является наличие прочных ковалентных связей между ионом комплексообразователя и лигандом, преобразованного по донорно- акцепторному механизму, путем размещения неподеленных электронных пар лигандов, в свободных орбиталях ионов комплексообразователей. Ионная связь образуется между ионом внешней сферы и комплексным ионом. Диссоциация комплексных соединений. При диссоциации комплексных соединений различают: первичную диссоциацию – распад на комплексный ион и ион внешней сферы. Протекает необратимо. Вторичную – распад комплексного иона на ион комплексообразователь и лиганды. Обратимый процесс, количественно характеризуется своей константой равновесия, называемой константой нестойкости. К=[Ag⁺][NH3]2⁄[[Ag(NH3)+2] Наряду и Кн используется понятие константы устойчивости. Куст=1⁄Кн |
