Шпора. Экзамен по химии. 1. Основные понятия в химии вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
5.Принципы и правила заполнения орбиталей. Принцип минимальной энергии. Принцип запрета Паули. Правило Хунда. Правило Клечковского. Область около ядерного пространства, которая наиболее вероятна в нахождении электронов называется атомной орбиталью (орбиталью). Электроны с приблизительно равной энергией находится на приблизительно равном расположении от ядра, образуя электронный слой или энергетический уровень, располагаясь на различных энергетических подуровнях. Распределение электронов в атоме по энергетическим подуровням основывается на квантовых числах и следующих правилах: 1)принцип минимальной энергии 2)принцип Паули 3)правило Хунда 4)правило Клечковского 1)Принцип минимальной энергии : электроны в атоме распределяются по подуровням в порядке возрастания энергии атомных орбиталей. 2)Принцип запрета Паули: в атоме не может быть двух электронов со всеми одинаковыми квантовыми числами. Следствие: в атоме не может быть в одной орбитали более двух электронов (в орбитали 1 или 2 электрона, либо она свободна). 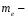 магнитное квантовое число; n=2; L=1; магнитное квантовое число; n=2; L=1; 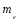 =0; =0; 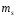 = =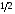 3)Правило Хунда: в пределах первого подуровня электроны располагаются по орбиталям таким образом, чтобы их суммарный спин был max. Следствие: при заполнении подуровня 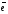 размещается сначала по одному в орбитали и только затем в орбитали появляется по два размещается сначала по одному в орбитали и только затем в орбитали появляется по два 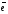 . .4)Правило Клечковского: 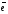 по орбитали располагаются в порядке возрастания суммы главного и орбитального чисел (n+ по орбитали располагаются в порядке возрастания суммы главного и орбитального чисел (n+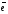 ). ).В случае, когда для разных подуровней эта сумма одинакова, 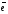 размещаются на подуровне с меньшим значением главных квантовых чисел n. размещаются на подуровне с меньшим значением главных квантовых чисел n.6. Периодический закон и периодическая система элементов Д. И. Менделеева с точки зрения электронного строения атомов. Периодические свойства элементов: энергия ионизации, энергия сродства к электрону, электроотрицательность, радиус атома Периодический закон - св-ва элементов, а также св-ва и формы их соединений находящиеся в периодической зависимости от заряда ядер элементов (от атомной массы в формулировке Менделеева). Графическим отображением периодического закона является периодическая система химических элементов (ПСХЭ) Структура ПСХЭ В ПСХЭ все элементы сгруппированы в горизонтальные ряды-периоды, и вертикальные столбцы-группы Различают 2 формы ПСХЭ- длинную и короткую. Длинная форма: периоды представлены в один ряд, а каждая подгруппа выделена в один столбец. Недостаток - отсутствие наглядности и компактности, трудно выделить отдельный элемент. Короткая форма является более наглядной. Недостаток - элементы главной и побочной подгрупп объединены в одну группу, длинные периоды представлены в 2 ряда, причём отдельно выделены f элементы. В таблице выделяют первых 3 коротких периода (содержат 2; 8;S элементов), и 4 длинных: в 4 и 5 по 18 элементов, в 6- 32 элемента, последний 7- незавершённый. Каждый период начинается с щелочного металла (с атомами водорода) и заканчивается благородным газом, т.е в периодах свойства элементов изменяется от Ме до неМе. В группах выделяют главную подгруппу ( начинается с элементов 2 и 3 периодов) и побочных подгрупп. В главных подгруппах располагаются s и p элементы, в побочных d и f элементов. Принципиальной особенностью элементов, расположенных в главных подгруппах, является одинаковое строение внешнего( валентного) энергетического уровня. Для элементов побочных подгрупп это не соблюдается. Рассмотрим строение d элемента главных подгрупп Li 2s, Na 3s -ns1 Be 2s2, Mg 3s2 - ns2 N 2s22p3, P 3s23p3 - ns2np Ne 2s22p6, Ar 3s23p6 - ns2np6 Как видно у электрон одинаковое электронное строение валентных уровней. Вывод: Периодическое повторение строения внешнего энергетического уровня обуславливает периодическое повторение химических св-в элементов. Номер периода, в котором стоит элемент, показывает число энергетических уровней в его атоме; для главных подгрупп номер группы показывает число электрон на внешнем энергетическим уровне. Периодические свойства элементов 1 Энергия(потенциал) ионизации I- энергия, которую необходимо затратить для отрыва электрона от атома. При этом образуется положительно заряженный ион. В периодах с ростом порядкового ионизации увеличивается: при увеличении заряда ядра притяжение электронов к ядру возрастает, в группах с увеличение порядкового номера потенциал убывает из-за большой удалённости внешних электронов от ядра. 2 Энергия средства к электрону E- энергия, которая выделяется при присоединении электронов к атому при этом образуется отрицательно заряженный ион. Максимальное значение сродства у галогенов O2 и S, наименьшее у элементов с ns2 (гелий, бериллий, магний и т. д.), а т. ж. у элементов с наполовину или полностью заполненной p-подуровнем(благородные газы, N, F и т. д.) 3 Электроотрицательность (ЭО) - способность атомов притягивать к себе электроны. Количество ЭО характеризуется полусуммой энергии ионизации и энергии сродства к электрону Более часто используют понятие- относительная ЭО: ЭО элемента сравнивают с ЭО Li, чьё значение принимают за 1. По этой шкале макс ЭО обладает F(4), O2 (3,5), N(3); наименьшее ЭО щелочные и щелочноземельные металлы(среднее значение 0,8-1). В периодах с ростом порядкового номера ЭО возрастает, в группах незначительно убывает. 4 Радиус атома-это половина межъядерного расстояния между соседними атомами для в-в в кристаллическом состоянии В периодах с ростом порядкового номера радиус атома убывает; в группах- возрастает. 7. Химическая связь и ее характеристики. Ковалентная связь – полярная и неполярная, механизмы ее образования – обменный и донорно-акцепторный. Гибридизация атомных орбиталей. Под химической связью понимают различные взаимодействия, обуславливающие устойчивое существование двух- и многоатомных молекул, ионов, радикалов. Основным признаком химической связи можно считать снижение энергии образовавшейся структуры в сравнении с суммой энергии изолированных частиц, образовавших донорную систему. В основе образований химических связей лежит взаимодействие положительно заряженных атомов с чужими электронами, а так же электроны друг друга. Выделяют следующие виды химических связей: ковалентная, ионная, водородная, металлическая. Характеристики связей: Энергия связей – энергия, которую необходимо затратить для разрыва связей(кДж/моль); Длина связи – расстояние между ядрами взаимодействующих атомов в молекуле; чем меньше длина связи, тем она прочнее, тем больше ее энергия. Длина связи уменьшается с увеличением ее кратности; Для ковалентной связи так же важными характеристиками являются: насыщаемость – максимальное число связей, которое может образовывать данный атом; направленность – взаимное расположение атомов в молекуле относительно друг друга, характеризующиеся валентным углом. При образовании как ковалентной, так и ионной связи, конфигурация внешнего энергетического уровня взаимодействующих атомов стремится к конфигурации инертных газов – ns2np6, т.е. на внешнем уровне 8 электронов. Ковалентную связь обозначают в виде пары точек, либо каждой паре электронов ставят в соответствии черточку. Ковалентная связь. Это химическая связь, образованная обобщенными электронными парами. При образовании выделяют 2 механизма: обменный и донорно-акцепторный. По обменному механизму каждый из взаимодействующих атомов предоставляет свои неспаренные электроны для образования обобщенных пар. При образовании молекулы BeCl2 у атома Be принимал участие 1s и 1р электрон, однако обе связи Be-Cl абсолютно равноценны (одинаковая длина, энергия), что объясняется гибридизацией валентных орбиталей Be в момент образования BeCl2. Взаимное отталкивание двух sp орбиталей определяет линейную конфигурацию молекулы BeCl2 с валентным углом 180˚. Гибридизация – процесс смещения и выравнивания по форме и энергии атомных орбиталей. Тип гибридизации определяет пространственное строение молекулы: sp - линейное, sp2 - плоскостное, sp3 - тетраидрическое. Донорно-акцепторный механизм образования ковалентной связи. Механизм образования ковалентной связи, когда один атом предоставляет не поделенную электронную пару (донор) свободную орбиталь другого атома(акцептор), называется донорно-акцепторным. Донорно-акцепторный механизм образования ковалентной связи играет важнейшую роль при образовании комплексных соединения, в том числе и биокоплексы. Валентность – число связей , который атом в молекуле связан с другими атомами. Максимальная валентность равна числу неспаренных электронов(с учетом возбужденного состояния) + число связей , образованных по донорно-акцепторному механизму. Максимальная валентность не может превышать число орбиталей на внешнем энергетическом уровне. Полярность ковалентной связи. Если молекула образована атомами одного химического элемента, то обобщенные электронные пары находятся строго посередине между ядрами взаимодействующих атомов – ковалентная неполярная связь(H2, N2, Cl2). Если молекула образована атомами разных химических элементов, то электронные пары смещены к атому с большей электроотрицательностью, на котором появляется частичный отрицательный заряд – ковалентная полярная связь. Процесс смещения электронной пары к атому с большей электроотрицательностью, называется поляризуемостью молекулы. А полярные молекулы называются диполем и изображаются в виде эллипса с разноименно заряженными полюсами. Различают ơ и π связи. Ơ-связь – валентные орбитали перекрываются вдоль линии, соединяющей центры, образуется s и p электроны. Π-связь – валентные электроны над и под линией, соединяющей центры атомов. Образуются p и d электроны. Характерна для соединений с кратной связью(СН2=СН2). Ионная связь. Характерна для соединений типичных металлов с типичными неметаллами. Может рассматриваться как частный случай ковалентной неполярной связи, при которой обобщенные электронные пары практически полностью смещены к атому неметалла. При таком разделении электрических рядом атомы металлов превращаются в положительный ион. При этом электронная конфигурация ионов стремится к конфигурации инертных газов. Связь, образованная за счет электростатического притяжения разноименно заряженных ионов называется ионной (NaCl). Водородная связь. Это связь между положительно поляризованным атомом Н и атомом с высокой ЭО(F, O, N). Образование водородной связи обусловлено следующими 2 факторами: Между атомом Н. несущим положительный заряд, и электроотрицательным атомом, несущим отрицательный заряд, возникает электростатическое напряжение. За счет освободившегося атома Н и готовых неподеленных электронных пар атома с большой ЭО возникает образование прообраза ковалентной связи по донорно-акцепторному механизму. Различают межмолекулярную(между разными молекулами) и внутримолекулярную(в пределах одной молекулы) водородную связь. Наличие у веществ водородных связей приводит к аномальному изменению физических свойств: возрастает вязкость, температура кипения и плавления, парообразование). Энергия водородной связи в 1-20 раз меньше энергии ковалентной связи. 8. Ионная, металлическая, водородная связи. Влияние водородной связи на физико-химические свойства веществ. Ионная связь - электростатическое притяжение между ионами, образованными путём практически полного смещения электронной пары к одному из атомов. Этот тип связи образуется, если разность электроотрицательностей атомов велика. Связи такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Ионы могут быть простыми, т.е. состоящими из одного атома (например, катионы Na+, K+, анионы F-, Cl-), или сложными, т.е. состоящими из двух или более атомов, (например, катион NH4+, анионы OH-, NO3-,SO4 2-). Ионная связь - предельный случай полярной ковалентной связи. Но в отличие от ковалентной связи, ионная связь характеризуется ненаправленностью и ненасыщаемостью. Металлическая связь - связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. . В соот ветствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов . Эти электроны достаточно слабо связаны со своими ядрами и могут легко отры ваться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные элек троны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». В случае металлов невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу равномерно. Этим и объясняется, например, пластичность металлов, т.е. возможность смещения ионов и атомов в любом направлении без нарушения связи. Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи. Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками - водородная связь). Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Межмолекулярная и внутримолекулярная водородная связь Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед). Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений. Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Влияние водородной связи на физико-химические свойства веществ. Было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота, обладают рядом аномальных свойств. Это проявляется, например, в значениях температур плавления и кипения подобных соединений. Обычно в ряду однотипных соединений элементов анной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают. Это объяснятся усилением взаимного притяжения молекул, что связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними. Водородная связь служит причиной некоторых особенностей воды - вещества, играющего огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. 9.Классификация неорганических соединений Можно разделить на четыре важнейших класса: оксиды, кислоты, основания и соли. Зная особен ности классов соединений, можно описать свойства отдель ных их представителей. Оксиды — сложные вещества, молекулы которых со стоят из атомов кислорода и какого-нибудь другого элемен та. Например: K2O, FeO, Сг2О3, SiO2, P2O5. Оксиды делятся на солеобразующие и несолеобразующие. Последних довольно мало (СО, NO, N2O и NO2), в химических реакциях они не образуют солей. Соле образующие оксиды делятся на основные, кислотные и амфотерные. К основным оксидам относятся оксиды щелочных и щелочно-земельных металлов, а также многие оксиды других металлов со степенью окисления +1, +2. Они взаимодейству ют с водой с образованием оснований: ВаО + Н2О = Ва (ОН)2 Непосредственно с водой при обычной температуре реаги руют только оксиды металлов I и II групп главных подгрупп (кроме ВеО и MgO) периодической системы Д. И. Менделеева. Основные оксиды взаимодействуют с кислотными оксида ми и кислотами, образуя соли: СаО + СO2 = СаСО3 СuО + 2НС1 = CuCl2 + H2O Кислотные оксиды образуют неметаллы (CI2O, В2О3, CO2, N2O5, SO3, Cl2O7 и др.), а также металлы со степенью окисле ния более +4 (V2O5, СгО3, Mn2O7, WO3). Многие кислотные оксиды непосредственно взаимодейст вуют с водой, образуя кислоты: SO2 + H2O = Н2SО3 СгО3 + H2O = H2CrO4 Со щелочами кислотные оксиды образуют соль и воду: N2O5 + 2NaOH = 2NaNО3 + H2O Амфотерные оксиды образуют металлы, имеющие степе ни окисления +3, +4, иногда +2. К амфотерным оксидам отно сятся, например, BeO, ZnO, Аl2О3, Сг2О3, SnO, PbO, MnO2 и др. Они характеризуются реакциями солеобразования и с кислотами, и с основаниями, так как в зависимости от усло вий проявляют как основные, так и кислотные свойства. Например, как основный оксид, Аl2О3 реагирует с кисло той: Аl2О3 + 6НС1 = 2 АlС1з + 3H2O как кислотный — со щелочью: Аl2О3 + 2NaOH = 2NaCrO2 + H2O Оксиды можно получить следующими способами: - при взаимодействии простых веществ с кислородом, например 2Mg + O2 = 2MgO 4P + 5O2 = 2P2O5 ; - разложением сложных веществ, например t Сu(ОН)2 = СuО + H2О, t СаСО3 = СаО + СО2, t 2Zn(NO3)2 = 2ZnO + 4NO2 + O2. Кислотами называют вещества, в состав молекул которых входят атомы водорода и кислотные остатки, например, HCl, H2SO4, H3PO2 (подчеркнуты кислотные остатки). Кислоты можно разделить на бескислородные (например, НС1, НВг, HCN, H2S) и кислородсодержащие (например, НNО3, H2SO4, Н3Р04). В растворах кислот индикаторы меняют свою окраску: лакмус становится красным, метиловый оранжевый — розо вым. Кислоты взаимодействуют с металлами, стоящими левее водорода в ряду активностей (стандартных электродных потенциалов), обра зуя соль и водород: 2А1 + ЗН2SO4 = А12(SO4)3 + ЗН2↑ Водород не выделяется при взаимодействии металлов с азотной и концентрированной серной кислотами. Кислоты реагируют с основаниями и основными оксидами с образованием солей: H2SO4 + Mg(OH)2 = MgSO4 + 2Н2O 2HNO3 + СаО =Са(NО3)3 + H2O При взаимодействии кислот с солями могут образовывать cя новые соль и кислота: 2НС1 + СаСОз = CaCl2 + Н2СОз H2SО4 + BaCl2 = BaSО4↓ + 2НCl Кислоты получают: - гидратацией (взаимодействием с водой) кислотных оксидов Р2О5 + ЗН2О = 2Н3РO4 - обменной реакцией соли с кислотой Са3(РO4)2 + 3H2SO4 = 3CaSO4 + 2Н3РO4 Основаниями называют сложные вещества, в состав которых входят атомы металлов и ОН – группы (например, NaOH, Fe(OH)3). Кислотность основания – это количество ОН - групп, приходящихся на 1 атом металла. По растворимости в воде различают: а) основания, растворимые в воде, — щелочи. К ним отно сятся LiOH, NaOH, КОН, RbOH, CsOH, FrOH, Ca(OH)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также Т1OН; б) основания, нерастворимые в воде, например СuОН)2, Fе(ОН)3, Сг(ОН)3 и др. Водные растворы щелочей изменяют окраску индика торов. В их присутствии фиолетовый лакмус синеет, бесцвет ный фенолфталеин становится малиновым, метиловый оран жевый — желтым. Основания реагируют с кислотами и кислотными оксидами с образованием солей: 2NaOH + H2SO4 = Na2SO4 + 2H2O Ba(OH)2 + СО2 = ВаСО3 + Н2О При действии щелочей на растворы солей может получиться но вая соль и новое основание, если одно из полученных ве ществ нерастворимо (выпадает в осадок): КОН + CuSO4 = Cu(OH)2↓+ 2K2SO4 Са(ОН)2 + Na2CO3 = СаСО3↓ + 2NaOH Нерастворимые в воде основания разлагаются при нагревании: t 2Fе(ОН)3 = Fе2Оз + 3H2O Получить щелочи можно растворением в воде соответст вующих оксидов: СаО + H2O = Са(ОН)2 или при взаимодействии воды с очень активными металлами (К, Na, Са. Ва и др.): 2Na + 2Н2О = 2NaOH + H2 Общий способ получения нерастворимых в воде основа ний — действие щелочей на растворимые соли металлов: 2NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4 Некоторые основания проявляют как химические свойства оснований, так и свойства кислот. Такие основания называют амфотерными. К ним относятся Сг(ОН)3, Zn(OH)2, Be(OH)2, А1(ОН)3 и др. Амфотерные основания (гидроксиды) способны реагировать как с кис лотами, так и со щелочами. С кислотами они реагируют как основания, а со щелочами — как кислоты. Соли — это вещества, в состав которых входят атомы металлов и кислотные остатки Соли делятся на средние, кислые, основные. Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла или как продукты полного замещения гидроксогрупп основания кислотными остатками. Например, Na2CO3, K2SO4, Са3(РO4)2. Кислые соли — продукты неполного замеще ния атомов водорода многоосновных кислот атомами металла. Их образуют только многоосновные кислоты. Например, NаНСОз, Са (Н2РO4)2, КНSО3. Основные соли по составу являются про дуктами неполного замещения гидроксогрупп основания на кислотные остатки. Основные соли образуются толь ко многокислотными основаниями. Например, (СuОН)2СО3, АlOН(NО3)2, FeOHCl. Соли могут взаимодействовать с кислотами и со щелочами. Две растворимые в воде соли могут реагировать друг с другом, если при обмене своими частями соли образуют нерастворимое вещество: Ва(NО3)2 + K2SO4 = 2KNO3 + BaSO4↓ Средние соли могут быть получены многими спосо бами: 1) Металл + Неметалл 2Na + Cl2 = 2NaCl 2) Металл + Кислота Mg + 2НС1 = MgCl2 + Н2↑ 3) Металл + Соль Сu + 2AgNO3 = 2Ag + Сu(NО3)2 4) Основный оксид + Кислотный оксид СаО + CO2 -= СаСО3 5) Основание + Кислота Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H20 6) Соль + Соль РЬ(NО3)2 + Na2SO4 = PbS04↓ + 2NaN03 7) Основный оксид + Кислота CuO + H2S04 = CuS04 + H2O 8) Кислотный оксид + Основание P2O5+ 6NaOH = 2Nа3РO4 + ЗН2О 9) Щелочь + Соль Ва(ОН)2 + К2СО3 = ВаСО3↓ + 2КОН 10) Кислота + Соль H2SO4 + BaCl2 = BaSO4↓ + 2НС1 Кислые соли могут быть получены в кислой среде: 1) Основание + Кислота (избыток) NaOH + Н3РO4 = NaH2P04 + H2O 2) Средняя соль + Кислота (избыток) Na3P04 + 2Н3Р04 = 3NaH2P04 Основные соли могут быть получены в щелочной среде: 1) Кислота + Основание (избыток) Н2SO4 + 2Cu(OH)2 = (CuOH)2S04 + 2H2O 2) Средняя соль + Щелочь (недостаток) 2CuSO4 + 2NaOH = (CuOH)2SO4 + Na2SO4 Превращение кислых и основных солей в средние проис ходит следующими способами: 1) Кислая соль + Щелочь NaHSO3 + NaOH = Na2SO3 + Н2О Са(Н2Р04)2 + 2Са(ОН)2 = Са3(РO4)2 + 4H2O 2) Основная соль + Кислота (CuOH)2S04 + H2SO4 = 2CuSO4 + 2H2O 10. Соли, их классификация, номенклатура, получение, химические свойства. Соляминазываются сложные вещества формула молекулы которых, состоит из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д. Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла: Na+Cl– – хлорид натрия Ca2+SO42– – сульфат кальция и т.д. Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие типы солей: 1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 и т. д. 3. Основные соли можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д. По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей. Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl) Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O). Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl). Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например,Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], Cu(NH3)4](OH)2 По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д. В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния. При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия. Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде. Способы получения солей Взаимодействие металла с кислотой. Zn + 2HCl = ZnCl2 + H2 Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O Взаимодействие основного оксида с кислотой CaO + 2HCl = CaCl2 + 2H2O FeO + H2SO4 = FeSO4 + H2O Взаимодействие основания с кислотой (реакция нейтрализации). Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2NaOH + H2SO4 = Na2SO4 + H2O При неполной нейтрализации кислоты основанием образуется кислая соль: H2SO4 + NaOH = NaHSO4 + H2O Взаимодействие соли с кислотой. В этом случаи образуется новая кислота и новая соль. Для осуществления этой реакции необходимо, что бы взятая кислота была сильнее образующейся или менее летучей. 2NaCl + H2So4 = Na2SO4 + 2HCl↑ Действием избытка кислоты на средние соли многоосновных кислот получают кислые соли: Na2SO4 + H2SO4 = 2NaHSO4 CaCO3 + CO2 + H2O = Ca(HCO3)2 Взаимодействие основного оксида с кислотным оксидом. CaО + SiО2 = CaSiO3 Взаимодействие основания с кислотным оксидом 6NaOH + P2O5 = 2Na3PO4 + 3H2O Взаимодействие соли с кислотным оксидом. Вступающий в реакцию кислотный оксид должен быть менее летуч, чем образующийся после реакции. CaCO3 + SiO2 =t CaSiO3 + CO2 ↑ Взаимодействие соли с основанием. Этим способом можно получить как средние соли, так и, при недостатке основания, основные соли. Кислые соли, взаимодействуют с основанием, переходят в средние: Fe(NO3)3 + 3NaOH = 3NaNo3 + Fe(OH)3 ↓ ZnCl2 + KOH = ZnOHCl + KCl Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O Взаимодействие между двумя солями. Образуются две новые соли. Реакция протекает до конца лишь в том случае, если одна из образующихся солей выпадает в осадок: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl AgNO3 + KJ = AgI↓ + KNO3 Взаимодействие между металлом и солью. Вступивший в реакцию металл должен находится в ряду напряжения металлов левее металла, входящего в состав исходной соли. Fe + CuSO4 = FeSO4 + Cu Взаимодействие металла с неметаллом 2Fe + 3Cl2 = 2FeCl3 Взаимодействие металла со щелочью. Zn + 2NaOHкр 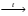 Na2ZnO2 + H2 ↑ Na2ZnO2 + H2 ↑Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑ Взаимодействие металла со щелочью Cl2 + 2KOH = KCl + KClO + H2O Взаимодействие неметалла с солью. Cl2 + KJ = 2KCl + J2 Термическое разложение солей. 2KNO3 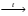 2KNO2 + O2↑ 2KNO2 + O2↑2KClO3 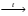 2KCl + 3O2↑ 2KCl + 3O2↑Химические свойства солей Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав. 1. Некоторые соли разлагаются при прокаливании: CaCO3 = CaO + CO2↑ 2. Взаимодействуют с кислотамис образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота: 2NaCl + H2 SO4 → Na2SO4 + 2HCl↑. 3. Взаимодействуют с основаниями, образуя новую соль и новое основание: Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2. 4. Взаимодействуют друг с другомс образованием новых солей: NaCl + AgNO3 → AgCl + NaNO3 . 5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли: Fe + CuSO4 → FeSO4 + Cu↓. |
