1. Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
 Скачать 29.04 Mb. Скачать 29.04 Mb.
|
|
Часть ионов Ca2+ в костной ткани замещена ионами Mg2+. Незначительная часть ионов OH– замещена ионами фтора. Это приводит к уплотнению кристаллической решетки, а следовательно, к увеличению твердости и повышению устойчивости соединения к действию кислот ( фторид-ион - менее сильное основание Бренстеда по сравнению с гидроксид-ионом).Явление замещения ионов в узлах кристаллической решетки другими ионами, имеющими сходные кристаллохимические характеристики, называется изоморфизмом. Таким образом, помимо гидроксиапатита в состав костной ткани входят и другие неорганические минералы: CaНPO4 Ca5(PO4)3F- фторапатит (в составе зубной эмали) Ca10(PO4)6СO3 – карбонапатит Ca8H2 (PO4)6∙ 5H2O- октакальция фосфат Mg10(PO4)6(OH)2 Ca3(PO4)2 – аморфный фосфат кальция . Механизм функционирования кальций-фосфатного буфера. В стоматологической практике как компонент биокерамики и в качестве имплантата костной ткани используют поликристаллический синтетический гидроксиаппатит, благодаря его уникальной биосовместимости чрезвычайно низкой растворимости . Обмен ионами кальция в организме составляет до 800мг/сут . Концентрация ионов кальция в плазме крови постоянна и составляет 0,0025М, а фосфатов – 0,001М. Только половина кальция находится в ионизированном состоянии, другая половина связана с белками плазмы. Поддержание концентрации ионов кальция на постоянном уровне обеспечивает костная ткань и плазма крови; эту систему можно рассматривать как кальциевый буфер. Плазма крови представляет собой почти насыщенный раствор гидрофосфата кальция (CaHPO4), находящийся в динамическом равновесии с неорганическими составными частями костной ткани, поэтому костная ткань не растворяется. Полная перестройка костной ткани происходит каждые 10 лет. При увеличении концентрации ионов Са2+ в плазме крови согласно принципу Ле- Шателье наблюдается сдвиг равновесия, приводящий к отложению кальция в костной ткани. Наоборот, снижение концентрации ионов Са2+ в плазме крови приводит к смещению равновесия в сторону растворения минеральных компонентов костной ткани, ее обызвествлению. Например, при рахите из-за недостаточности всасывания ионов Са2+ из желудочно-кишечного тракта, при беременности концентрация ионов Са2+ в плазме крови поддерживается постоянной за счет мобилизации (высвобождения) ионов Са2+ из неорганических компонентов костей. Растворение костной ткани происходит в специальных клетках- остеокластах, чему способствуют: уменьшение рН, увеличение концентрации лактатов, цитратов, белков, комплексно связывающих ионы кальция, отсутствие в пище витамина Д, . являющегося проводником кальция в составе растворимого комплекса через стенки кишечника в плазму. 40.Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов. Применение хлорида кальция и сульфата магния в качестве антидотов.    Изоморфизм-явление возникшее в результате замещения частиц одного компонента в узлах кристаллической решетки частицами другого компонента . Оксалаты :CaC2O4+2HCL=CaCL2+H2C2O4 реагирует с сильными кислотами . Кальциноз сосудов -отложение карбоната кальция на стенках сосудов . Ca+CO3=CaCO3 В организме человека помимо фосфатов , ионы Са могут образовываться и другие малорастворимые соединения -патологические кокременты . Локально повышение концентраций некоторых ионов может наблюдаться при различных нарушениях обмена веществ . Мочекаменная болезнь .
Увеличение концентрации ионов лития приводит к уменьшению концентрации ионов натрия, что необходимо для поддержания значений ионной силы плазмы и осмотического давления. Уменьшение концентрации ионов на трия приводит к частичному растворению уратов натрия (соответственно прин ципу Ле Шателье).   Для формирования костной ткани необходимы строгая ориентация коллагеновых волокон, гормональная регуляция, ряд других факторов. Клетки костной ткани вследствие локальных изменений рН, концентрации ионов кальция и фосфатов, активности ферментов могут легко ускорять процессы минерализации или деминерализации, проходящей уже в остеокластах. Растворение костной ткани происходит из-за повышения кислотности среды. Вначале отдаются катионы кальция, а затем происходит полный распад. Костную ткань можно рассматривать как кальциевый буфер. Регуляторами данного обмена кальцием и фосфатами в организме являются: витамин D(процесс всасывания ионов кальция и фосфатов из кишечника), гормоны паратирин, кальцитонин(подавляет активность остеокластов и ингибирует освобождение ионов Ca2+ из костной ткани), йодсодержащие гормоны щитовидной железы - тироксин (Т4) и трийодтиронин (Т3) обеспечивают оптимальный рост костной ткани, лактоферрин выполняет роль фактора роста кости и её здоровья. Благодаря им поддерживается постоянная концентрация этих ионов в сыворотке крови, межклеточной жидкости и тканях. 41. Комплексные соединения. Их строение на основе координационной теории А. Вернера. Комплексный ион, его заряд. Катионные, анионные, нейтральные комплексы. Номенклатура, примеры. 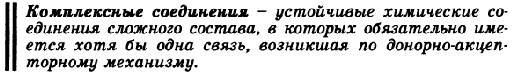    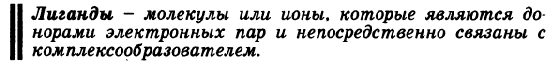  Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцепторному механизму По координационной теории Вернера в комплексном соединении различают внутреннюю и внешнюю сферы. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратными скобками. Между центральным атомом и лигандами действуют силы притяжения (образуется ковалентная связь по обменному и (или) донорно-акцепторному механизму), между лигандами - силы отталкивания. Комплексообразователь – атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число Значение координационного числа комплексообразователя равно удвоенному заряду иона комплексообразователя Катионные: [Cu(NH3)4]2+ Анионные: [Fe(CN)6]3- Нейтральные: [Fe(CO)5]0 42.Реакции замещения лигандов. Константа нестойкости комплексного иона, константа устойчивости. Лиганды - ионы или молекулы, которые непосредственно связаны с комплексообразователем и являются донорами электронных пар. Эти электроноизбыточные системы, имеющие свободные и подвижные электронные пары, могут быть донорами электронов, например: Соединения р-элементов проявляют комплексообразующие свойства и выступают в комплексном соединении в качестве лигандов. Лигандами могут быть атомы и молекулы (белка, аминокислот, нуклеиновых кислот, углеводов). Эффективность и прочность донорно-акцкпторного взаимодействия лиганда и комплексообразователя определяется их поляризуемостью-способностью частицы трансформировать свои электронные оболочки под внешним воздействием. Константа нестойкости:  Кнест=[Ag+][NH3]2/[Ag(NH3)2+] К уст=1/Кнест Реакции замещения лигандов Одна из важнейших стадий в металлокомплексном катализе – взаимодействие субстрата Yс комплексом – происходит по трем механизмам: а) Замещение лиганда растворителем. Обычно такую стадию изображают как диссоциацию комплекса Суть процесса в большинстве случаев – замещение лиганда LрастворителемS, который далее легко замещается молекулой субстратаY б) Присоединение нового лиганда по свободной координате с образованием ассоциата с последующей диссоциацией замещаемого лиганда в) Синхронное замещение (типа SN2) без образования интермедиата 44. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином. Особенности строения металлоферментов. Биокомплексные соединения значительно различаются по устойчивости. Роль металла в таких комплексах высокоспецифична: замена его даже на близкий по свойствам элемент приводит к значительной или полной утрате физиологической активности.
Гемоглобин - дыхательный пигмент, придающий крови красный цвет. Гемоглобин состоит из белка и железопорфирина и переносит кислород от органов дыхания к тканям тела и углекислый газ от них к дыхательным органам. Цитохромы - сложные белки (гемопротеиды), осуществляющие в живых клетках ступенчатый перенос электронов и/или водорода от окисляемых органических веществ к молекулярному кислороду. При этом образуется богатое энергией соединение АТФ. Кобаламины - природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта. Физико-химические принципы транспорта кислорода гемоглобином - Атом (Fe (II)) (один из компонентов гемоглобина) способен образовывать 6 координационных связей. Из них четыре используются для закрепления самого атома Fe(II) в геме, пятая связь - для связывания гема с белковой субъединицей, а с помощью шестой связи происходит связывание молекулы О2 или СО2. 45. Металло-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (ЖМКО). Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины. В организме непрерывно происходит образование и разрушение биокомплексов из катионов металлов и биолигандов (порфинов, аминокислот, белков, полинуклеотидов), в состав которых входят донорные атомы кислорода, азота, серы. Обмен с окружающей средой поддерживает концентрации этих веществ на постоянном уровне, обеспечивая металло-лигандный гомеостаз. Нарушение сложившегося равновесия ведет к ряду патологических явлений – металлоизбыточным и металлодефицитным состояниям. В качестве примера можно привести неполный перечень заболеваний, связанных с изменением металло-лигандного баланса только для одного иона – катиона меди. Дефицит этого элемента в организме вызывает синдром Менкеса, синдром Морфана, болезнь Вильсона-Коновалова, цирроз печени, эмфизему лёгких, аорто- и артериопатии, анемии. Избыточное поступление катиона может вести к серии заболеваний самых разных органов: ревматизму, бронхиальной астме, воспалению почек и печени, инфаркту миокарда и т.д., называемых гиперкупремиями. Известен и профессиональный гиперкупреоз – медная лихорадка. Циркуляция тяжелых металлов происходит частично в виде ионов или комплексов с аминокислотами, жирными кислотами. Однако ведущая роль в транспорте тяжелых металлов принадлежит белкам, образующим с ними прочную связь. Они фиксируются на клеточных оболочках, блокируют тиоловые группы мембранных протеинов – 50% из них белки-ферменты, нарушают стабильность белково-липидных комплексов клеточной оболочки и ее проницаемость, вызывая выход из клетки калия и проникновение в нее натрия и воды. Подобное действие этих ядов, активно фиксирующихся на красных кровяных клетках, приводит к нарушению целостности мембран эритроцитов, торможению в них процессов аэробного гликолиза и метаболизма вообще и накоплению гемолитически активной перекиси водорода вследствие торможения пероксидазы в частности, что приводит к развитию одного из характерных симптомов отравления соединениями этой группы – к гемолизу. Распределение и депонирование тяжелых металлов и мышьяка происходят практически во всех органах. Особый интерес представляет способность этих веществ накапливаться в почках, что объясняется богатым содержанием в почечной ткани тиоловых групп, наличием в ней белка – металлобионина, содержащего большое количество тиоловых групп, что способствует длительному депонированию ядов. Высокой степенью накопления токсических соединений этой группы отличается и ткань печени, также богатая тиоловыми группами и содержащая металлобионин. Срок депонирования, например, ртути может достигать 2 мес и более. Выделение тяжелых металлов и мышьяка происходит в разных пропорциях через почки, печень (с желчью), слизистую оболочку желудка и кишечника (с калом), потовые и слюнные железы, легкие, что сопровождается, как правило, поражением выделительных аппаратов этих органов и проявляется соответствующей клинической симптоматикой. Смертельная доза для растворимых соединений ртути 0,5 г, для каломели 1–2 г, для медного купороса 10 г, для ацетата свинца 50 г, для свинцовых белил 20 г, для мышьяка 0,1–0,2 г. Токсической считается концентрация ртути в крови более 10 мкг/л (1γ%), в моче более 100 мкг/л (10γ%), концентрация меди в крови более 1600 мкг/л (160γ%), мышьяка более 250 мкг/л (25γ%) в моче. Хелатотерапия – это выведение токсичных частиц из организма, основанное на хелатировании их комплексонатами s–элементов. Препараты, применяемые для выведения инкорпорированных в организме токсичных частиц, называют детоксикантами. Унитиол: Британский антилюизитон (БАЛ) H2C-SH H2C-SH HC-SH HC-SH H2C-SO6Na H2C-SH Пентацин Тетациин CaNa3ДТПА Na2CaЭДТА  46.Окислительно-восстановительные (редокс) реакции. Окислители и восстановители. Сопряженные окислительно- восстановительные пары. (редокс- системы). Механизм возникновения электродного потенциала. Уравнение Нернста, его анализ. Стандартный электродный потенциал.   Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода:Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота(инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение(Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:Aox + n·e− → Ared, Окислительно-восстановительный потенциал.Основными процессами, обеспечивающими жизнедеятельность любого организма, являются окислительно-восстановительные реакции, т.е. реакции, связанные с передачей или присоединением электронов. Энергия, выделяемая в ходе этих реакций, расходуется на поддержание гомеостаза (жизнедеятельности организма) и регенерацию клеток организма, т.е. на обеспечение процессов жизнедеятельности организма соответственно в настоящем и будущем.  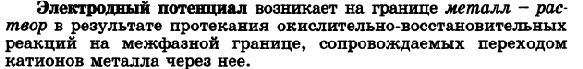  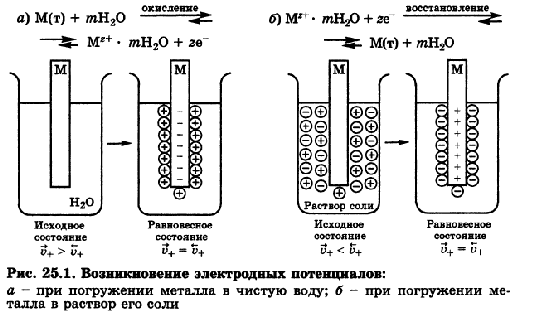 Электродные потенциалы и механизмы их возникновения. Для определения направления и полноты протекания окислительно-восстановительных реакций между окислительно-восстановительными системами в водных растворах используются значения электродных потенциалов этих систем. Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией. Сочетая электрод, представляющий исследуемую окислительно-восстановительную систему, со стандартным водородным электродом, определяют электродный потенциал Е данной системы. Для того, чтобы можно было сравнивать окислительно-восстановительные свойства различных систем по их электродным потенциалам, необходимо, чтобы последние также были измерены при стандартных условиях. Таковыми обычно являются концентрация ионов, равная 1 моль/л, давление газообразных веществ 101,325 кПа и температура 298,15 К. Потенциалы, измеренные в таких условиях, носят название стандартных электродных потенциалов и обозначаются Ео. Они часто называются также окислительно-восстановительными или редокс-потенциалами, представляя собой разность между редокс-потенциалом системы при стандартных условиях и потенциалом стандартного водородного электрода.. Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице. Стандартные электродные потенциалы окислительно-восстановительных систем приводятся в справочной литературе. Эти системы записаны в форме уравнений полуреакций восстановления, в левой части которых находятся атомы, ионы или молекулы, принимающие электроны (окисленная форма) Электрохимический ряд напряжений характеризует свойства металлов в водных растворах: чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов; металлы, имеющие отрицательные электродные потенциалы, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот; каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал. При условиях, отличающихся от стандартных, численное значение равновесного электродного потенциала для окислительно-восстановительной системы, записанной в форме , определяется по уравнению Нернста: 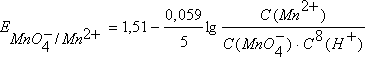 47.Механизм возникновения редокс-потенциала. Уравнения Нернста-Петерса, его анализ. Стандартный окислительно –восстановительный (редокс-) потенциал. Сравнительная сила окислителей и восстановителей. Прогнозирование направления редокс-процессов по величинам редокс-потенциалов. Константа окислительно – восстановительного процесса. Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода:Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота(инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение(Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:Aox + n·e− → Ared, Окислительно-восстановительный потенциал.Основными процессами, обеспечивающими жизнедеятельность любого организма, являются окислительно-восстановительные реакции, т.е. реакции, связанные с передачей или присоединением электронов. Энергия, выделяемая в ходе этих реакций, расходуется на поддержание гомеостаза (жизнедеятельности организма) и регенерацию клеток организма, т.е. на обеспечение процессов жизнедеятельности организма соответственно в настоящем и будущем. При не стандартных условях значение восстановительного потенциала с учетом влияния природы окислительно-восстановительной пары, температуры, и активности компонентов в растворе вычисляют:   Стандартный ОВП Если потенциал исследуемой окислительно-восстановительной пары измерен в стандартизированных условиях – температура 25ᵒС (298 K), давление 1 атм (101,3 кПа) и активности окисленной и восстановленной форм равны единице (аок = авос = 1 моль/л), то его называют «стандартный окислительно-восстановительный потенциал» и обозначают: Е0ок/вос. Чем больше окислительно-восстановительный потенциал Е0Ок/Вос, тем окисленная форма является более сильной, соответственно, восстановленная форма обладает более слабой функцией восстановления. И наоборот, чем меньше Е0Ок/Вос, тем сильнее восстановленная форма. Положительный знак потенциала указывает на самопроизвольное протекание реакции восстановления в паре со СВЭ, отрицательный – на самопроизвольное протекание реакции окисления. Потенциалы сильных окислителей будут всегда положительны, а сильных восстановителей – отрицательны. Окислителями называются вещества или частицы, принимаю щие электроны от других веществ или частиц — восстановителей. Окисленную и восстановленную форму одного и того же вещества называют редокс-системой (редокс-парой). Для протекания окисли тельно-восстановительной реакции (редокс-реакции) необходимо наличие как минимум двух веществ, относящихся к разным редокс-системам. В ходе окислительно-восстановительной реакции окислитель (Ох1) превращается в сопряженный восстановитель (Red1), а восстановитель (Red2) - в сопряженный окислитель (Ох2). |
