1. Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
 Скачать 29.04 Mb. Скачать 29.04 Mb.
|
|
Коллигативные свойства – не зависящие от природы частиц свойства, а зависящие только от концентрации частиц в растворе. Такими свойствами являются: диффузия, осмотическое давление, понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора. Теория Дебая – Хюккеля.
Основная ее идея - вследствие электростатического притяжения между положительными и отрицательными ионами вблизи каждого иона находятся главным образом ионы противоположного знака, т.е. ион как бы окружен ионной атмосферой. Суммарный заряд этой атмосферы по абсолютной величине равен заряду центрального иона, но противоположен ему по знаку. Тормозящее действие ионной атмосферы на передвижение ионов проявляется таким образом, что все свойства, зависящие от концентрации ионов (такие, как электрическая проводимость, осмотическое давление и т.д.), отвечают заниженной степени диссоциации – кажущейся степени диссоциации. Для оценки состояния ионов в растворе пользуются понятием активности иона – его условной концентрации, соответственно которой он действует при химических реакциях: a = f*C, где a – активность иона, C – его концентрация, f – коэффициент активности. Значение f < 1 указывает на связывающее взаимодействие ионов; если f близок к единице, это говорит о слабом межионном взаимодействии. В очень разбавленных растворах действие межионных сил почти не проявляется.  Ионная сила раствора (I) - величина, характеризующая интенсивность электростатического ноля всех ионов в растворе, которая равна полу-сумме произведений молярной концентрации (с) каждого иона на квадрат его заряда (z): Активность электролита – эффективная концентрация в соответствии с которой он участвует в различных процессах В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы. 24. Электролиты в организме.Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов .Понятия изо-, гипо-, гипертонический раствор. Понятие об изоосмии.Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Цитолиз. В биологических системах широко распространены межионные взаимодействия, которые сильно зависят от ионной силы растворов, что прежде всего сказывается на значениях констант диссоциации ионогенных групп биологических субстратов, так как они определяются активностями ионов, а не их концентрациями. Незначительное увеличение ионной силы раствора вызываем из менение степени ионизованности белков или нуклеиновых кислот, вследствие чего меняется их конформация. а следовательно, и биологические функции. Поэтому при использовании растворов электролитов в биологических экспериментах крайне необходимо, чтобы их ионная сила была равна ионной силе соответствующей биологической системы. Так, ионная сила плазмы крови человека равна 0,15 М, поэтому физиологический раствор -простейший заменитель плазмы крови - должен иметь соответствующую концентрацию NaCI (0,15 М, или 0,9 %). Электролиты являются составной частью жидкостей и тканей живых организмов. Для нормального протекания физиологических и биохимических процессов необходимы катионы натрия, калия, кальция, магния, водорода, анионы хлора, сульфат-ионы, гидрокарбонат-ионы, гидроксид-ионы и др. Концентрации этих ионов в организме человека различны. Так, например, концентрации ионов натрия и хлора весьма значительны и ежедневно пополняются. Концентрации ионов водорода и гидроксид-ионов очень малы, но играют большую роль в жизненных процессах, способствуя нормальному функционированию ферментов, обмену веществ, перевариванию пищи и т.д. Изоосмия, изотония – это относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентрации содержащихся в них веществ. В растворах, содержащих смесь электролитов, расчет числа кинетически самостоятельных частиц затруднен. В связи с этим в прикладных областях химии, в частности в медицине, в последнее время широко применяются понятия осмолярность и осмолялыюсть. Под осмолярностыо (осмоляльностью) понимают активную концентрацию частиц, не проникающих через идеальную полупроницаемую мембрану. Единицы измерения в системе СИ: осмолярности - моль/л, осмоляльностн - моль /кг. Для разбавленных растворов численные значения осмоляльностниосмолярности совпадают. Последнее время чаще применяется такая единица измерения, как осмоль. Учет этих величин особенно важен в тех случаях, когда применение лекарственных средств сопряжено с протеканием процессов, связанных с осмотическим давлением. Так.при введении лекарственных растворов в кровь, необходимо, чтобы осмолярная концентрация раствора для инъекции совпадала с осмолярной концентрацией плазмы крови (0.3 осмоль/л). Это значит, что растворы изотоничны. Часто под изоосмией понимают способность организма поддерживать постоянство осмолярности биологических жидкостей. Осмоляльность крови в значительной степени зависит от концентрации ионов Na и CL , в меньшей от глюкозы и мочевины. Гипертонические растворы - растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в гипертонический раствор он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (плазмолиз). Эритроциты крови человека и животных в гипертонических растворах также теряют воду и уменьшаются в объёме. Гипертонические растворы в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях. 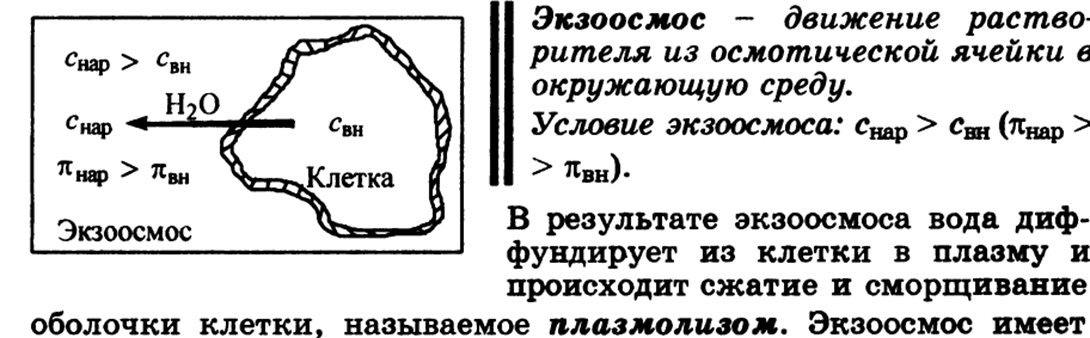 Гипотонические растворы - различные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей. В гипотонических растворах клетки насасывают воду, увеличиваясь в объёме, и теряют часть осмотически активных веществ (органических и минеральных). Эритроциты крови животных и человека в гипотонических растворах разбухают до такой степени, что их оболочки лопаются и они разрушаются. Это явление называют гемолизом. 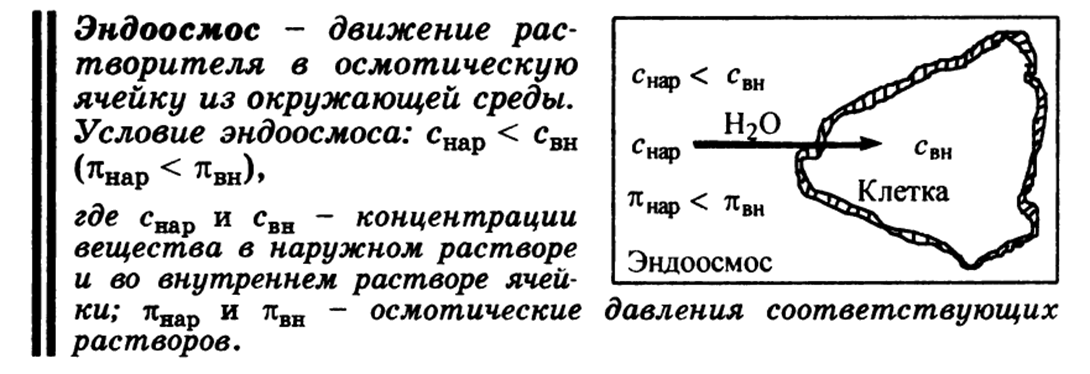 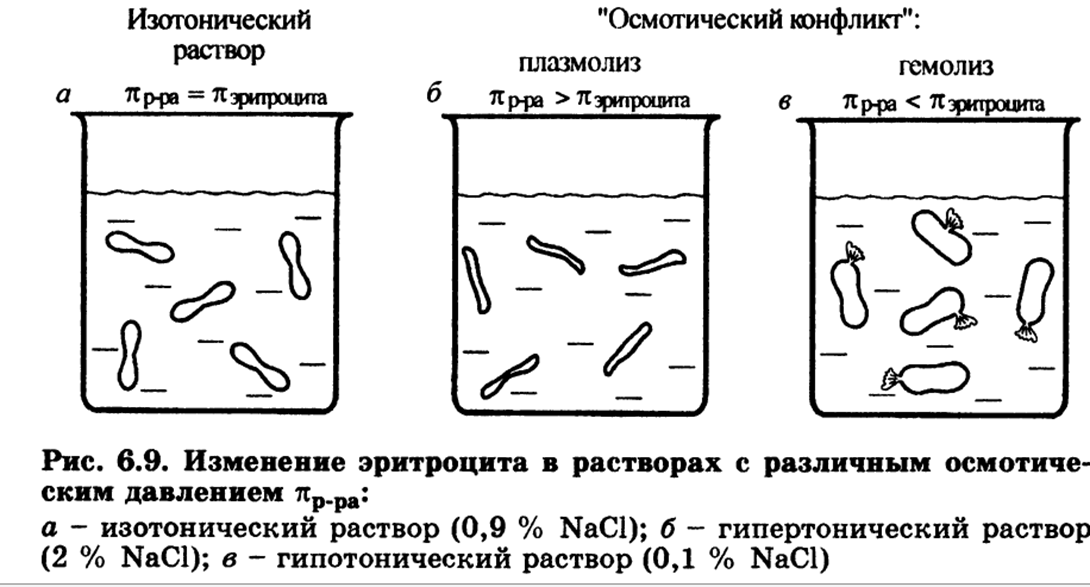   25 Основные положения теории кислот и оснований Бренстеда- Лоури: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара. Амфолиты. 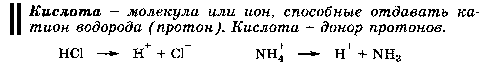  Сила кислоты определяется ее способностью отдавать протон, т.е сильная кислота - активный донор протона. Сила основания определяется его способностью принимать протон, т.е сильное основание - активный акцептор протона. 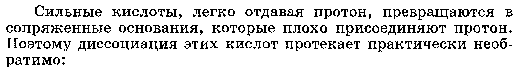 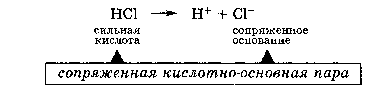 Для удобства оценки характера водной среды используют водородный показатель pH. Это количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода. pH=-lg[H+] Иногда используют гидроксильный показатель pOH. В нейтральной среде водородный показатель =7, в кислой он меньше 7 а в щелочной – больше. Для определения кислотности среды используют индикаторный или ионометрический метод.  Некоторые вещества в одних реакциях способны вступать в роли донора протона, а в других - в роли акцептора протона. Такие вещества называют амфолитами. 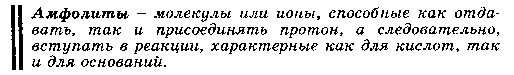 Типичным амфолитом является вода: 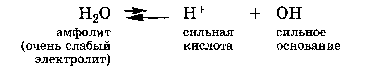 Вода взаимодействует и с кислотами, выступая в роли основания, и с основаниями, выступая в роли кислот: 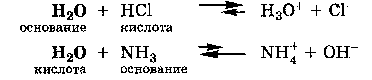 Амфолитами являются также гидроксиды некоторых металлов и гидроанионы некоторых многоосновных кислот: 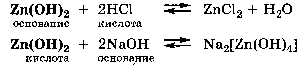 Амфолитами также являются соединения, молекулы которых две различные кислотно-основные группы: 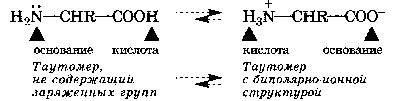 26. Ионное произведение воды. Водородный показатель среды растворов. Математическое выражение рН, его значение в кислой, щелочной, нейтральной средах. Биологическая роль водородного показателя.  В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.  ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. Вода является очень слабым электролитом. Ее диссоциация выглядит так: Константа последнего равновесия равна: 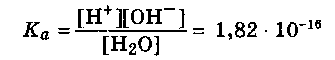 Отсюда:  Постоянство ионного произведения воды означает, что в любом водном растворе-нейтральном, кисломилищелочном-имеются и водородные ионы, и гидроксид-ионы.   27.Основные положения теории кислот и оснований Льюиса. Понятие о жестких и мягких кислотах и основаниях (теория ЖМКО).  Кислота Льюиса – любое хим.соединение , молекула ,ион , являющийся акцептором электронной пары и таким образом способное принимать пару электронов соединения донора (основания Льюиса ) на незаполненную орбиталь с образованием соединения аддукта . Основание Льюиса – основанием считается любая частица (атом , молекула или анион ) способная отдавать электронную пару для образования ковалентной связи . Т.е по Льюису кислота является акцептором пары электронов , а основание -донором . В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны приниматьэлектронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот. Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода,спирты, галогены. Примеры химических реакций между кислотами и основаниями Льюиса: Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Молекулярная орбиталь, на которую переходит электронная пара, у жёстких кислот имеет низкую энергию. Соответственно, жёсткие основания — это доноры с аналогичными свойствами (с большим отрицательным зарядом, большой электроотрицательностью и низкой поляризуемостью). Их орбиталь, с которой отдаётся электронная пара, также имеет низкую энергию. Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания — это основания Льюиса с теми же свойствами. Как у мягких кислот, так и у мягких оснований энергия орбиталей, участвующих в реакции высока. Поскольку такие свойства как заряд, электроотрицательность и поляризуемость изменяются плавно, существует ряд кислот и оснований Льюиса, которые занимают промежуточное положение между жёсткими и мягкими. Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера. 28. Ионизация слабых кислот и оснований. Константа кислотности и основности. Связь между константой кислотности и константой основности в сопряженной протолитической паре. Амфолиты. Изоэлектрическая точка.       29.Протолитические реакции. Типы протолитических реакции (нейтрализации, гидролиза, ионизации). Примеры. Конкуренция за протон: изолированное и совмещенное протолитические равновесия. Общая константа совмещенного протолитического равновесия. 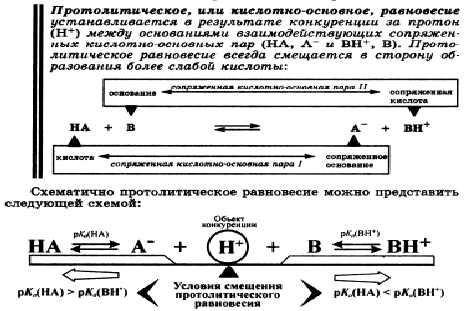     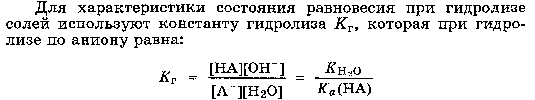  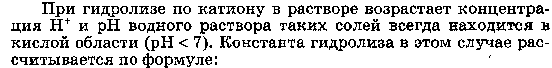 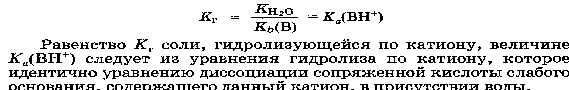   . Реакции нейтрализации:H2CO3+H2O=HCO3+H3O кислота +основание = с.о +с.к 1)между слабыми электролитами NH3+CH3COOH=NH4+ +CH3COO- 2) слабыми и сильнымиNH3+H3O+(кислота) = NH4+ + H2O(основание) 3)сильнымиH3O(кислота)+OH=H2O+H2O Реакции ионизации: CH3COOH + H2O(основание) ↔ H3O+(кислота) + CH3COO- 30.Буферное действие - основной механизм протолитического гомеостаза организма.Буферные системы, буферные растворы, их состав. Классификация буферных систем. Механизм действия буферных систем (на примере гидрокарбонатного буфера).   |
