1. Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
 Скачать 29.04 Mb. Скачать 29.04 Mb.
|
|
Автопротолиз воды – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого вещества за счет передачи протона от одной молекулы к другой. Понятие автопротолиза вытекает из протонной теории кислот и оснований Бренстеда-Лоури. 2 Н2О =Н3О++ОН- Также легко проходит и обратный процесс: Н3О++ОН-=2 Н2О или упрощенно Н2О = Н++ОН- Константа данного равновесия при 22 градусах равна: Ка = [H+] [OH-] / [H2O] = 1.82 *10 -16 19.Зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий, на растворимость. Термодинамика растворения. Понятие об идеальном растворе.        Идеальными называются растворы, образование которых не сопровожда ется ни тепловыми, ни объемными изменениями системы (DH = 0, DV = 0). Свой ства идеальных растворов не зависят от природы растворителя и растворенного вещества, а зависят только от количества частиц. При этом не имеют места какие-либо взаимодействия между частицами растворенного вещества и растворителя. Реальные растворы не являются идеальными и в своем поведении могут лишь приближаться к модели идеального раствора, например, разбавленные ра створы неэлектролитов. При растворении дифильных веществ происходит изменение структуры воды как результат взаимодействия с гидрофобными группами сводится к минимуму. Гидрофобные группы, ассоциируясь, выталкивают молекулы воды из области своего расположения. Термодинамика процесса растворения ΔG = (ΔH – TΔS) < 0. ΔH – энтальпийный фактор, TΔS – энтропийный фактор. При растворении жидких и твёрдых веществ энтропия системы обычно возрастает (ΔS>0), т. к. растворяемые вещества из более упорядоченного переходят в менее упорядоченное. Вклад энтропийного фактора, особенно заметен при повышенных Т, т. к. произведение TΔS – велико, в результате возрастает убыль ΔG. При растворении газов ΔS<0, т. к. вещество из менее упорядоченного переходит в более упорядоченное, а снижение T способствует растворению газов. 20. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константы ионизации слабого электролита. Закон разбавления Оствальда. Электролиты– это вещества с ионными или сильнополярными ковалентными связями в водных растворах, подвергающиеся электролитической диссоциации, в результат чего образуются катионы и анионы. Сильные электролиты– вещества, способные диссоциировать нацело. К ним относится большинство солей, а так же некоторые вещества молекулярного строения (HCl). 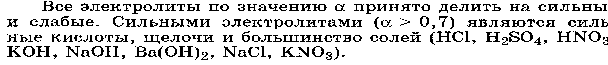 Слабые электролиты- диссоциируют в незначительно степени, и преобладающей формой их является молекулярная (H2S, органические кислоты).  Степенью электролитической диссоциации называется отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита. Количественно способность молекулярного электролита к диссоциации определяется степенью ионизации(она зависит от концентрации электролита): α= где Nобщ – общее число молекул в растворе;Nиониз – число молекул, распавшихся на ионы. Константа ионизации: Kd= Где [A],[B] – распавшиеся ионы [AB] – не распавшееся на ионы вещество. Закон разбавления Оствальда: K= α2c/1- α , Где α – степень ионизации С – молярная концентрация   21 .Коллигативные свойства разбавленных растворов неэлектролитов. Закон Рауля и следствия из него: понижение температуры замерзания раствора, повышение температуры кипения раствора. 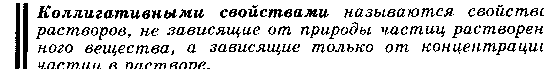 Коллигативными свойствами называются свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, но не от природы растворенного вещества. Нелетучими считают такие вещества, давление пара которых ничтожно мало по сравнению с давлением пара растворителя. К коллигативным свойствам относятся:
 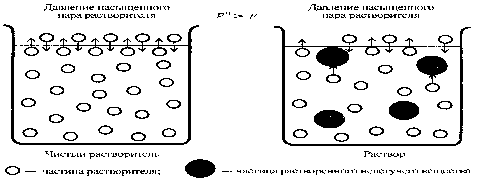  Первый закон Рауля Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя. Франсуа Мари Рауль: "Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе: p = p0 · χр-ль, где p — давление пара над раствором, Па; p0 — давление пара над чистым растворителем; χр-ль —— мольная доля растворителя. 1. Понижение давления пара над раствором Это свойство мы уже рассмотрели для случая, когда растворенное вещество является летучим (закон Рауля). При растворении нелетучего вещества давлением пара растворенного вещества можно пренебречь и учитывать лишь давление пара растворителя Р0. Давление пара растворителя над раствором нелетучего вещества может быть выражено уравнением: Р = Р0 · N1 , где N1 - мольная доля растворителя. «Давление насыщенного пара растворителя над разбавленным раствором Р равно произведению Р0 на мольную долю растворителя». Таким образом, давление насыщенного пара над раствором ниже, чем над чистым растворителем, и снижается с ростом концентрации растворенного вещества. Вместо N1 введем мольную долю растворенного вещества N2 . Учитывая, что N1+ N2 = 1, получим Р = Р0 · (1- N2). Решив уравнение относительно N2, найдем, что (Р0- Р)/Р0 = ∆Р/Р0 = N2, где ∆Р/Р0 – относительное понижение давления пара растворителя над раствором. «Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества». Таким образом, относительное понижение давления пара не зависит от свойств растворенного вещества. Закон Рауля точно соблюдается только для идеальных растворов и приближённо – для разбавленных. Второй закон Рауля: Повышение температуры кипения или понижение температуры замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора: Δ Т кип = К кип * С m Δ Ткр = К кр * Сm Здесь Cm -моляльная концентрация раствора (моль/кг); Ккип - эбуллиосконическая константа или константа кипения растворителя; Ккр - криоскопическая константа или константа кристаллизации растворителя. Растворение нелетучего вещества в растворителе приводит к расширению температурного диапазона существования жилкой фазы: раствор замерзает при более низкой температуре, а кипит при более высокой температуре по сравнению с растворителем, т.к. моляльная концентрация раствора повышается. Экспериментально определенное понижение температуры за мерзания плазмы крови человека равно 0,56 °С, что отвечает моляльной в молярной концентрациям частиц 0,303 моль/кг или 0,303 моль/л и совпадает с величиной, полученной при измере нии осмотических показателей крови. Все коллигативные свой ства растворов находятся в тесной взаимосвязи. Анализ коллигативных свойств водных растворов убедительно свидетельствует о том, что растворенные вещества сильно влияют на свойства воды как растворителя, а раствор является системой, свойства которой резко отличаются от свойств исходных компонентов. Это очень важно понимать при изучении особенностей биожид костей организма, которые содержат воду, электролиты, белки, углеводы и вещества в коллоидном состоянии. В то же время физико-химические свойства таких систем, а особенно биоло гические и физиологические функции, определяются не только качественным и количественным составом, но и структурой систем, которая динамична и еще недостаточно изучена. Второй закон Рауля(следствия) – 1)условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твердым растворителем. Это будет достигаться только при более низких температурах, чем температура замерзания растворителя. 2) жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если вещество нелетучее, то давление должно быть равным парциальному давлению растворителя. 2. Понижение температуры замерзания растворов Раствор, в отличие от чистой жидкости, не отвердевает целиком при постоянной температуре; при некоторой температуре, называемой температурой начала кристаллизации, начинают выделяться кристаллы растворителя и по мере кристаллизации температура раствора понижается (поэтому под температурой замерзания раствора всегда понимают именно температуру начала кристаллизации). Замерзание растворов можно охарактеризовать величиной понижения температуры замерзания ∆Tзам равной разности между температурой замерзания чистого растворителя T0зам и температурой начала кристаллизации раствора Tзам: ∆Tзам = T0зам – Tзам Рассмотрим p – T диаграмму состояния растворителя и растворов различной концентрации (рисунок 1), на которой кривая OF – есть зависимость давления пара над твердым растворителем, а кривые OA, BC, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями, соответственно. Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково.Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношениемчисла частиц растворителяи растворенного вещества. Показано, что понижение температуры замерзания раствора ΔTзам, прямо пропорционально моляльной концентрации раствора: ΔTзам , = Kзам · Cm, где Kзам – криоскопическая постоянная растворителя – определяется природой растворителя. Связь криоскопической константы с теплотой плавления растворителя Криоскопическая константа Kзам представляет собой понижение температуры замерзания раствора при растворении 1 моль нелетучего неэлектролита в 1000 г растворителя. Константа Kзам связана с температурой замерзания растворителя Т и его теплотой плавления ΔНпл уравнением: Kзам =(RT2зам/ ΔHпл) · (M1/1000), где M1 – молярная масса растворителя, ΔHпл - энтальпия плавления растворителя, Т зам –температура замерзания растворителя .Для данного растворителя криоскопическая постоянная не зависит от природырастворенного вещества. Kзам = (RT2зам / ΔHпл) · (M1 / 1000) Метод исследования, основанный на измерении понижения температуры затвердевания растворов называют криоскопическим методом. Зная массу растворителя (g1) и массу растворенного вещества (g2) можно по измеренной ΔTзам , пользуясь уравнением ΔTзам = Kзам·Cm , определить молярную массу растворенного вещества (М2): M2 = Kзам · (1000·g2)/(ΔTзам·g1) 3. Повышение температуры кипения растворов Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении. Любая жидкость – растворитель или раствор – кипит при той температуре, при которой давление насыщенного пара становится равным внешнему давлению. Соответственно, температуры, при которых изобара p = 1 атм пересечёт кривые, представляющие зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями, соответственно, будут температурами кипения этих жидкостей. Повышение температуры кипения растворов нелетучих веществ ΔTкип = Tкип – T0 кип пропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора: ΔTкип = Kкип · Сm Коэффициент пропорциональности Kкип – есть эбулиоскопическая постоянная растворителя, не зависящая от природырастворенного вещества: Эбулиоскопическая константа имеет физический смысл повышения температуры кипения растворов с моляльной концентрацией, равной 1 моль/кг. Таким образом, второй закон Рауля можно в наиболее общем виде сформулировать следующим образом: «Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего неэлектролита прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества». Связь эбулиоскопической константы с теплотой испарения растворителя Kкип = (RT2 кип/ ΔHисп) · (M1/1000) Для данного растворителя эбулиоскопическая постоянная не зависит от природы растворенного вещества. Метод исследования, основанный на измерении повышения температуры кипения растворов, называют эбулиоскопическим методом. Зная массу растворителя (g1) и массу растворенного вещества (g2) можно по измеренной ΔTкип , пользуясь уравнением ΔTкип = Kкип·Cm , определить молекулярную массу растворенного вещества (М2): M2 = Kкип · (1000·g2)/(ΔTкип·g1) 22. Осмос. Осмотическое давление: закон Вант-Гоффа. Осмотическое давление в растворах неэлектролитов и электролитов. Изотонический коэффициент. Осмос - самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью. Не зависит от природы растворенного вещества, а только от числа частиц в растворе и от температуры. Осмотическое давление - избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью. Для учета межмолекулярных взаимодействий в реальных растворах было предложено использовать изотонический коэффициент, который для растворов неэлектролитовi=1, а для растворов электролитов i> 1(максимальное значение равно числу ионов в его молекуле) В. Пфеффер и Я Вант-Гофф, изучая колличественную зависимость осмотического давления от внешних факторов, установили, что оно подчиняется объединенному газовому закону Менделеева-Клайперока. Закон Вант-Гоффа гласит: "Осмотическое давление разбавленного раствора равно давлению, которое проявляло бы растворенное вещество, если бы оно было газообразным и занимало объем, равный объему раствора". Уравнение для описания осмотического давления для растворов неэлектролитов можно записать так: р = (m/MV)*RT = C*RT. , где р - осмотическое давление, кПа: С - молярная концентрация, моль/ л; R - универсальная газовая постоянная, равная 8,31 (кПа-л)(моль-К); Т - абсолютная температура. К. Концентрация кинетически самостоятельных частиц в растворах электролитов всегда больше, чем это следует из аналитической концентрации. С тем, чтобы свойства растворов электролитов удовлетворительно описывались уравнениями, выражающими следствие из закона Рауля, Вант-Гоффом был введен поправочный эмпирический коэффициент, называемый сейчас изотоническим или коэффициентом Вант-Гоффа (i) i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м3, а не в привычных моль/л; R — универсальная газовая постоянная; T — термодинамическая температура раствора. 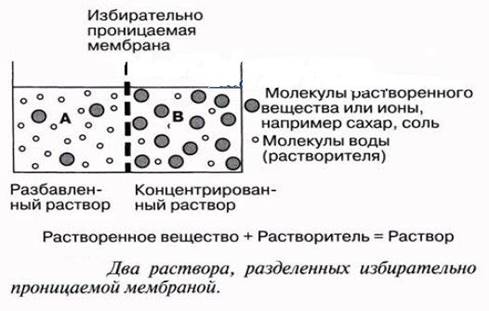 .  23.Коллигативные свойства разбавленных растворов электролитов. Элементы теории растворов сильных электролитов Дебая- Хюккеля. Ионная сила, ее математическое выражение. Понятие об активности. Коэффициент активности. |
