1. Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики
 Скачать 29.04 Mb. Скачать 29.04 Mb.
|
|
Уравнение Ленгмюра : 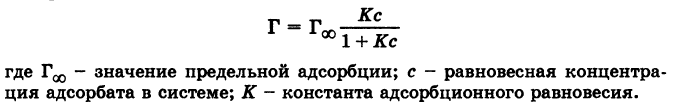 Теория адсорбции Ленгмюра: 1. Частицы вещества располагаются только на активных центрах адсорбента. 2. Каждая частица адсорбата занимает 1 активный центр адсорбента. 3. Адсорбция заканчивается образованием мономолекулярного слоя. 4. Процесс адсорбции обратимый 5. Через некоторое время адсорбированные молекулы покидают активные центры и их место занимают активные молекулы. 6. Допускается, что взаимодействие между адсорбированными молекулами отсутствует. Адсорбция газов на твердом адсорбенте зависит от следующих факторов: 1. природы и площади поверхности адсорбента 2. природы поглощаемого газа или пара 3. концентрации или давления газа или пара 4. температуры 54. Адсорбция из растворов .Правило выравнивания полярностей. Избирательная адсорбция. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов      Молекулярная адсорбция заключается в конкуренции между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. При молекулярной адсорбции природа растворителя должна сильно отличаться от природы растворенного вещества природы адсорбента. Другими словами: чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества. Также при повышении температуры адсорбция веществ из растворов обычно уменьшается. Влияние природы поглощаемого вещества определяется несколькими правилами: Во-первых правилом "подобное взаимодействует с подобным". Во-вторых, правилом Шилова: чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента. Правило Ребиндера: на поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает. Поэтому эффективней всего адсорбируются вещества, молекулы которых дифильны: включают гидрофильную (полярную) головку и гидрофобный (неполярный) хвост. При наличии в растворе вещества, молекулы которого дифильны, будет происходить их эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент всегда обращен к полярной фазе, а неполярный фрагмент- к неполярной фазе. 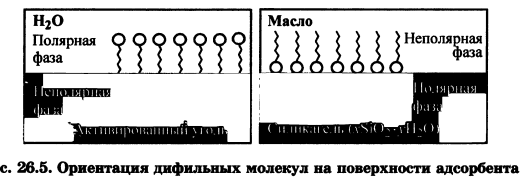 Ионная адсорбция заключается в адсорбции ионов из растворов электролитов на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, т.е. на полярных адсорбентах. При ионной адсорбции на поверхности адсорбента вследствие адсорбции ионов, называемых потенциалопределяющими, возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы - противоионы; в результате на границе раздела фаз возникает двойной электрический слой. Скорость ионной адсорбции меньше скорости молекулярной адсорбции, так как скорость диффузии сольватированных ионов меньше скорости диффузии молекул и, кроме того, адсорбции ионов предшествует более медленный, чем у молекул, процесс десольватации. Ионная адсорбция не всегда обратима, так как она может сопровождаться хемосорбцией, приводящей, например, к образованию малорастворимого вещества. Ионная адсорбция зависит от следующих факторов: 1. Радиуса иона: чем больше радиус, тем лучше ион адсорбируется. 2. От заряда иона: чем больше заряд, тем лучше адсорбируется. 3. От степени ионизации и гидратации. 4. От Рн среды В животных организмах явления адсорбции также играют очень большую роль в их жизнедеятельности. Роль адсорбции обусловлена наличием в организме огромного количества самых разнообразных поверхностей раздела - стенок сосудов, поверхности клеток, клеточных ядер и вакуолей, коллоидных частиц протоплазмы и, наконец, поверхности раздела между организмом и средой. Особенно важную функцию выполняет поверхность раздела между организмом и средой для низших организмов и организмов, живущих в воде, так как ей принадлежит существенная роль в процессах питания и обмена веществ. Исследования последних лет показали, что пищевые вещества, как правило, являются поверхностно-активными веществами, и потому первым этапом их усвоения является адсорбция, а процесс их химического превращения уже вторичен. Исследования показали, что эритроциты являются переносчиками различных веществ, в том числе аминокислот, которые они разносят и передают клеткам и различным тканям организма. Количество эритроцитов в крови взрослого человека примерно 5 000 000 в 1 нм3. У здорового мужчины в среднем на 1 кг массы приходится 450 миллиардов эритроцитов, 27 триллионов на весь организм. Учитывая, что диаметр эритроцита 7—8 мкм, можно легко подсчитать, что общая поверхность эритроцитов всей крови человека составит примерно 3200 м2. Большинство реакций, протекающих в организме, совершается при непосредственном участии ферментов-катализаторов. Исследования показали, что первые стадии действия любого фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие. Гемосорбция - метод лечения, направленный на удаление из крови различных токсичных продуктов и регуляцию гомеостаза путем контакта крови с сорбентом вне организма. При контакте крови с гемосорбентом наблюдается конкуренция за активные центры между веществами, подлежащими удалению, и веществами, наличие которых обеспечивает жизненно необходимые функции. Использование неспецифических сорбентов делает процедуру гемосорбции практически неуправляемой, так как при этом удаляются и токсиканты, и вещества, находящиеся в плазме в норме. Эффективность этого метода лечения в настоящее время связана с созданием высокоспецифичных сорбентов конкретных метаболитов, ионов, токсинов. Важной проблемой гемосорбции является создание сорбентов, совместимых с кровью (гемосовместимых сорбентов). Разработана методика гемосорбции с наложенным электрическим потенциалом, что обеспечивает ускорение процесса.      55. Дисперсные системы. Классификация дисперсных систем по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Природа коллоидного состояния.   По размеру: Грубодисперсные - суспензии, эмульсии,пены,аэрозоли. Мутные. Не проходят через бумажный фильт. 10-6 -10-4 Коллоидно-дисперсные: коллоидные растворы. Прозрачные, опалесцируют при боковом освещении. Проходят через бумажный фильтр, но не проходят через животные и растительные мембраны. 10-9 -10-6 Молекулярно-дисперсные: истинные растворы низкомолекулярных веществ. Прозрачные. Проходят через животные и растительные мембраны. 10-9 - 10-10 По агрегатному сост.:  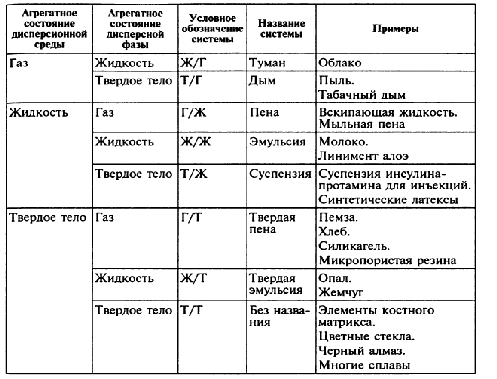   Коллоидная химия, традиционное название физической химии дисперсныхсистем и поверхностных явлений. Термин «коллоиды» — синоним высокодисперсных (микрогетерогенных) систем, то есть дисперсных систем с наиболее развитой поверхностью раздела фаз. К. х. изучает своеобразные процессы и явления, обусловленные особенностями высокодисперсного состояния тел. К ним относятся, например, самопроизвольное укрупнение частиц твёрдой дисперсной фазы или капель жидкости (коагуляция и коалесценция) как проявление термодинамической (агрегативной) неустойчивости дисперсных систем; застудневание жидких дисперсных систем с образованием гелей и возникновение пространственных дисперсных структур; взаимодействие соприкасающихся тел (трение, адгезия) и изменение этого взаимодействия под влиянием веществ, адсорбирующихся на поверхностях соприкосновения; явления в тонких жидких и твёрдых плёнках; самопроизвольное диспергирование жидкостей и твёрдых тел. 56. Методы получения и очистки коллоидных растворов. Получение эмульсий, суспензий, эмульсий, коллоидных растворов. Диализ, электродиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки.  Методы диспергирования ( физические) :
(Химические):
Конденсационный метод ( физические) : 1.Замена растворителя . Вещество, ранее необходимое в растворенном состоянии выделяют из раствора. (химически): 1)Метод восстановления 2)Обменный метод 3)Метод гидролиза 4)Метод окисления Методы очистки коллоидных растворов:     Ультрафильтрация- отделение дисперсной фазы от дисперсной среды через специальный фильтр. Фильтрацию проводят под давлением. В осноке метода лежит «продавливание» разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы нмв. Получение эмульсий, суспензий, эмульсий, коллоидных растворов.Слесарев с.754 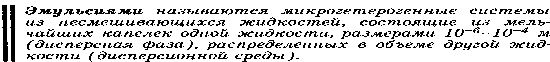    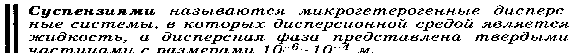      57.Молекулярно-кинетические свойства коллоидно-дисперсных систем: броуновское движение, диффузия, осмотическое давление, седиментационное Фарадея-Тиндаля. Уравнение Рэлея, его анализ.   См прак навыки  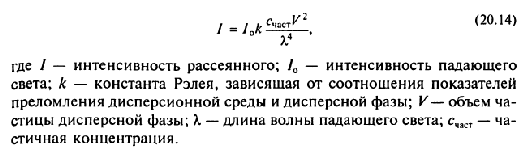 58.Электрокинетические свойства: электрофорез и электроосмос; потенциал течения и потенциал седиментации. Биологическое значение. При воздействии на дисперсную систему электрического поля можно наблюдать перемещение дисперсной фазы и дисперсионной среды относительно друг друга. Отсюда следует, что части системы электрически заряжены. Электрокинетические свойства: - Электрофорез - движение заряженных коллоидных частиц к противоположно заряженному электроду, называется электрофорезом. Электрофорез широко применяется для лечения: заболеваний дыхательной системы;
Лечебное вещество наносится на прокладки электродов и под действием электрического поля проникает в организм через кожные покровы (в терапии, неврологии, травматологии и др.) или слизистые оболочки (в стоматологии, ЛОР, гинекологии и др.) и влияет на физиологические и патологические процессы непосредственно в месте введения. Электрический ток также оказывает нервно-рефлекторное и гуморальное действие. Электроосмос- движение жидкости через капилляры или пористые диафрагмы при наложении внешнего электрического тока. Явление электроосмоса используется в физических экспериментах для введения веществ через микроэлектрод. -Потенциал течения( потенциал Квинке)- разность потенциалов, возникающая на концах капиллярной системы при протекании через систему жидкой дисперсионной среды. Возникновение потенциала объясняется тем, что при движении через капиллярную систему жидкая дисперсионная среда увлекает за собой подвижные противоионы диффузного слоя , вследствие чего на конце капиллярной системы накапливается заряд, имеющий заряд противоионов. -Потенциал оседания(потенциал Дорна, седиментации) – разность потенциалов, возникающая при оседании частиц дисперсной фазы в жидкость дисперсионной среды. Возникновение потенциала объясняется тем, что при оседании частиц дисперсной фазы нижние слои дисперсной системы приобретают заряд других частиц, а верхние слои обогащены противоиноми диффузной части ДЭС, приобретают заряд противоинов 59. Строение мицеллы лиофобного золя. Строение двойного электрического слоя. Межфазный и электрокинетический потенциалы коллоидных частиц, зависимость от различных факторов. Понятие об электрокинетическом потенциале как о факторе устойчивости .         Важность дзета-потенциала состоит в том, что его значение может быть связано с устойчивостью коллоидных систем. Дзета-потенциал определяет степень и характер взаимодействия между частицами дисперсной системы. Для молекул и частиц, которые достаточно малы, выскоий дзета-потенциал будет означать стабильность, т.е. раствор или система будут устойчивы по отношению к агрегации. Когда дзета-потенциал низкий, притяжение превышает отталкивание, и устойчивость системы будет нарушаться. Так, коллоидные растворы с высоким дзета-потенциалом являются электрически стабилизированными, в то время, как коллоидные растворы с низким дзета-потенциалом склонны коагулировать. Чем выше заряд твердой фазы, чем больше толщина диффузного слоя и больше значение дзета-потенциала, тем больше расклинивающее давление между частицами и выше агрегативная устойчивость коллоидного раствора. 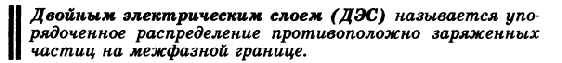  60.Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.   |
