Органика. 1. Предмет орг химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура
 Скачать 410.1 Kb. Скачать 410.1 Kb.
|
гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего Н
|
| 3H2C=CH2 + 2KMnO4 + 4H2O ® 3 | CH2−CH2(этиленгликоль) + 2MnO2 + 2KOH I I OH OH |
Ациклические и циклические алкены при взаимодействии с надкислотами RCOOOH в неполярной, среде образуют эпоксиды (оксираны), поэтому сама реакция носит название реакции эпоксидирования.
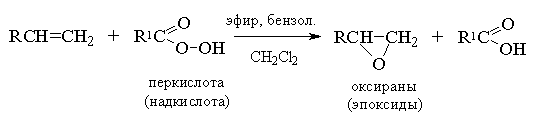
Озонирование алкенов.
при взаимодействии алкенов с озоном образуются перекисные соединения, которые называются озо-нидами. Реакция алкенов с озоном является наиболее важным методом окислительного расщепления алкенов по двойной связи
Алкены не вступают в реакции замещения.
Вакер-процесс —процесс получения ацетальдегида прямым окислением этилена.
Вакер-процесс основан на реакции окисления этилена дихлоридом палладия:
CH2=CH2 + PdCl2 + H2O = CH3CHO + Pd + 2HCl
15. Алкены: химические свойства. Гидрирование. Правило Лебедева. Изомеризация и олигомеризация алкенов. Радикальная и ионная полимеризация. Понятие полимер, олигомер, мономер, элементарное звено, степень полимеризации. Теломеризация и сополимеризация.
Гидрирование
Гидрирование алкенов непосредственно водородом происходит только в присутствии катализатора. Катализаторами гидрирования служат платина,палладий, никель
Гидрирование можно проводить и в жидкой фазе с гомогенными катализаторами
Реакции изомеризации
При нагревании возможна изомеризация молекул алкенов, которая
может привести как к перемещению двойной связи, так и к изменению скелета
углеводорода.
CH2=CH-CH2-CH3 CH3-CH=CH-CH3
Реакции полимеризации
Это разновидность реакции присоединения. Полимеризация - это реакция последовательного соединения одинаковых молекул в большие по размеру молекулы, без выделения какого-либо низкомолекулярного продукта. При полимеризации атом водорода присоединяется к наиболее гидрогенизированному атому углерода, находящемуся у двойной связи, а к другому атому углерода присоединяется остальная часть молекулы.
CH2=CH2 + CH2=CH2 + ... -CH2-CH2-CH2-CH2- ...
или n CH2=CH2 (-CH2-CH2-)n (полиэтилен)
Вещество, молекулы которого вступают в реакцию полимеризации, называются мономером. Молекула мономера обязательно должна иметь хотя бы одну двойную связь. Образующиеся полимеры состоят из большого количества повторяющихся цепочек, имеющих одинаковое строение (элементарных звеньев). Число, показывающее, сколько раз в полимере повторяется структурное (элементарное) звено, называется степенью полимеризации (n).
В зависимости от вида промежуточных частиц, образующихся при полимеризации, различают 3 механизма полимеризации: а) радикальный; б)катионный; в) анионный.
По первому методу получают полиэтилен высокого давления:
Катализатором реакции выступают пероксиды.
Второй и третий методы предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений.
В химии олигомер ) — молекула в виде цепочки изнебольшого числа одинаковых составных звеньев.
Теломеризация
Теломеризация – олигомеризация алкенов в присутствии веществ – передатчиков цепи (телогенов). В результате реакции образуется смесь олигомеров (теломеров), концевые группы которых представляют собой части телогена. Например, в реакции CCl4 с этиленом телогеном является CCl4.
CCl4 + nCH2=CH2 => Cl(CH2CH2)nCCl3
Инициирование этих реакций может осуществляться радикальными инициаторами или g -излучением.
16. Алкены. Реакции радикального присоединения галогенов и галогеноводородов (механизм). Присоединение карбенов к олефинам. Этилен, пропилен, бутилены. Промышленные источники и основные пути использования.
Алкены легко присоединяют галогены, особенно хлор и бром (галогенирование).
Типичной реакцией такого типа является обесцвечивание бромной воды
CH2=CH2 + Вr2 → СH2Br-CH2Br (1,2-дибромэтан)
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:
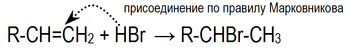
Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода
