Органика. 1. Предмет орг химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура
 Скачать 410.1 Kb. Скачать 410.1 Kb.
|
гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего НСН≡СН + HСl => СH2=CHCl + HCl => СH3-CHCl2 (хлорвинил) (1,1-дихлорэтан) Гидратация ацетилена (реакция Кучерова) идет при пропускании ацетилена в воду, в которой содержится соль двухвалентной ртути и серная кислота. Сначала образуется нестойкое соединение - виниловый спирт, который тут же изомеризуется до уксусного альдегида. Гомологи ацетилена также способны присоединять воду. СН≡СН + H2O => СH2=CH-OH (изомеризация) => СH3-COH 21. Алкины. Реакции нуклеофильного присоединения спиртов, синильной и уксусной кислоты. Понятия о нуклеофильном механизме присоединения по тройной связи. Карбонилирование алкинов. Окислительные превращения алкинов. Олигомеризация и полимеризация. Применение в промышленности. Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен. Присоединение уксусной кислоты в присутствии фосфорной кислоты. Образующийся винилацетат служит сырьем для производства поливинилацетата-основного компонента известного клея ПВА. СН≡СН + CH3COOH => СH2=CH-O-CO-CH3 Характерным примером реакции нуклеофильного присоединения является Реакция Фаворского — присоединениеспиртов в присутствии щелочей с образованием алкенильных эфиров: Присоединение синильной кислоты Реакции полимеризации 1. Димеризация идет в присутствии хлорида меди (I). Образующийся винилацетилен служит сырьем для получения хлоропрена. Винилацетилен способен к дальнейшей полимеризации и присоединяя молекулу ацетилена образует дивинилацетилен. СН≡СН + СН≡СН => СH2=CH-С≡СН; 2. Тримеризация - объединение 3-х молекул ацетилена с образованием бензола 3СН≡СН => С6H6 Реакции олигомеризацииВ присутствии солей меди(I) и хлорида аммония в водной среде ацетилен вступает в реакцию олигомеризации с образованием винилацетилена: Реакция может идти дальше с образованием дивинилацетилена: Реакции окисления 1. Ацетиленовые углеводороды легко окисляются при действии обычных окислителей, а при энергичном окислении разрываются по месту тройной связи. Так, ацетилен окисляется раствором перманганата калия до щавелевой кислоты (оксалата калия). 3СН≡СН + 8KMnO4 =>3KOOC-COOK + 8MnO2 + 2KOH + 2H2O 2. Горение - огромное количество тепла, выделяющееся при сгорании ацетилена в кислороде, позволяет проводить резание и сваривание металлов. 2СН≡СН + 5О2 => 4СО2 + 2H2O ∆H = -3200 кДж Применение Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применение: 1. В качестве топлива при резке и сваривании металлов 2. Производство ацетальдегида, а из него уксусную кислоту и этанол. 3. Производство хлорвинила сырья для получения медицинского полимера - полихлорвинила. 4. Производство винилацетилена - сырья для получения хлоропренового каучука, поливинилацетата. 22. Ацетиленовые углеводороды: С-Н-кислотные свойства алкинов с концевой тройной связью. Константа кислотности. Реакции замещения. Образование ацетиленидов, их свойства и синтетическое применение. Реакции альдегидов и кетонов с алкинами. Кислотные свойства алкинов с концевой тройной связью 1. Ацетилениды. Ацетилен взаимодействует с металлическим натрием в среде жидкого аммиака: 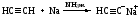 2. Реакция с альдегидами и кетонами: 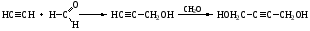 Реакции замещения 1. В отличие от этана и этилена, ацетилен имеет кислотные свойства. Атом водорода при углероде с тройной связью способен замещаться на атом металла. Так при пропускании ацетилена через аммиачный раствор нитрата серебра выпадает белый осадок ацетиленида серебра, аммиачный раствор хлористой меди дает красный осадок ацетиленида меди. Ацетилениды легко взрываются при ударе или нагревании. К ацетиленидам относится и карбид кальция СаС2. СH≡СН + 2[Ag(NH3)2]Cl => Ag-C≡С-Ag + 2NH4Cl Ацетилениды разрушаются кислотами Ag-C≡С-Ag + 2HCl => СH≡СН + 2AgCl Ацетилениды щелочных и щелочно-земельных металлов используются для получения гомологов ацетилена. 23. Циклопарафины. Изомерия. Номенклатура. Методы получения: из дигалогенпроизводных, из солей дикарбоновых кислот, гидрогенизацией ароматических углеводородов, дегидроциклизацией парафинов, реакциями циклоприсоединения. Циклоалканы(циклопарафины) - это насыщенные циклические углеводороды с общей формулой СnH2n. Циклоалканы могут иметь циклы, включающие три, четыре, пять, шесть и семь атомов углерода. Осн. природный источник циклоалканов - нефть Для циклоалканов характерны следующие виды изомерии:
Все атомы углерода в молекулах циклоалканов имеют sp³-гибридизацию. Однако величины углов между гибридными орбиталями в циклобутане и особенно вциклопропане не 109°28', а меньше из-за геометрии. Методы получения: Дегалогенирование дигалогенпроизводных алканов H2C-CH2-Br + Mg => Н2С-СН2 + MgBr2 Гидрирование бензола и его гомологов (образуются циклогексан или его производные): С6Н6 +3Н2 = С6Н12 24. Циклопарафины. Пространственное строение. Напряжение цикла, его виды. Инверсия цикла. Особенности химических свойств циклоалканов, реакции замещения, раскрытия, сужения и расширения кольца. Нахождение в природе и применение моно-, би- и полициклоалканов. Все атомы углерода в циклоалканах находится в состоянии sp3-гибридизации и образуют 4 σ-связи. Однако углы между связями зависят от размера цикла. В циклопропане и циклобутане они составляют, соответственно, 60 и 90, (нормальный валентный угол 109,280), что создает в этих молекулах напряжение, поскольку перекрывание орбиталей идет вне прямой, соединяющей ядра атомов углерода. Эти сигма-связи изогнуты подобно банану и называются «банановыми». Поэтому циклы в напряженных циклоалканах неустойчивы и легко разрываются. Для циклоалканов характерны следующие виды напряжений: 1 ) торсионное (Пи-гцеровское) напряжение — связано со взаимодействием химических связей в заслоненной или частично заслоненной конформациях; 2) напряжение Ван-дер-Ваальса — обусловлено взаимным отталкиванием заместителей при сближении на расстояние, близкое сумме их вандерваальсовых радиусов; 3) угловое (Байеровское) напряжение — присуще отдельным циклоалканам и связано с отклонением валентных углов между углерод-углеродными связями в цикле от нормального (тетраэдрического) значения. В обычных условиях преобладающая часть молекул циклогексана (99,9 %) существует в конформации «кресла». В результате вращения вокруг углерод-углеродных связей одна конформация «кресла» переходит в другую, энергетически равноценную, форму кресла. Такой процесс называют инверсией цикла. ве конформации «кресла» могут взаимно превращаться как с промежуточным образованием конформации «ванны», конформации, так и без прохождения через конформацию «ванны». 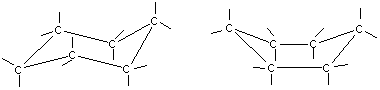 1. конформация кресла 2.ванны Циклопропан и циклобутан склонны к реакциям присоединения, а для циклопентана и циклогексана более характерны реакции замещения. Циклопропан и циклобутан способны присоединять бром: С3H6 + Br2 → BrCH2—CH2—CH2Br 2. Циклопропан, циклобутан и циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора: С4H8 + H2 → CH3—CH2—CH2—CH3 Применение: Применение циклоалканов. Из циклопарафинов практическое значение имеют циклопентан, циклогексан, метил циклогексан, их производные и другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды - в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и т.д. Циклопропан применяют для наркоза. Циклопентан используется как добавка к моторному топливу для повышения качества последнего и в разных синтезах. 25.Ароматические углеводороды. Пространственное и электронное строение молекулы бензола. Ароматичность. Правило Хюккеля. Критерии ароматичности. Номенклатура и изомерия аренов. Физические свойства ароматических углеводородов. Арены - это циклические соединения, в молекулах которых содержатся одно или несколько ядер бензола. Эмпирическая формула бензола С6Н6 Строение бензола  Современная точка зрения на строение бензола: плоская молекула, атомы углерода которой находятся в состоянии sp2 -гибридизации и объединены в правильный шестиугольник. 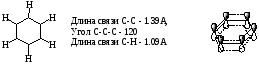 Изображение молекулы бензола:  Ароматичность - необычайно низкая энергия невозбужденного состояния, вызванная делокализацией π-электронов. Ароматичность -понятие, характеризующее совокупность структурных, энергетических свойств и особенностей реакционной способности циклических структур с системой сопряженных связей Признаки ароматичности Любое соединение обладает ароматичностью, если оно имеет: а) плоский замкнутый цикл; б) сопряженную π−электронную систему, охватывающую все атомы цикла; в) если число электронов, участвующих в сопряжении соответствует формуле Хюккеля (4n+2., где n - число циклов). ИзомерияДля ди-, три- и тетразамещенных ароматических углеводородов характерна изомерия положения заместителя и изомерия боковой алкильной цепи. 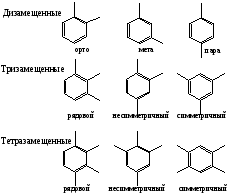 Моно-, пента- и гексазамещенные арены не имеют изомеров, связанных с положением заместителя в кольце. НоменклатураПроизводные бензола называют замещенными бензолами. Для многих из них либо используют тривиальные названия, либо заместитель обозначается приставкой перед словом «бензол». В случае монозамещенных бензолов в названия не входят цифры, так как все шесть атомов углерода молекулы бензола равноценны, для каждого заместителя возможен только один монозамещенный бензол. 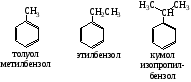 Если в молекуле бензола присутствуют два заместителя, то могут существовать три различных дизамещенных бензола. Они называются соответственно орто-, мета- и пара-замещенными: 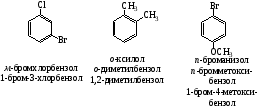 Если в бензоле имеется три и более заместителей, то их положение в кольце следует обозначать только цифрами. Во всех случаях названия заместителей перечисляют перед словом «бензол» в алфавитном порядке. Цифра 1 в названии может быть пропущена, заместитель, с которого начинается отсчет, в этом случае входит в основу названия: 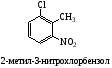 Физические свойства Все ароматические соединения имеют запах. Бензол, толуол, ксилолы, этилбензол, кумол, стирол - жидкости, нафталин, антрацен - твердые вещества. 26. Ароматические углеводороды ряда бензола. Номенклатура. Изомерия. Способы получения бензола и его гомологов: из каменноугольной смолы, ароматизацией и дегидроциклизацией парафинов, по реакции Вюрца-Фиттига, алкилированием по Фриделю-Крафтсу олефинами, галоидными алкилами, спиртами, из солей бензойной кислоты, тримеризацией алкинов. Арены(ароматические углеводороды) - это циклические соединения, в молекулах которых содержатся одно или несколько ядер бензола. Эмпирическая формула бензола С6Н6 ИзомерияДля ди-, три- и тетразамещенных ароматических углеводородов характерна изомерия положения заместителя и изомерия боковой алкильной цепи.  Моно-, пента- и гексазамещенные арены не имеют изомеров, связанных с положением заместителя в кольце. НоменклатураПроизводные бензола называют замещенными бензолами. Для многих из них либо используют тривиальные названия, либо заместитель обозначается приставкой перед словом «бензол». В случае монозамещенных бензолов в названия не входят цифры, так как все шесть атомов углерода молекулы бензола равноценны, для каждого заместителя возможен только один монозамещенный бензол. 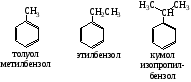 Если в молекуле бензола присутствуют два заместителя, то могут существовать три различных дизамещенных бензола. Они называются соответственно орто-, мета- и пара-замещенными: 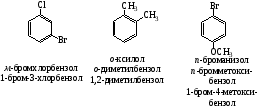 Если в бензоле имеется три и более заместителей, то их положение в кольце следует обозначать только цифрами. Во всех случаях названия заместителей перечисляют перед словом «бензол» в алфавитном порядке. Цифра 1 в названии может быть пропущена, заместитель, с которого начинается отсчет, в этом случае входит в основу названия:  Получение: 1.Переработка каменноугольной смолы, перегонка нефти, cухая перегонка древесины. 2. Ароматизация нефти. 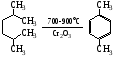 3. Дегидроциклизация гексана и гептана. C6H14 → С6H6 + 4H2 C7H16 → С6H5-СН3 + 4H2 4. Вюрца-Фиттига: 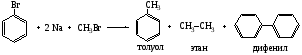 Алкилирование по Фриделю – Крафтсу. Принято два возможных механизма протекания реакции. В первом случае электрофильной частицей является карбокатион, образующийся в результате взаимодействия галогеналкана с хлоридом алюминия (кислотой Льюиса):  Во втором случае можно предполагать, что электрофилом служит алкильная группа полярного комплекса AlCl3 с алкилгалогенидом.  Алкилирование бензола (реакция Фриделя-Крафтса) C6H6 + C2H5Cl → С6H5-C2H5 + HCl 27.Электрофильное замещение в ароматическом ряду (нитрование, сульфирование, галогенирование, алкилирование и ацилирование по Фриделю-Крафтсу). Понятие о - и -комплексах. Механизм реакций электрофильного замещения |
