Органика. 1. Предмет орг химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура
 Скачать 410.1 Kb. Скачать 410.1 Kb.
|
Классификация по направлению реакцииРеакции замещения2: R–Н + Сl–Cl Реакции присоединения(по кратным связям): 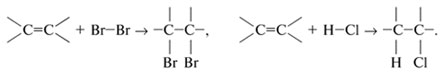 Реакции отщепления (элиминирования) с образованием кратных связей: 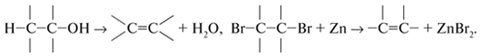 \ \Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический. Гетеролитические реакции называют ионными, поскольку они сопровождаются образованием органических ионов. Гомолитические реакции протекают преимущественно в газовой фазе. Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны). Нуклеофильные реагентыа) нейтральные молекулы, имеющие неподеленные пары электронов: б) анионы: OH— ; CN—; NH2—; RCOO—; RS—; Cl—; Br—; I—; HSO3—; в) соединения, содержащие центры с повышенной электронной плотностью: Электрофильные реагентыа) нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты Льюиса (AlCl3, SnCl4, FeBr3, BF3); б) катионы: протон (Н+), ионы металлов (Меn+); SO3H+, NO2+, NO+; в) молекулы, имеющие центры с пониженной электронной плотностью: галогенпроизводные углеводов – Rδ+—Halδ—, галогены (Cl2, Br2, I2), соединения с карбонильной группой Карбкатионы – положительно заряженные частицы, атом углерода, несущий положительный заряд находится в sр2-гибридизации. Карбанионы – отрицательно заряженные частицы, заряд которых обусловлен наличием в их структуре атома С с неподеленной электронной парой. При этом атом углерода, несущий отрицательный заряд, может быть как в sp2, так и в sр3-гибридизации. Свободные радикалы – любая электронейтральная активная частица, содержащая одноэлектронную орбиталь, т.е. неспаренный электрон. 6. Кислоты и основания в орг.химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность. По Льюису, кислотные и основные свойства органических соединений оцениваются по способности принимать или предоставлять электронную пару с последующим образованием связи. Атом, принимающий электронную пару, является акцептором электронов, а соединение, содержащее такой атом, следует отнести к кислотам. Атом, предоставляющий электронную пару, является донором элекронов, а соединение, содержащее такой атом, – основанием. Конкретно кислотами Льюиса могут быть атом, молекула или катион: протон, галогениды элементов второй и третьей групп Периодической системы, галогениды переходных металлов – BF3 , ZnCl2 , AlCl3 , FeCl3 ,FeBr3 , TiCl4 , SnCl4 , SbCl5 , катионы металлов, серный ангидрид – SO3 , карбкатион. К основаниям Льюиса относятся амины (RNH2 , R2NH, R3N), спирты ROH, простые эфиры ROR По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Сопряжённые кислота и основание: HCN (кисл) и СN-(основание) NН3(основание) и NH4+ (кислота) Кислотно-основное (или протолитическое) равновесие– это равновесие в котором участвует протон (Н+). HCOOH + H2O D H3O+ + HCOO- кислота1 основание2 сопряженная сопряженное кислота2 основание1 или H2O + NH3 D NH4+ + OH-. кислота1 основание2 сопряженная сопряженное кислота2 основание1 7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,S, Z,E – номенкулатуры. Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стерео-изомеры — расположением атомов в пространстве при одинаковом порядке связей между ними. Структурная изомерия: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию). Структурная изомерия + 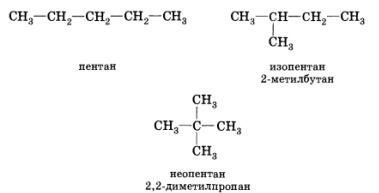 Изомерия углеродного скелета Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы: 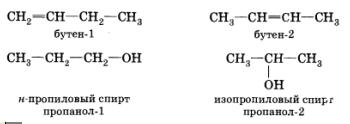 Пространственная изомерия Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). 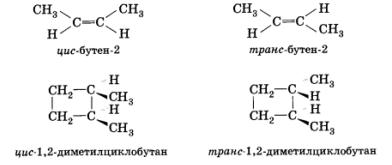 Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале. Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом называют асимметрическим. 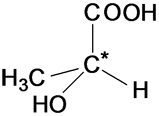 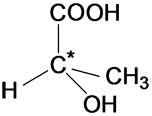 ХИРАЛЬНОСТЬ, св-во объекта быть несовместимым со своим отображением в идеальном плоском зеркале. Различные пространственные структуры, возникающие за счет вращения вокруг простых связей без нарушения целостности молекулы (без разрыва химических связей), называют КОНФОРМАЦИЯМИ. 8. Строение алканов. Sp3- состояние углерода. Характеристика связей С-С и С-Н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов. Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации, угол между связями С-C составляет 109°28', поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм 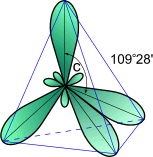 Связь С-С ковалентная неполярная. Связь С-Н ковалентная слабополярная, тк С и Н близки по электроотрицательности. Физические свойства В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями..
Вращение атомов вокруг s-связи не будет приводить к ее разрыву. В результате внутримолекулярного вращения по s-связям С–С молекулы алканов, начиная с этана С2Н6, могут принимать разные геометрические формы. Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг s-связей С–С, называют конформациями или поворотными изомерами (конформерами). Поворотные изомеры молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами. Общее (родовое) название предельных углеводородов — алканы. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан 9. Углеводороды. Классификация. Предельные углеводороды ряда метана. Гомологический ряд. Номенклатура. Изомерия. Радикалы. Природные источники. Синтез Фишера-Тропша. Методы получения ( из алкенов, карбоновых кислот, галогенпроизводных, по реакции Вюрца)
Общее (родовое) название предельных углеводородов — алканы. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан Свою номенклатуру имеют и радикалы (углеводородные радикалы). Одновалентные радикалы называют алкилами и обозначают буквой R или Alk. Их общая формула CnH2n+ 1 . Названия радикалов составляют из названий соответствующих углеводородов заменой суффикса -ан на суффикс -ил (метан — метил, этан — этил, пропан — пропил и т.д.). Двухвалентные радикалы называют, заменяя суффикс -ан на -илиден (исключение - радикал метилен ==СН2). Трехвалентные радикалы имеют суффикс -илидин Изомерия. Для алканов характерена структурная изомерия. Если в молекуле алкана содержится более трех углеродных атомов, то порядок их соединения может быть различным. Один из изомеров бутана (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение). Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье- нефть и сопутствующие ей нефтяные газы. Получение алканов можно осуществить реакцией Вюрца, заключающейся в действии металлического натрия на моногалогенопроизводные углеводородов. 2CH3–CH2Br(бромистый этил) + 2Na ––> CH3–CH2–CH2–CH3(бутан) + 2NaBr
CnH2n + H2 → CnH2n+2 Синтез Фишера — Тропша nCO + (2n+1)H2 → CnH2n+2 + nH2O Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2-.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях. Физические свойства В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Химические свойства Тривиальное (историческое) название алканов - "парафины" - означает "не имеющие сродства". Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия. Для них свойственны реакции замещения водородных атомов и расщепления. Реакции радикального замещенияГалогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть. Галогенирование — это одна из реакций замещения. CH4 + Cl2 → CH3Cl (хлорметан) + HCl Нитрование: RH + HNO3 → RNO2 + H2O. Сульфохлорирование (реакция Рида): При облучении УФ-излучением алканы реагируют со смесью SO2 и Cl2 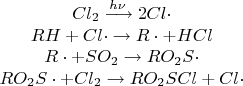 11. Предельные углеводороды ряда метана. Химические свойства: крекинг, дегидрирование, изомеризация, дегидроциклизация. Реакция окисления, частичное окисление, образование и распад гидропероксидов (автоокисление). Применение алканов.
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2-.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами. Крекинг. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. При крекинге происходит гомолитический разрыв углерод-углеродных связей с образованием насыщенных и ненасыщенных углеводородов с более короткими цепями. CH3–CH2–CH2–CH3(бутан) ––400°C> CH3–CH3(этан) + CH2=CH2(этилен) Окисление. В обычных условиях алканы устойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла. В общем виде реакцию горения алканов можно записать следующим образом: СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O. Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода. Так, метан при 1500ºС приводит к ацетилену. 2CH4 ––1500°C> H–C=C–H(ацетилен) + 3H2 Изомеризация. Алканы нормального строения под влиянием катализаторов и нагревании способны превращаться в разветвленные без изменения состава молекул – изомеризация. 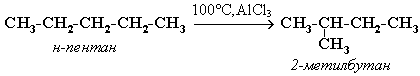 Применение Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и широко используется в качестве промышленного и бытового газа. Средние члены гомологического ряда применяются как растворители и моторные топлива. Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе. 12. Алкены. Гомологический ряд. Номенклатура. Строение. sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева. Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n Гомологический ряд.
Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой. Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2— «аллил».  Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная. Физические свойства
Дегидрирование алкановЭто один из промышленных способов получения алкенов Гидрирование алкиновЧастичное гидрирование алкинов требует специальных условий и наличие катализатора Двойная связь является сочетания сигма- и пи-связей. Сигма- связь возникает при осевом перекрывании sp2 – орбиталей, а пи-связь при боковом перекрывании Правило Зайцева: Отщепление атома водорода в реакциях элиминирования происходит преимущественно от наименее гидрогенизированного атома углерода. 13. Алкены. Строение. sp2 гибридизация, параметры кратной связи. Реакции электрофильного присоединения галогенов, галогеноводородов, , хлорноватистой кислоты. Гидратация алкенов. Правило Морковникова. Механизмы реакций. Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n Одна s- и 2 p-орбитали смешиваются и образуются 2 равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120. Если связь образуется более чем одной парой электронов, то она называется кратной. Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома. Реакции электрофильного присоединенияВ данных реакциях атакующей частицей является электрофил. Галогенирование: ГидрогалогенированиеЭлектрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова 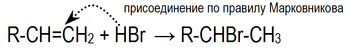 Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
