Органика. 1. Предмет орг химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура
 Скачать 410.1 Kb. Скачать 410.1 Kb.
|
Физические свойстваБутадиен — газ с характерным запахом, температура кипения -4,5 °C. Плохо растворим в воде, хорошо растворим в спирте, керосине с воздухом. Применение: Полимеризацией бутадиена получают синтетические каучуки. Изопрен (2-метилбутадиен-1,3) — ненасыщенный углеводород, принадлежащий алкадиенам, представляющий собой бесцветную летучую жидкость с характерным запахом. Является мономером натурального каучука Изопрен растворим во многих органических растворителях. Плохо растворим в воде. Основное применение в промышленности — синтез изопреновых каучуков, некоторых медицинских препаратов, душистых веществ. Получение алкадиенов из этилового спиртов по методу С.В.Лебедева при 580оС и с участием катализаторов - Al2O3, ZnO. 2C2H5OH => СH2=CH-CH=CH2 + H2 + 2H2O Дегидратация гликолей 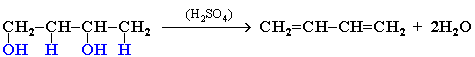 Хлоропрен получают из винилацетилена: CH2=CH-C≡СH + HCl = >СH2=CCl-CH=CH2 18. 1,3 – алкадиены. Особенности молекулярной структуры. Химические свойства. Реакции электрофильного присоединения (механизм) : 1,2- и 1,4-присоединение. Цикло присоединение по Дильсу-Альдеру. Полимеризация и сополимеризация диенов. Натуральный и синтетический каучук. 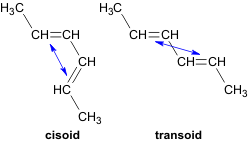 Если между двумя двойными связями находится одна одинарная связь, то такие алкадиены называются алкадиенами-1,3 или сопряженными диенами, например, СН2=СН–СН=СН2 бутадиен-1,3. Структурные исследования молекулы бутадиена–1,3 показали, что все ее атомы лежат в одной плоскости. Наиболее вероятным является расположение двойных связей в транс-конформации по отношению к одинарной связи. Особенностью сопряженных диенов является то, что двойные связи в их молекулах функционируют как единое целое и присоединение идет преимущественно по крайним положениям сопряженной системы (1,4-присоединение) с образованием новой двойной связи в центре системы. Параллельно, однако, идет второстепенная реакция присоединение по одной из 2 двойных связей (1,2-присоединение). 1.Гидрирование. При гидрировании бутадиена-1,3 получается бутен-2, т.е происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между С2 и С3 CH2=CH-CH=CH2 + H2 =CH3-CH=CH-CH3 (бутен-2) 2. Галогенирование. Присоединение галогенов, галогеноводородов происходит по электрофильному механизму. Галогенирование сопряженных диенов происходит постепенно. ПИСАТЬ В ОТВЕТ ТРИ РЕАКЦИИ! 1,4-присоединение. CH2=CH-CH=CH2 + Br2=> СH2Br-CH=CH-CH2Br -1,4-дибромбутен-2 1,2- присоединение CH2=CH-CH=CH2 + Br2 => СH2Br-CHBr-CH=CH2 1,2-дибромбутен-1 СH2Br-CH=CH-CH2Br Br2 => СH2Br-CHBr-CHBr-CH2Br (1,2,.3,4-тетрабромбутан). 3. Диеновый синтез ( реакция Дильса – Альдера) – присоединение к сопряженным диенам соединений, содержащих кратные связи ( диенофилы). Реакция идет как 1,4-присоединение и приводит к образованию циклических продуктов. И ДА, РИСУЙ ЭТИ ФИГОВИНЫ! 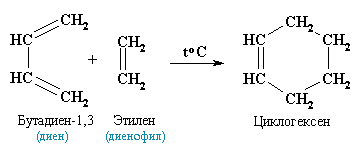 Реакции полимеризации также проходят с перемещением двойной связи и приводят к образованию каучуков. nСH2=CH-CH=CH2 => (-CH2-CH=CH-CH2-)n полибутадиен (дивиниловый каучук) nCH2=C(CH3)-CH=CH2 => (-CH2-C(CH3)=CH-CH2-)n полиизопреновый каучук nCH2=CCl-CH=CH2 => (-CH2-CCl=CH-CH2-)n хлоропреновый каучук. Натуральный каучук получают из млечного сока (латекса) дерева гевеи. Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью. Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140°С с серой. В 1932 году С.В.Лебедев разработал способ синтеза синтетического каучука на основе бутадиена, получаемого из спирта. В настоящее время в промышленности выпускают каучук,в котором содержание звеньев изопрена, соединенных в положении 1,4, достигает 99%, тогда как в натуральном каучуке они составляют 98%. 19. Ацетиленовые углеводороды. Гомологический ряд. Изомерия. Номенклатура. Строение тройное связи, sp-гибридизация. Способы получения алкинов: из алканов, оксидов углерода, галогенпроизводных, карбида кальция, алкилированием ацетиленидов. Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен. Гомологический ряд алкинов:
Для них характерны 2 вида изомерии - изомерия положения тройной связи и изомерия углеродного скелета. При названии алкинов нумерацию цепи начинают с того конца, ближе к которому находится тройная связь. Алкины, содержащие до 4 атомов углерода - газы, начиная с углеводородов с 5 атомами углерода - жидкости, начиная с С16Н30 - твердые тела. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют два гибризованных электрона, которые образуют две σ-связи. Одна σ-связь соединяет атомы углерода (sp-sp-связь), вторая - атомы углерода и водорода (sp-s-связь). Эти связи располагаются на одной линии под углом 180о. Две π-связи между атомами углерода образуются негибридизованными р-электронами. Таким образом, тройная связь является комбинацией одной σ- и двух π-связей. Получение 1.Термическим крекингом метана(алкана) или его ближайших гомологов этана и пропана при высокой температуре (1200 -1500о). Основной способ получения ацетилена. 2CH4 => CH≡СН + 3H2 ; 2C2H6 => CH≡СН + 2H2 2. Дегидрогалогенированием дигалогенпроизводных алканов, содержащих галогены у одного или у соседних атомов углерода, путем нагревания со спиртовым раствором щелочи. Этим путем получают не только ацетилен, но и его гомологи. ДЛЯ ПРИМЕРА ХВАТИТ 1 РЕАКЦИИ. CH3-CHCl2 + 2KOH => CH≡CH + 2KCl + 2H2O CH2Cl-CH2Cl + 2KOH => CH≡CH + 2KCl + 2H2O CH2Cl-CHCl-CH3 + 2KOH => CH≡C-CH3 + 2KCl + 2H2O 3. Разложением карбида кальция водой. Это один из основных способов получения ацетилена. В промышленности карбид кальция получают совместным прокаливанием оксида кальция или кальция с углем. СаС2 + Н2О => C2H2 + Ca(OH)2 4. Разложением ацетиленидов кислотами. Cu-C≡С-Cu + 2HCl => СH≡СН + 2СuCl; СаС2 + 2HCl => C2H2 + CaCl2 20. Ацетиленовые углеводороды. Химические свойства: гидрирование, реакции электрофильного присоединения галогенов, галогеноводородов. Реакция Кучерова. Механизм реакций. Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен. Особенностью ацетилена и других алкинов, имеющих концевую тройную связь, является их способность отщеплять протон (кислотные свойства) под действием оснований, вследствие сильной поляризации связи ≡С-Н. Реакция присоединения к алкинам идет ступенчато. На первой стадии идет присоединение к тройной связи с образованием двойной связи, на второй - присоединение к двойной связи с образованием насыщенного соединения. Гидрогенирование (на никелевом или палладиевом катализаторе). СН≡СН + H2 => СH2=CH2 + H2 => СH3-CH3 Галогенирование (например реакция обесцвечивание бромной воды). Реакция присоединения галогеноводорода протекает по электрофильному механизму СН≡СН + Br2 => СHBr=CHBr + Br2 => СHBr2-CHBr2 1,2-дибромэтен 1,1,2,2-тетрабромэтан Гидрогалогенирование При полном гидрогалогенировании алкинов соблюдается правило Марковникова. Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода |
