вопрос Роль белков в питании. 1 вопрос Роль белков в питании, нормы, азотистый баланс, коэффициент изнашивания, физиологический белковый минимум. Белковая недостаточность
 Скачать 1 Mb. Скачать 1 Mb.
|
|
Желтуха новорождённых "физиологическая желтуха", наблюдающаяся в первые дни жизни ребёнка. Причиной повышения концентрации непрямого билирубина в крови служит ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина. У новорождённых снижена активность УДФ-глюкуронилтрансферазы, но и, недостаточно активно происходит синтез второго субстрата реакции конъюгации УДФ-глюкуроната.УДФ-глюкуронилтрансфераза - индуцируемый фермент. Новорождённым с физиологической желтухой вводят лекарственный препарат фенобарбитал. 2. Печёночно-клеточная (печёночная) желтуха Печёночно-клеточная (печёночная) желтуха обусловлена повреждением гепатоцитов и жёлчных капилляров, например, при острых вирусных инфекциях, хроническом и токсических гепатитах. Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические процессы, в частности переводить конъюгированный (прямой) билирубин из клеток в жёлчь против градиента концентрации. Для печёночно-клеточной желтухи характерно то, что вместо преобладающих в норме диглюкуронидов билирубина в поражённой печёночной клетке образуются главным образом моноглюкурониды. В результате деструкции печёночной паренхимы образующийся прямой билирубин частично попадает в большой круг кровообращения, что ведёт к желтухе. Экскреция жёлчи также нарушена. При печёночно-клеточной желтухе повышается концентрация в крови как общего билирубина, так 3. Механическая, или обтурационная (подпечёночная) желтуха Механическая, или обтурационная (подпечёночная), желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной При полной закупорке общего жёлчного протока конъюгированный билирубин в составе желчи не поступает в кишечник, хотя гепатоциты продолжают его вырабатывать. Поскольку билирубин в кишечник не попадает, продуктов его катаболизма уробилиногенов в моче и кале нет. Кал обесцвечен. Так как нормальные пути экскреции билирубина заблокированы, происходит его утечка в кровь, поэтому в крови больных повышена концентрация конъ-югированного билирубина. Растворимый билирубин экскретируется с мочой, придавая ей насыщенный оранжево-коричневый цвет. 21 Обмен железа: источники железа в организме, всасывание, транспорт в крови, депонирование. Нарушение обмена железа: железодефицитная анемия, гемохроматоз, токсичность железа. В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа. В организме взрослого человека содержится 3 - 4 г железа, из которых только около 3,5 мг находится в плазме крови. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки. В нейтральной или щелочной среде железо находится в окисленном состоянии - Fe3+, При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин 22. Активные формы кислорода: супероксидный анион, пероксид водорода, гидроксильный радикал, пероксинитрит. Их образование, причины токсичности. Физиологическая роль АФК. Роль токсических форм кислорода в ПОЛ, окисление белков и нуклеиновых кислот (примеры). Образование активных форм кислорода может происходить: в процессе переноса электронов в митохондриальной дыхательной цепи; в реакциях, которые катализируются оксидазами (образуется перекись водорода), в том числе в свободнорадикальных процессах, совершающихся в фагоцитах; в реакциях микросомального окисления при обезвреживании веществ с участием цитохрома Р-450; в реакциях самопроизвольного (неферментативного) окисления веществ (гемоглобина, ферредоксинов, адреналина и др.); в биологических системах с наличием ионов металлов с переменной валентностью и, прежде всего, железа (свободных атомов, так называемых внегемовых) Значительное число АФК при воспалениях образуется в остром периоде нейтрофильными гранулоцитами крови и макрофагами во время "кислородно-метаболического взрыва лейкоцитов". Поступление в кровь АФК и продуктов ПОЛ способствует выработке и высвобождению провоспалительных цитокинов, медиаторов воспаления, а также медленно реагирующей субстанции анафилаксии и обуславливает резкую активацию системы комплемента по альтернативному пути с высвобождение анафилаксина. В этот период происходит резкая активация калликреин-кининовой системы, а также нарушается нормальное функционирование систем фибринолиза и гемостаза. Интенсивный выброс цитокинов и медиаторов воспаления макрофагами и иммунокомпетентными клетками, активация эндотелиоцитов и рост их тромбогенного потенциала, а также замедление периферического кровотока на фоне избыточной адренэргической стимуляции вызывают во многих органах выраженное в той или иной степени воспаление, не имеющее биологической цели, т.е. защитно-приспособительного значения, что обуславливает вторичное повреждение тканей и разрушение структурно-функциональных единиц органов. Молекула кислорода, присоединяя дополнительный электрон, образует высоко реакцион-носпособный супероксид-радикал (•О2-). Супероксид может порождать вторичные АФК: - присоединяя еще один электрон, образует короткоживущий пероксид-анион (•О22-), который легко связывает протоны и вследствие этого переходит в Н2О2 - присоединяя NO, образует пероксинитрит (образуется при избытке О2-) - переводит трехвалентное железо Fe3+ в двухвалентное Fe2+, которое при взаимо-действии с Н2О2, НClО и липоперекисями образует гидроксильный радикал ОН* или липоксильный радикал LO* (образуется при избытке О2-) - присоединяя 2 протона и электрон, образует перекись кислорода Н2О2 (основной продукт). Физиологическая роль АФК 1 Активные формы кислорода принимают участие в клеточной системе иммунитета, обеспечивая функцию всех фагоцитов в борьбе с инфекцией 2 Регуляция синтеза простагландинов, тромбоксанов и лейкотриенов. 3 Окислительное разрушение ксенобиотиков (чужеродных для организма экзогенных веществ), деструкция собственных поврежденных или аномальных клеток. 4 Регуляция роста, пролиферации и дифференцировки клеток. 5 Участие в обновлении и модификации клеточных мембран. 6 Регуляция апоптоза 23. Обезвреживание активных форм кислорода. Ферментная антиоксидантная система. Схемы реакций, место протекания. Неферментная антиоксидантная система ( витамины А, Е, С), механизм действияЛипидные антиоксиданты" - производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран и предотвращать развитие ПОЛ. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол). Витамин Е(α-токоферол) самый распространённый липофильный антиоксидант, он обеспечивает защиту мембран от СРО. Различают 8 типов токоферолов, но α-токоферол наиболее активен. α-Токоферол отдаёт атом водорода радикалу липида ROO∙, восстанавливает его до гидропероксида (ROOH), а сам превращается в малоактивный свободный радикал, что прерывает ПОЛ: Регенерацию α-токоферола осуществляет витамин С. Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму — токоферолхинон. Витамин Сингибирует СРО с помощью двух различных механизмов: 1). восстанавливает в мембранах токоферолхинон до витамина Е: НО-аскорбат-ОН + α-ТФ-О·→ α-ТФ-ОН + НО-аскорбат-О·(семидегидроаскорбиновая к-та) НО-аскорбат-О·+ α-ТФ-О·→ α-ТФ-ОН + О=аскорбат=О (дегидроаскорбиновая к-та) Регенерация аскорбиновой кислоты идет с участием ферментативных систем: а). В микросомах, с участием комплекса НАДН2-редуктаза-цитохромb5: 2НО-аскорбат-О·+ НАДН2 → 2НО-аскорбат-ОН + НАД+ б). В митохондриях, с участием НАДН2-семидегидроаскорбатредуктазы: 2НО-аскорбат-О·+ НАДН2 → 2НО-аскорбат-ОН + НАД+ в). В цитозоле, с участием НАДФН2-дегидроаскорбатредуктазы: О=аскорбат=О + 2НАДФН2 → НО-аскорбат-ОН + 2НАДФ+ г). В цитозоле, с участием GSH-дегидроаскорбатредуктазы: О=аскорбат=О + 2GSH → НО-аскорбат-ОН +GS-SG 2). взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙и инактивирует их. β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ин-гибирует ПОЛ. Соединения, связывающие железо. Большинство из них, включая такие природные соединения как дипептид карнозин, не просто связывают железо, но, самое главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы, в силу своей полярности, не проникают в гидрофобную зону. Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина. 24 Обезвреживание ксенобиотиков в организме. Микросомальная система окисления, роль цитохрома Р450 (схема процесса, место протекания, регуляция). Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы. В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями. В мембранах ЭР практически всех тканей локализована сисгема микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырёк - микросому, отсюда и название - микросомальное окисление. Эта сисгема обеспечивает первую фазу обезвреживания большинства гидрофобных веществ. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации. Вторая фаза - реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными сисгемами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма Микросомальное окисление Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Сисгема включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу. Цитохром Р450 - гемопротеин, содержит простетическую группу гем и имеет участки связывания для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм. Связывание в активном центре цитохрома Р450 липофильного вещества RH и молекулы кислорода повышает окислительную активность фермента. 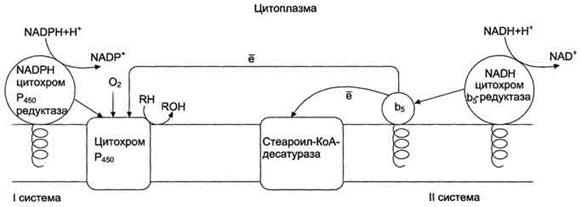 Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось 25. Фаза конъюгации в системе обезвреживания токсических веществ. Виды конъюгации, ферменты (примеры реакций с ФАФС, УДФГК). Конъюгация - вторая фаза обезвреживание веществ, в ходе которой происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков 1. Участие трансфераз в реакциях конъюгации УДФ-глюкуронилтрансферазы. Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе мик-росомального окисления В общем виде: ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ. Сульфотрансферазы. Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам Реакция в общем виде: ROH + ФАФ-SO3H = RO-SO3H + ФАФ. Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений. Глутатионтрансферазы. Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, билирубина, жёлчных кислот, В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цис-теину карбоксильной группой радикала). ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами: путём конъюгации субстрата R с глутатионом (GSH): R + GSH → GSRH, в результате нуклеофильного замещения: RX + GSH → GSR + НХ, восстановления органических пероксидов до спиртов: R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O В реакции: ООН - гидропероксидная группа, GSSG - окисленный глутатион. Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма ГТ своими гидрофобными центрами могут не-ковалентно связывать огромное количество ли-пофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином. ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки. Ацетилтрансферазы, метилтрансферазы Ацетилтрансферазы катализируют реакции конъюгации - переноса ацетильного остатка от ацетил-КоА на азот группы -SO2NH2, например в составе сульфаниламидов. Мембранные и цитоплазматические метилтрансферазы с участием SAM метилируют группы -Р=О, -NH2 и SH-группы ксенобиотиков. Роль эпоксидгидролаз в образовании диолов Во второй фазе обезвреживания (реакции конъюгации) принимают участие и некоторые другие ферменты. Эпоксидгидролаза (эпоксидгидратаза) присоединяет воду к эпоксидам бензола, бензпирена и другим полициклическим углеводородам, образованным в ходе первой фазы обезвреживания, и превращает их в диолы (рис. 12-8). Эпоксиды, образовавшиеся при микросомальном окислении, являются канцерогенами. Они обладают высокой химической активностью и могут участвовать в реакциях неферментативного алкилирования ДНК, РНК, белков Химические модификации этих молекул могут привести к перерождению нормальной клетки в опухолевую. 26. Связывание, транспорт и выведение ксенобиотиков. Роль альбумина, металлотионеина и P-гликопротеина. В плазме крови огромное количество как эндогенных (жирные кислоты, свободный билирубин), так и экзогенных веществ (сульфаниламиды, антибиотики, противосвёртывающие лекарства) связываются и транспортируются альбуминами. (Некоторые вещества, например, жирорастворимые витамины, анаболические стероиды транспортируются липопротеинами). В клетках, особенно печени, многие КСБ (ПАУ, канцерогены, антибиотики) связываются глутатионтрансферазами (лигандинами). Очень важный механизм выведения из клеток гидрофобных ксенобиотиков – функционирование Р-гликопротеина (Р-ГП), который встроен в плазматическую мембрану клеток. Он, являясь транспортной АТФ-азой, работает как «помпа», откачивая из клетки гидрофобные вещества. Металлы (Pb, Hg, Cd, Zn, Pt и др. – тиоловые яды) связываются SH-группами GSH (быстродействующий механизм) и белка металлотионеина, очень богатого остатками цистеина (медленнодействующий механизм). Связанные КСБ неактивны, постепенно они освобождаются, метаболизируются и выводятся. Гидрофильные вещества выводятся из гепатоцитов и других клеток в плазму крови диффузией или активным транспортом, а далее попадают в почки, где происходит фильтрация всех свободных веществ и ионов в клубочках (почечный эпителий, как и эпителий слизистой тонкой кишки, проницаем, в отличие от эпителия мочевого пузыря и желудка). Из лекарств почками выводятся салицилаты, производные атропина, морфина. Это «кооператив печень – почки». Гидрофобные вещества печень выбрасывает в желчь, далее в кишечник и затем они удаляются с калом. Эпителий жёлчных ходов с зазорами, через которые в желчь идут вещества с молекулярной массой более 300: – это гидрофобные анионы (конъюгаты билирубина, билигност) и катионы (новокаинамид, этабромид), неионизированные вещества (сердечные гликозиды) и металлы (Mn, Ca, Hg, Cu, Ag, Zn – часто в комплексе с GSH), затем они выводятся с калом. Это «кооператив печень – кишечник». Транспорт гидрофобных лекарств осуществляет также Р-гликопротеин. Его функция – с затратой АТФ, связывать и удалять из клетки гидрофобные молекулы (ГФБ), в том числе многие противораковые лекарства. 27 Гниение белков в кишечнике, обезвреживание продуктов гниения.Аминокислоты, невсосавшиеся в клетки кишечника, используются микрофлорой толстой кишки в качестве питательных веществ. Ферменты бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения. Этот процесс иногда называют гниением белков в кишечнике. В основе гниения лежат реакции декарбоксилирования и дезаминирования аминокислот. Образование и обезвреживание n-крезола и фенола Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путём разрушения боковых цепей аминокислот микробами Всосавшиеся продукты по воротной вене поступают в печеНb, где обезвреживание фенола и крезола может происходить путём конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфераза Конъюгация глюкуроновых кислот с фенолом и крезолом происходит при участии фермента УДФглюкуронилтрансферазы.Продукты конъюгации хорошо растворимы в воде и выводятся с мочой через почки. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом обнаруживают в моче при увеличении продуктов гниения белков в кишечнике. Образование и обезвреживание индола и скатола В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру. Индол образуется в результате отщепления бактериями боковой цепи, возможно, в виде серина или аланина Скатол и индол обезвреживаются в печени в 2 этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана Обезвреживание бензойной кислоты Синтез гиппуровой кислоты из бензойной кислоты и глицина протекает у человека и большинства животных преимущественно в печени. Скорость этой реакции отражает функциональное состояние печени. В клинической практике используют определение скорости образования и выведения гиппуровой кислоты после введения в организм ксенобиотика бензойной кислоты (бензойнокислого натрия) -проба Квика. 28. Обезвреживание этилового спирта в печени. NAD-зависимая алкогольдегидрогеназа, P450 -зависимая микросомальная этанолокисляющая система, каталаза. Метаболизм и токсичность ацетальдегида. Катаболизм этилового спирта осуществляется главным образом в печени. Превращение этанола в печени осуществляется тремя путями с образованием токсического метаболита - ацетальдегида А. ОКИСЛЕНИЕ ЭТАНОЛА NAD-ЗАВИСИМОЙ АЛКОГОЛЬДЕГИДРОГЕНАЗОЙ Основную роль в метаболизме этанола играет цинксодержащий NAD+-зависимый фермент - алкогольдегидрогеназа, локализующаяся в основном в цитозоле и митохондриях печени (95%). В ходе реакции пpoиcxoдит дегидрирование этанола, образуются ацетальдегид и восстановленный кофермент NADH. Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD+ в клетке. С9H5ОН + NAD+ ↔ CH3CHO + NADH + H+. Фермент алкогольдегидрогеназа - димер, состоящий из идентичных полипептидных цепей,. Существуют 3 изоформы алкогольдегидрогеназы (АДГ): АДГ1, АДГ2, АДГ3, различающиеся по строению протомеров, локализации и активности. При хроническом алкоголизме количество фермента в печени не увеличивается, т.е. он не является индуцируемым ферментом. Б. ОКИСЛЕНИЕ ЭТАНОЛА ПРИ УЧАСТИИ ЦИТОХРОМ Р450-ЗАВИСИМОЙ МИКРОСОМАЛЬНОЙ ЭТАНОЛОКИСЛЯЮЩЕЙ СИСТЕМЫ Цитохром Р450-зависимая микросомальная этанолокисляющая система (МЭОС) локализована в мембране гладкого ЭР гепатоцитов. МЭОС играет незначительную роль в метаболизме небольших количеств алкоголя, но индуцируется этанолом, другими спиртами, лекарствами типа барбитуратов и приобретает существенное значение при злоупотреблении этими веществами. Этот путь окисления этанола происходит при участии одной из изоформ Р450 - изофермента Р450 II Е1. При хроническом алкоголизме окисление этанола ускоряется на 50-70% за счёт гипертрофии ЭР и индукции цитохрома Р450 II Е1. C9H5OH + NADPH + Н+ + О2 → CH3CHO + NADP+ + 2 Н2О. Кроме основной реакции, цитохром Р450 катализирует образование активных форм кислорода (О2-, Н2О2), которые стимулируют ПОЛ в печени и других органах в. окисление этанола каталазой Второстепенную роль в окислении этанола играет каталаза, находящаяся в пероксисомах цитоплазмы и митохондрий клеток печени. Этот фермент расщепляет примерно 2% этанола, но при этом утилизирует пероксид водорода. СН3СН2ОН + Н2О2 → СН3СНО +2 Н2О. г. метаболизм и токсичность ацетальдегида Ацетальдегид, образовавшийся из этанола, окисляется до уксусной кислоты двумя ферментами: FAD-зависимой альдегидоксидазой и NАD+-зависимой ацетальдегиддегидрогеназой (АлДГ). CH3CHO + О2 + Н2О → CH3COOH +Н2О2. Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегид-оксидазы. В ходе реакции образуются уксусная кислота, пероксид водорода и другие активные формы кислорода, что приводит к активации ПОЛ. Другой фермент ацетальдегиддегидрогеназа (АлДГ) окисляет субстрат при участии кофермента NАD+. CH3CHO + Н2О + NAD+ → CH3COOH + + NADH + H+. Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил-КоА-синтетазы. При поступлении больших доз алкоголя (более 2 г/кг) из-за разных скоростей окисления этанола и ацетальдегида в цитозоле резко повышается концентрация последнего. Ацетальдегид - очень реакционно-способное соединение; он неферментативно может ацетилировать SH-, NН2-группы белков и других соединений в клетке и нарушать их функции. В модифицированных (ацетилиро-ванных) белках могут возникать «сшивки», нехарактерные для нативной структуры Ацетилирование белков приводит к снижению синтеза экспортируемых печенью в кровь белков, например альбумина, который, поддерживает осмотическое давление, а также участвует в транспорте многих гидрофобных веществ в крови. Нарушение функций альбумина в сочетании с повреждающим действием ацетальдегида на мембраны сопровождается поступлением в клетки ионов натрия и воды, происходит осмотическое набухание этих клеток и нарушение их функций. Восстановление дигидроксиацетонфосфата, промежуточного метаболита гликолиза и глю-конеогенеза, приводит к снижению скорости глюконеогенеза. Образование глицерол-3-фосфата повышает вероятность синтеза жира в печени. В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу Происходит нарушение структуры внутренней мембраны митохондрий, вызванное мембранотропным действием этилового спирта и повреждающим действием ацетальдегида на мембраны. Ацетальдегид опосредованно активирует ПОЛ, так как связывая SH-группы глутатиона, он снижает количество активного (восстановленного) глутатиона в клетке. Hакопление свободных радикалов приводит к активации ПОЛ мембран и нарушению структуры липидного бислоя. При хроническом алкоголизме снижение синтеза фосфолипидов и белков в печени, в том числе и апобелков, участвующих в формировании ЛПОHП, вызывает внутриклеточное накопление ТАГ и ожирение печени. Повышение в крови концентрации лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации. При повышении концентрации ацетальдегида и NADH в клетках печени образуется этанол. Этанол - растворяется в липидном бислое мембран и нарушает их функции. Это негативно отражается на трансмембранном переносе веществ, межклеточных контактах, взаимодействиях рецепторов клетки с сигнальными молекулами. Этанол может проходить через мембраны в межклеточное пространство и кровь и далее в любую клетку организма. |
