153. Комплекс Гольжди. Строение. Функция. Комплекс Гольджи
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
|
153. Комплекс Гольжди. Строение. Функция. Комплекс Гольджи расположен около ядра и часто вблизи центриоли, образован стопкой из 3-10 уплощённых и слегка изогнутых цистерн с расширенными концами (рис. 2-18). а. Структура. Цистерны комплекса Гольджи образуют три основных компартмента: цис-сторона, транс-сторона, промежуточный компартмент. С комплексом Гольджи тесно связан и всегда рассматривается вместе ещё один клеточный компартмент — транс-сеть Гольджи. (1) Цис-сторона (формирующаяся) более осмиофильная, включает цистерны, обра щённые к расширенным элементам гранулярной эндоплазматической сети, а так же небольшие транспортные пузырьки. (2) Транс-сторона (зрелая) образована цистернами, обращёнными к вакуолям и секреторным гранулам. (3) Промежуточный компартмент включает небольшое количество цистерн меж ду цис- и транс-стороной. (4) Транс-сеть Гольджи лежит на небольшом расстоянии от краевой цистерны транс-стороны и участвует в образовании лизосом и сортировке белков для различ ных транспортных пузырьков. Функции. (1) Модификация секреторного продукта. Ферменты комплекса Гольджи гликозилируют белки и липиды; образующиеся здесь гликопротеины, протеогликаны, гликолипиды и сульфатированные гликозаминогликаны предназначены для последующей секреции. (2) Концентрирование секреторных продуктов происходит в конденсирующих ваку олях, расположенных на транс-стороне. (3) Упаковка секреторного продукта, образование участвующих в экзоцитозе секре торных гранул. 154. Лизосомы. Происхождение, функция. Лизосомы — округлые пузырьки, окружённые мембраной; их размеры и электронная плотность значительно варьируют. Содержимое. Более 50 ферментов: рибонуклеазы, дезоксирибонуклеазы, катепсины, сульфатазы, р-глюкуронидазы, фосфолипазы, гликозидазы, липазы и другие. Лизосомные ферменты наиболее активны в кислой среде (pH—5,0), для поддержания кото рой в мембрану лизосомы встроен протонный насос (Н+,К+-АТФаза). Функция. Лизосомы участвуют во внутриклеточном пищеварении. Варианты учас тия лизосом в переваривании материала внутриклеточных компонентов или частиц, различными путями попавших в клетку, представ лены на рис. При нарушении функции лизосом развиваются лизосомные болезни накопления. Болезни накопления характеризуются неспособностью ферментов лизосом (вслед ствие дефектов их синтеза или структуры) расщеплять метаболиты. 155. Роль протеасом в деградации белков. Протеасома —очень крупная мультисубъединичная протеаза, присутствующая в клетках эукариот. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Основная функция протеасомы — протеолитическая деградация ненужных и повреждённых белков до коротких пептидов, которые затем могут быть расщеплены до отдельных аминокислот. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка. Протеасомальная деградация белка важна для протекания многих клеточных процессов, включая клеточный цикл, регуляцию экспрессии генов и ответ на окислительный стресс. 156. Макромолекулярные комплексы цитоплазмы: протеосомы, апоптосомы. Макромолекулярные комплексы цитоплазмы: протеосомы, апоптосомы. Протеосомы - крупные белковые комплексы, которые гидролизуют белки, связанные с убиквитином (белок, который играет роль «ярлыка» для других молекул белков), регулируя концентрацию определенных белков в клетке. Апоптосома — крупная четвертичная белковая структура, формирующаяся внутри клетки в процессе апоптоза. Сборка апоптосомы запускается высвобождением цитохрома c измитохондрий в ответ на внутренние либо внешние про-апоптозные стимулы. Апоптосома активирует инициаторные каспазы, запускающие каскад апоптозных реакций. 157. Апоптоз. Сигнальные механизмы апоптоза. Апоптоз — запрограммированная гибель клеток — естественный процесс, предназначенный для элиминации поврежденных клеток либо клеток, «не нужных» по программе морфогенеза и индивидуального развития организма. Важной особенностью апоптоза, отличающей его от некроза, является отсутствие воспалительных реакций соседних клеток на продукты распада, так как деградирующая клетка сохраняет целостность мембраны до конечных стадий процесса, а затем подвергается фагоцитозу. Характерные признаки: утрата межклеточных контактов, разрушение цитоскелета, конденсация хроматина, фрагментация ядер, деградация ДНК. Инициация апоптоза может происходить по средством внеклеточных и внутриклеточных факторов. Внеклеточными сигналами могут быть молекулы смерти связывающиеся с рецепторами смерти. В результате собирается смерть-индуцирующий сигнальный комплекс, который контролирует каспазную реакцию и деградацию ДНК. Внутриклеточные сигналы часто происходят из ядра. Синтезируются проапоптозные белки, под действием которых из митохондрий выходят проапоптозные факторы, участвующие в сборке апоптосом и последующей активации каспазного каскада. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути трансдукции (передачи) сигнала апоптоза: рецептор-зависимый (рецепторный) сигнальный путь с участием рецепторов гибели клетки и митохондриальный путь. 158. Индуцированные плюрипотентные клетки. Механизм получения и применение в клеточной терапии. Индуцированные плюрипотентные стволовые клетки - вид плюрипотентных стволовых клеток, искусственно полученных из неплюрипотентных клеток, обычно из взрослых соматических клеток, путем "вынужденной" индукции (процесс запуска транскрипции гена или белка вследствие действия определенного фактора-индуктора) определенных генов. Этот процесс осуществляется путем трансфекции (процесс переноса генетического материала в клетку с помощью вирусных векторов) определенных генов стволовых клеток в неплюрипотентную клетку человека, такую как фибробласт, с помощью вирусных векторов (ретровирусов). Эта техника должна быть тщательно контролируемой и изученной перед ее применением у человека. В исследованиях на животных вирусы, которые применяются для введения факторов перепрограммирования, иногда вызывали раковые опухоли. В настоящее время ученые разрабатывают методы без использования вирусов. . Иными словами, ИПСК - это взрослые клетки, которые генетически перепрограммированы в эмбрионально-подобные клетки путем экспрессии генов и факторов, важных для определения свойств эмбриональных стволовых клеток. Схема получения индуцированных плюлрипотентных клеток. (1)изолирование и культивирование донорных клеток (2) - перенос ассоциированных со стволовой клеткой генов в донорные клетки с помощью вирусных векторов. Красные клетки - те, в которых происходит экспрессия экзогенных генов. (3) - сбор и культивирование клеток соответственно культуре эмбриональных стволовых клеток, используя митотически неактивированные фидерные клетки (светло-серые, клетки, используемые в культуре для опоры и питания ПСК, фидерные клетки обработаны таким образом, чтобы они не делились) (4) - небольшое количество клеток становятся iPS-клетками (Induced Pluripotent Stem Cells) и генерируют подобные эмбриональным колонии стволовых клеток. Применение: 1)Этот подход дает возможность использовать собственные ткани пациента и, таким образом, решает проблему отторжения пересаженных тканей, избавляя от необходимости принимать иммунодепрессанты. Это значит, что в скором времени можно будет заменить поврежденную или пораженную ткань человека на точно такую же ткань этого пациента, только здоровую. Это решит проблему терапии множества болезней. 2) При должном уровне диагностики будет не сложно выявлять возрастные нарушения работы органов и уже на самом начальном этапе исправлять эти нарушения с помощью клеточной терапии. Таким образом, можно поддерживать организм в "молодом" состоянии на протяжении очень длительного времени, что фактически отменияет старение. 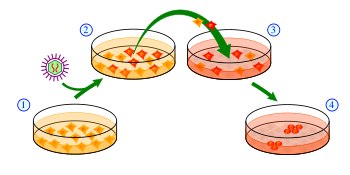 159. Эмбриональная стволовая клетка. Эмбриональные стволовые клетки (ЭСК) — тип плюрипотентных клеток млекопитающих, поддерживаемых в культуре, которые получают из внутренней клеточной массы бластоцисты на ранней стадии развития эмбриона. Эмбрион человека достигает стадии бластоцисты спустя 5-6 дней после оплодотворения, внутренняя клеточная масса бластоцисты человека состоит из 50-150 клеток. Основные свойства ЭСК: 1)Эмбриональные стволовые клетки являются плюрипотентными. Это означает, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму. 2)способность к длительному самовозобновлению без старения 160. Митоз. Кариокинез и цитокинез. 1) пресинтетическая (G1) (2n2c, где n-число хромосом, c- число молекул). Идет сразу после деления клетки. Синтеза ДНК еще не происходит. Клетка активно растет в размерах, запасает вещества, необходимые для деления: белки (гистоны, структурные белки, ферменты), РНК, молекулы АТФ. Происходит деление митохондрий и хлоропластов (т. е. структур, способных к ауторепродукции). Восстанавливаются черты организации интерфазной клетки после предшествующего деления; 2) синтетическая (S) (2n4c). Происходит удвоение генетического материала путем репликации ДНК. Она происходит полуконсервативным способом, когда двойная спираль молекулы ДНК расходится на две цепи и на каждой из них синтезируется комплементарная цепочка. В итоге образуются две идентичные двойные спирали ДНК, каждая из которых состоит из одной новой и старой цепи ДНК. Количество наследственного материала удваивается. Кроме этого, продолжается синтез РНК и белков. Также репликации подвергается небольшая часть митохонд-риальной ДНК (основная же ее часть реплицируется в G2 период); 3) постсинтетическая (G2) (2n4c). ДНК уже не синтезируется, но происходит исправление недочетов, допущенных при синтезе ее в S период (репарация). Также накапливаются энергия и питательные вещества, продолжается синтез РНК и белков (преимущественно ядерных). В профазе увеличивается объем ядра, и вследствие спирализации хроматина формируются хромосомы. К концу профазы видно, что каждая хромосома состоит из двух хроматид. Постепенно растворяются ядрышки и ядерная оболочка, и хромосомы оказываются беспорядочно расположенными в цитоплазме клетки. Центриоли расходятся к полюсам клетки. Формируется ахроматиновое веретено деления, часть нитей которого идет от полюса к полюсу, а часть — прикрепляется к центромерам хромосом. Содержание генетического материала в клетке остается неизменным (2n4c). Прометафаза начинается с быстрого распада ядерной оболочки на мелкие фрагменты, неотличимые от фрагментов цитоплазматического ретикулума. Расположенное около ядра митотическое веретено может теперь проникнуть в ядерную область. В хромосомах с каждой стороны центромеры образуются особые структуры - кинетохоры . Обычно у каждой хромосомы оказывается по одной кинетохорной нити , связанной с каждым из полюсов. В результате этого возникают две противоположно направленные силы, которые и приводят хромосому в экваториальную плоскость. В метафазе хромосомы достигают максимальной спирализации и располагаются упорядоченно на экваторе клетки, поэтому их подсчет и изучение проводят в этот период. Содержание генетического материала не изменяется (2n4c). В анафазе каждая хромосома «расщепляется» на две хроматиды, которые с этого момента называются дочерними хромосомами. Нити веретена, прикрепленные к центромерам, сокращаются и тянут хроматиды (дочерние хромосомы) к противоположным полюсам клетки. Содержание генетического материала в клетке у каждого полюса представлено диплоидным набором хромосом, но каждая хромосома содержит одну хроматиду (4n4c). В телофазе расположившиеся у полюсов хромосомы деспирализуются и становятся плохо видимыми. Вокруг хромосом у каждого полюса из мембранных структур цитоплазмы формируется ядерная оболочка, в ядрах образуются ядрышки. Разрушается веретено деления. Одновременно идет деление цитоплазмы. Дочерние клетки имеют диплоидный набор хромосом, каждая из которых состоит из одной хроматиды (2n2c). 161. Ген p53 и опухолевая трансформация клеток. Белок р53 - Один из важнейших регуляторов клеточного цикла. Специфически Связывается с ДНК и Активирует экспрессию генов, Блокирующих цикл в контрольной точке G1 - M. При неблагоприятной информации о состоянии генома(Активация онкогенов, повреждения ДНК) р53 Блокирует клеточный цикл, пока нарушения не будут устранены. В повреждённых клетках содержание р53 возрастает. Это дает клеткам шансы восстановить ДНК путём Блокирования клеточного цикла. При серьезных нарушениях ДНК р53 Инициирует самоубийство клетки - апоптоз. Вследствие мутации гена, кодирующего белок р53, И как следствие отсутствия сдерживающего фактора клетки с повреждённым геномом, продолжают активно размножаться, что приводит опухолевому росту. 162. Центросома. Строение. Функции. Центросома (клеточный центр)– немембранная структура, которая обычно находится рядом с ядром и играет важную роль в транспортировке хромосом при делении ядра клетки. Она включает 2 центриоли и перицентриольный матрикс. Имеет форму цилиндра диаметром 150 нм, длиной 500 нм, стенка состоит из 9 трпилетов микротрубочек. Растущие микротрубочк (-) концами связаны с центросомой, а их + концы в виде лучей направлены в цитоплазму. Функции: 1)При митозе и мейозе принимает участие в образовании веретена деления. 2)В интерфазу принимает участие в формировании микротрубочек – цитоскелета клетки; 3)При участии клеточного центра формируются реснички и жгутики. 163. Митохондрии. Строение, функция. Митохондрии – преобразователи энергии и ее поставщики для обеспечения клеточных функций – занимают значительную часть цитоплазмы клеток и сосредоточены в местах высокого потребления АТФ (нейроны, клетки мышц). Митохондрии имеют собственный геном и выполняют множество функций. Митохондрии предположительно произошли от аэробных симбионтов, проникших в анаэробную эукариотическую клетку путем эндоцитоза и начавших участвовать в ее окислительных процессах. В связи с этим митохондрии имеют собственный геном, мРНК, тРНК, рРНК, но большинство белков митохондрий кодирует ядерная ДНК. Митохондрии чаще имеют форму цилиндра. У них 2 мембраны – внутренняя и наружная. Внутренняя образует кристы. Между наружной и внутренней мембраной находится межмембранное пространство. Внемембранный объем митохондрии – матрикс. Наружная мембрана проницаема для многих мелких молекул. В межмембранном пространстве накапливаются ионы Н, выкачиваемые из матрикса, что создает протонный градиент концентрации по обе стороны внутренней мембраны. Внутренняя мембрана избирательно проницпема, содержит транспортные системы для переноса веществ. Митохондрии выполняют в клетке множество функций: окисление в цикле Кребса, транспорт электронов, хемиосмотическое сопряжение, фосфорилирование АДФ, сопряжение окисления и фосфорилирования, функцию контроля внутриклеточной концентрации кальция, синтез белков, образование тепла. Участвует в апоптозе. 164. Протоонкогенны и онкосупрессоры в регуляции клеточного цикла. Протоонкогенны кодируют белки, стимулирующие клеточный цикл (например, ras, erbb2). В случае мутации становятся онкогенами.
|
