Ксенобиология ответы. 6. Реакции биотрансформации неорганических ксенобиотиков
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
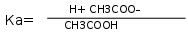 | |
Иногда выражение «константа диссоциации» используют вместо константы ионизации. Последнее название точнее, т. к. многие комплексы, например системы ферментов, «диссоциируют» на составляющие, а мицеллы – на мономеры. Устанавливающееся при этом равновесие можно выразить через константы диссоциации, но эти константы не являются константами ионизации.
Состояние ионизации слабых оснований также может быть охарактеризовано константами кислотности. Например, аммиак – слабое основание, которое может присоединить ионы водорода с образованием ионов аммония. В таком случае ион NH4+ можно рассматривать как слабую кислоту, ионизованную в воде на ионы водорода (Н+) и молекулы аммиака (NH3). Тогда константа ионизации может быть записана в таком виде:
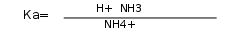 | |
Приведенные уравнения показывают, что кислота отщепляет ионы водорода, а основание можно характеризовать количественно одной величиной – сродством к иону водорода. Это позволяет применить константы кислотности для описания процесса ионизации как для кислот, так и для оснований.
Обычно, величины констант ионизации слишком малы, поэтому значительно удобнее при рассчетах использовать их отрицательными логарифмами
рКа= – lgКа
Очевидно, что рКа дают возможность легко сравнивать силу разных кислот (или оснований). Чем сильнее кислота, тем ниже ее рКа (чем сильнее основание, тем выше ее рКа).
Введение в молекулу электрондонорных групп (например, СН3) увеличивает ее основность и уменьшает кислотность, а электронакцепторных (например, NH2) – ослабляет основность и усиливает кислотность.
Степень ионизации любого вещества можно рассчитать при известных величинах рН раствора и рКа вещества с помощью выражений:
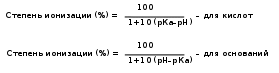 | |
Э
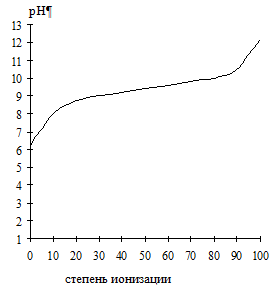 ти уравнения показывают, что степень ионизации данной кислоты (основания) зависит от рН. Эта зависимость не является линейной, а выражается сигмовидной кривой.
ти уравнения показывают, что степень ионизации данной кислоты (основания) зависит от рН. Эта зависимость не является линейной, а выражается сигмовидной кривой. Анализ этой кривой показывает, что небольшое изменение рН в определенной области может вызывать сильные изменения ионизации, особенно если значение рН раствора близко к величине рКа исследуемого вещества.
Значение рН, при котором кислота или основание ионизированы наполовину, эквивалентно их рКа. Если рН на одну единицу ниже, чем рКа, то кислота ионизирована на 9 %, а основание – на 91 %.
Связана ли степень ионизации с биологическими эффектами, вызываемыми ксенобиотиками, т. е. с биологической активностью ксенобиотиков?
Действительно, оказалось, что в зависимости от степени ионизации ксенобиотики обладают различной биологической активностью и их можно разделить на три большие группы:
Ксенобиотики, обладающие большей биологической активностью в ионизированном состоянии.
Ксенобиотики, более активные в неионизированном состоянии.
Ксенобиотики, проявляющие биологическое действие в виде ионов и неионизированных молекул.
51. Характеристика процессов взаимодействия наноматериалов с окружающей средой. Пути миграции в окружающей среде.
Взаимодействия наноматериалов с окружающей средой:
- образование и коагуляция золей; - растворение; - сорбция (поглощение); - разложение.
Пути миграции:
Подтвержденные экспериментально:
осаждение на поверхность, вмешательство человека – попадание в почву и водоносные слои – вторичный подъем
органосорбция – хемодеградация
Предполагаемые:
Из воздуха, почвы и воды в процессе питания и дыхания попадают в организм человека.
Оценка безопасности наноматериалов:
обнаружение, идентификация и количественное определения наноматериалов в объектах окружающей среды, пищевых продуктах и биологических средах;
изучение взаимодействия наноматериалов с липидами, белками, нуклеиновыми кислотами (ДНК, РНК, клеточные мембраны, рибосомы, ферменты, цитохромы Р-450) в системах in vitro;
исследование механизмов проникновения наноматериалов через биомембраны и связывания с мембранными рецепторами в системе in vitro; - выявление изменения характеристик наночастиц в составе модельных систем, воспроизводящих различные среды организма (желудочное и кишечное содержимое, кровь, лимфа, желчь, моча и др.);
определение параметров острой, подострой и хронической токсичности, органотоксичности (нейро-, гепато-, кардио-, иммуно-, нефротоксичность и др.) и отдаленных эффектов (мутагенность, эмбриотоксичность, тератогенность, канцерогенность), а также распределения нано- материалов по органам и тканям;
определение параметров I и II фазы метаболизма ксенобиотиков и системы антиоксидантной защиты;
изучение влияния наноматериалов на экспрессию генов, генотоксичность,
апоптоз, протеомный и метаболомный профили, потенциальнуюаллергенность;
- исследование влияния в моделях in vitro выживаемости пробиотических
микроорганизмов нормальной микрофлоры желудочно-кишечного
тракта в присутствии наноматериалов, процессов всасывания наноматериалов в желудочно-кишечном тракте на моделях in situ и in vivo
и определение влияния наноматериалов на микробиоценоз желудочно-кишечного тракта.
Индекс токсичности (ИТ) – характеризует токсичность наноматериала по отношению к нативному веществу.
Пример. ЛД50 наночастиц меди – 413 мг/кг
ЛД50 макрочастиц меди – 5 000 мг/кг
ИТ = 12 (делим)
Индекс опасности – отношение коэффициента кумуляции
нативного вещества к коэффициенту кумуляции наноматериала
Косвенное определение ПДК наночастиц (ИТ 10):
ПДКв.р.з. меди = 0,1 мг/м3 ; ПДКв.р.з. наночастиц меди = 0,01 мг/м3
Нанотехнологии в системы защиты окружающей среды:
- нанодатчики;
- фильтры очистки воздушной и водной среды;
- наноматериалы для очистки окружающей среды от загрязнения.
52. Роль природы превращений и процессов перемещения ксенобиотиков для функционального состояния экосистем.
Нарушение нормального функционирования экосистем, связанно с наличием биодеградабельных ксенобиотиков и обусловлено: природой превращений и аккумуляцией ксенобиотиков; опасностью воздействия больших доз; воздействием малых (сублетальных) концентраций. Способность ксенобиотиков распространяться в окружающей среде создает проблемы, связанные с длительностью их сохранения в природных условиях. Сведения о скорости разрушения веществ биологическими системами являются необходимыми. Особенно важны эти сведения для органических ксенобиотиков. Легко разрушаемые соединения большей частью не считаются потенциально опасными для окружающей среды. Тем не менее необходимо проводить сравнительный анализ и знать способность различных организмов разрушать то или иное вещество. Данное вещество может легко разрушаться в одной среде, но может быть устойчивым в других условиях.
Наряду с определением скорости разрушения вещества важно изучить, какие типы веществ образуются в процессе разрушения. Если органическое вещество разрушается полностью с образованием углерода и воды, как это происходит во многих микробных системах, такого вопроса не возникает.
При оценке экологической опасности необходимо учитывать природу и процессы метаболических превращений. Важно помнить тот факт, что почти любой органический ксенобиотик может метаболизироваться в каком-либо организме, и часто в результате довольно сложных последовательностей реакций образуются многочисленные мета-болиты. Степень накопления метаболитов в организме зависит от относительных скоростей их образования и последующего метаболизирования и (или) вывода из организма. Метаболит накапливается в организме, если он вырабатывается с относительно высокой скоростью, а по-следующие метаболические реакции идут с меньшей скоростью или скорость вывода его из организма мала по сравнению со скоростью образования.
Природу метаболических превращений следует учитывать при разработке аналитических методов. Например, при определении остатков 2,4-Д в обработанных этим гербицидом растениях надо учитывать следующие факты. Вещество можно экстрагировать в виде соли в водном растворе, затем снизить рН, что-бы перевести кислоту в неионизированную форму, и в такой форме экс-трагировать неполярным растворителем, а затем очистить и проанали-зировать. В растениях обычно протекают реакции конъюгирования, и 2,4-Д может быть связан с остатками некоторых углеводов. Образованное соединение весьма полярно, и если его проэкстрагировать и подкислить, то извлечь его неполярным растворителем невозможно. Если этот факт не учитывать, то ксенобиотик можно вообще не обнаружить. Поэтому до экстракции вещества необходимо определить возможность образования конъюгатов и разрушить их. В противном случае можно получить неадекватные данные.
