все вопросы бх. А) Химическая природа ферментов Ферменты(энзимы) биологические катализаторы
 Скачать 6.2 Mb. Скачать 6.2 Mb.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атеросклероз – это заболевание кровеносных сосудов, их изменения вследствие вредных воздействий, таких как никотин, повышенный уровень холестерина, а также старческий износ сосудов. Сосуды постепенно теряют гибкость, становятся твёрдыми из-за оседания жиров и извести на стенках, лишаются упругости и, как следствие, сужаются, что, как известно, снижет доступ крови к органам. В конце концов сосуд может полностью закрыться. А когда этому сопутствует нарушение свертываемости крови, то появляется склонность к тромбозам и возникают ишемические повреждения органов. Атеросклероз считается одним из самых опасных заболеваний, которое ведёт к смерти. Распознается атеросклероз чаще всего, когда появляются проблемы с кровоснабжением сердца, конечностей и мозга, т. е. заболевание диагностируют уже в последних стадиях. Атеросклероз является одной из основных причин развития сердечно-сосудистых заболеваний, ишемической болезни сердца и инфаркта миокарда. Процент людей с атеросклерозом повышается в зависимости от их возраста, т. е. эта болезнь характерна для людей в возрасте. Поэтому врачи называют её старческой болезнью, но с каждым годом она молодеет, что связано с образом жизни. |
Причинами развития атеросклероза являются высокое давление, курение, сахарный диабет, высокий уровень холестерина. Но основная причина атеросклероза лежит в нарушении обмена холестерина. Формирование атеросклероза – это естественный процесс, который начинается примерно с 10–15 лет. С возрастом он может замедляться, а может ускоряться. Выделяют следующие факторы риска развития атеросклероза:
Пол. Мужчины более подвержены развитию атеросклероза, чем женщины. Первые признаки данной патологии могут проявляться уже с 45 лет а то и раньше, у женщин – с 55 лет. Возможно, это связано с более активным участием в обмене холестерина эстрогенов и липопротеидов низкой и очень низкой плотности.
Возраст. Это естественный фактор риска. С возрастом атеросклеротические проявления усугубляются.
Наследственность. Безусловно, это одна из причин появления атеросклероза. Атеросклероз – многопричинное заболевание. Поэтому уровень гормонального фона, наследственная дислипопротеидемия (нарушение липидного профиля плазмы), активность иммунной системы играют важные роли в ускорении или замедлении развития атеросклероза.
Вредные привычки. Курение – это яд для организма. Данная привычка является еще одной причиной развития атеросклероза. Хотите иметь здоровые сосуды – бросайте курить! Что же касается алкоголя, то здесь имеется интересная зависимость: употребление небольших доз алкоголя – около 50 г водки, 100 г вина или 0,5 л пива ежедневно – являются прекрасной профилактикой атеросклероза. Правда, такая же доза способствует и развитию цирроза печении. Так что одно лечим – другое калечим. К тому же, большие дозы алкоголя ускоряют развитие атеросклероза.
Лишний вес. Этот фактор очень негативно влияет на атеросклероз. Лишний вес может привести к сахарному диабету, а эта патология является очень злокачественной для развития атеросклероза.
Питание. Питание является основным фактором риска. Прием пищи – очень важный физиологический процесс в нашей жизни. От того, насколько полезна наша пища, насколько содержится в ней необходимых нам химических соединений, будет зависеть наше дальнейшее здоровье. Мало кто знает, что ни одна диета, кроме лечебных, не одобрена всемирным советом гигиены питания. Питаться нужно рационально и адекватно своим потребностям и энергетическим затратам.
| К симптомам атеросклероза относят: часто холодные конечности синюшно-белого цвета, частые проблемы с сердцем, снижение памяти, нарушение кровоснабжения, плохую концентрацию внимания, больной становится раздражительным и чувствует себя уставшим. Более остальных людей атеросклерозу подвержены люди с высоким кровяным давлением, а также со слабыми почками и страдающие диабетом. При появлении первых признаков атеросклероза необходимо сразу обращаться к врачу, так как на ранней стадии процесс атеросклероза можно остановить изменением образа жизни. Кроме атеросклероза сосудов сердца, существуют атеросклероз сосудов мозга, артерий почек, артерий ног, мезентериальных артерий. Атеросклероз сосудов мозга ведет к ишемии мозга и ухудшению его функций, что проявляется в ослаблении памяти, снижении интеллектуальных способностей, изменении психики. Атеросклероз артерий почек приводит к ишемии почек и артериальной гипертензии. Его диагностика требует специализированных обследований. Признаками атеросклероза артерий ног являются похолодание и зябь ног, боли в икрах, которые возникают при ходьбе. Также возможно появление трофических язв и развитие гангрены. Для атеросклероза мезентериальных артерий характерны нарушения функций желудочно-кишечного тракта и развитие некрозов инвагинации кишечника. Они проявляются как боли в верхней части живота. |
40. ПОНЯТИЕ И РАЗНОВИДНОСТИ АЗОТИСТОГО БАЛАНСА.
Азотистый баланс – соотношение между поступающим в организм и выводимым из организма азотом. Различают три вида азотистого баланса: азотистое равновесие, положительный азотистый баланс, отрицательный азотистый баланс
При положительном азотистом балансе поступление азота преобладает над его выделением. В физиологических условиях встречается истинный положительный азотистый баланс (беременность, лактация, детский возраст). Для детей в возрасте 1 года жизни он составляет +30%, в 4 года +25%, в подростковом возрасте +14%. При заболевании почек возможен ложный положительный азотистый баланс, при котором происходит задержка в организме конечных продуктов азотистого обмена.
При отрицательном азотистом балансе преобладает выделение азота над его поступлением. Это состояние возможно при таких заболеваниях как туберкулез, ревматизм, онкологические заболевания.
Азотистое равновесие характерно для здоровых взрослых людей, у которых поступление азота равно его выделению.
Азотистый обмен характеризуется коэффициентом изнашивания, под которым понимают то количество белка, которое теряется из организма в условиях полного белкового голодания. Для взрослого человека он составляет 53 мг N/ кг (или 24 г белка/сутки). У новорожденных коэффициент изнашивания выше и составляет 120 мг N на 1 кг массы тела. Азотистое равновесие обеспечивается белковым питанием.
Белковый рацион характеризуется опредёленными количественными и качественными критериями.
Количественные критерии белкового питания
Белковый минимум – то количество белка, которое обеспечивает азотистое равновесие при условии, что все энергетические затраты обеспечиваются углеводами и жирами. Он составляет 40-45 г/сутки. При длительном использовании белкового минимума страдают иммунные процессы, процессы кроветворения, репродуктивная система. Поэтому для взрослых людей необходим белковый оптимум - то количество белка, которое обеспечивает выполнение всех его функций без ущерба для здоровья. Он составляет 100 – 120 г/сутки.
Для детей норма потребления в настоящее время пересматривается в сторону её снижения. Для новорожденного потребность в белках составляет около 2 г/кг, к концу первого года снижается при естественном вскармливании до 1 г/кг, при искусственном вскармливании остаётся в пределах 1,5 – 2 г/кг
Качественные критерии белкового питания
Более ценные для организма белки должны отвечать следующим требованиям:
· содержать набор всех незаменимых аминокислот (валин, лейцин, изолейцин, треонин, метионин, лизин, аргинин, гистидин, триптофан, фенилаланин);
· соотношение между аминокислотами должно быть близким к соотношению их в тканевых белках;
· хорошо перевариваться в желудочно-кишечном тракте.
Этим требованиям в большей степени отвечают белки животного происхождения. Для новорожденных все белки должны быть полноценными (белки грудного молока). В возрасте 3-4 лет около 70-75% должно приходиться на полноценные белки. Для взрослых людей их доля должна составлять около 50%.
41. ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ БЕЛКОВ. НОРМАЛЬНЫЕ И ПАТОЛОГИЧЕСКИЕ КОМПОНЕНТЫ ЖЕЛУДОЧНОГО СОКА.
Пищеварения белков - это ферментативный гидролиз (протеолиз) пептидных связей в молекулах белков, в результате которого образуются свободные аминокислоты. Пищеварения белков происходит с помощью гидролаз, которые называются протеолитическими ферментами (протеазами или пептидазами). Они образуются в неактивной форме (проферменты или зимогена) и активируются путем частичного протеолиза, то есть путем гидролиза одного пептидной связи с последующимотщеплением ингибирующего N-концевого пептида. Активный фермент, образовавшийся в результате частичного протеолиза, может действовать на собственный профермент и переводить его в активное состояние, то есть осуществлять аутокатализ (сам себя активирует).
Место синтеза проферментов (слизистая оболочка желудка, поджелудочная железа) и место их активации (полость желудка, полость тонкой кишки пространственно отделены. Это необходимо для защиты секреторных клеток желудка и поджелудочной железы от аутопереваривания
Преждевременная активация проферментов в секреторных клетках происходит при язвенной болезни, остром панкреатите (активируются пепсин, трипсин,
соответственно). В норме в поджелудочной железе не происходит активация зимогенов благодаря наличию ингибитора трипсина, который образует с ферментом очень прочный комплекс. В желудке и кишечнике внутрених повехни покрыты муцинами - гликопротеинами слизи.
Муцины защищают эпителий желудочно-кишечного тракта от негативного воздействияпротеолитических ферментов.
Согласно местом действия на молекулы субстрата протеолитические ферменты распределяются на экзопептидаза и эндопептидазы.
Протеазы, или пептидазы, которые гидролизуют пептидную связь в конечной
аминокислоте, называются экзопептидаза.К ним относятся аминопептидазы, которая отщепляет последнюю аминокислоту с N-концабелковой молекулы, и карбоксипептидазы, которая гидролизует пептидную связь с С-конца молекулы белка, а также ди- и трипептидазы, расщепляющие дипептиды и трипептиды.
Пептидные связи, расположенные на расстоянии от концов молекулы белка, гидролизуют эндопептидазы: пепсин, трипсин, химотрипсин, эластаза.В зависимости от наличии в их активных центрах аминокислот серина, цистеина и других, различают сериновые протеазы, цистеиновые протеазы и другие.
Пептидазы характеризуются относительной специфичностью, то есть они расщепляют все
белки, но каждый из этих ферментов преимущественно гидролизует пептидные связи только между
определенными аминокислотами:
пепсин гидролизует пептидные связи, образованные карбосильнимы группами ароматических
аминокислот (фенилаланина и тирозина),а также лейцина и глутамата;
трипсин розщепляюе связи, образованные карбоксильными группами аргинина и лизина;
химотрипсин - фенилаланина, тирозина и триптофана;
эластаза - глицина, аланина, серина, пролина
Протеолитические ферменты используются как лекарственные средства (ацидинпепсин,фестал, панкреатин) при нарушении секреции желудочного сока, при воспалении поджелудочной железы. Кроме того, протеазы используются для обработки гнойных ран (Расщепляют белки, содержащиеся в гнойной жидкости). У шлунку діє фермент пепсин, котрий синтезується у основних клітиних слизової оболонки шлунку у вигляді неактивного проферменту пепсиногену. Цей зимоген активується шляхом часткового протеолізу за допомогою соляної кислоти (повільно), а далі – за механізмом аутокаталіза (швидко). Пепсин – це фермент з відносною специфічністю. Він гідролізує пептидні зв’язки, утворені карбоксильними групами ароматичних амінокислот (фенілаланіну, тирозину).
Нарушение переваривания белков в желудке:
Гиперхлоргидрия -повышенная продукция НСl.
Гипохлоргидрия - уменьшенная продукция НСl.
Ахиллия - отсутствие в желудочном соке НСl и пепсина.
(Полная ахилия или тотальная резекция желудка может вызвать злокачественную пернициозной
анемию, так как отсутствует внутренний фактор Касла - гастромукопротеин, необходимдля всасывания витамина В12).
Компоненты желудочного сока в норме и при патологических состояниях
| Состояние | рН | Кислотность (ТЕ) | Пепсин | Фактор Касла | Молочная кислота | Кровь | ||
| общая | связанная НСl | свободная НСl | ||||||
| Норма | 1,5-2,0 | 40-60 | 20-30 | 20-40 | + | + | - | - |
| Гиперацидный гастрит | 1,0 | 80 | | 40 | + | ± | - | - |
| Гипоацидный гастрит | 2,5 | 40 | | 20 | ± | ± | ± | - |
| Ахилия | 7,0 | 20 | | - | - | - | + | - |
| Язва желудка | 1,5 | 60 | | 40 | + | + | - | + |
| Рак желудка | 6,0 и> | 40-60 | | 20 | + | + | + | + |
42. ГНИЕНИЕ БЕЛКОВ В ТОЛСТОМ КИШЕЧНИКЕ.
Всасывание аминокислот представляет собой активный Na-зависимый процесс, требующий затрат энергии АТФ. Перенос отдельных аминокислот осуществляется специальными переносчиками с участием трипептида глютатиона.
У детей могут всасываться не только аминокислоты, но также пептиды и низкомолекулярные белки. Это, с одной стороны, обеспечивает поступление в организм ребёнка иммуноглобулинов, антител грудного молока. С другой стороны, может вызывать аллергические реакции.
Процессу гниения в толстом кишечнике под действием ферментов гнилостной микрофлоры подвергаются не полностью расщепившиеся белки и отдельные не всосавшиеся аминокислоты. При гниении белков образуется большое количество газообразных и негазообразных веществ. К продуктам гниения белков относятся CO2, CH4, NH3, H2S, меркаптаны, альдегиды, кетоны, карбоновые кислоты, диамины, вещества циклической структуры.
Диамины образуются при декарбоксилировании диаминокислот лизина и орнитина
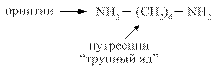
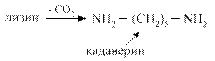
Диамины могут выводиться из кишечника или обезвреживаться в печени
При гниении белков могут образовываться токсичные циклические продукты. Гниение тирозина ведёт к появлению крезола и фенола, гниение триптофана сопровождается образованием скатола и индола.
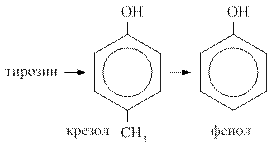
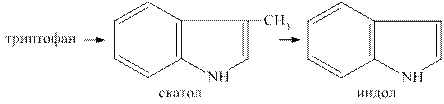
Продукты гниения белков чрезвычайно токсичны, по системе vena porta, они поступают в печень, где подвергаются процессам обезвреживания.
43. РЕАКЦИИ ДЕЗАМИНИРОВАНИЯ АМИНОКИСЛОТ И ИХ БИОЛОГИЧЕСКАЯ РОЛЬ.
Дезаминирование - это процесс отщепление α-аминогруппы от аминокислоты в виде аммиака.
Дезаминирования подлежат все аминокислоты, кроме лизина. Существует несколько видов дезаминирования:
прямое окислительное – для глутаминовой кислоты,
прямое неокислительное:
гидролитическое - для цистеина,
внутримолекулярная перестройка - для гистидина,
восстановительное - для серина и
треонина,
непрямое - для большинства аминокислот.
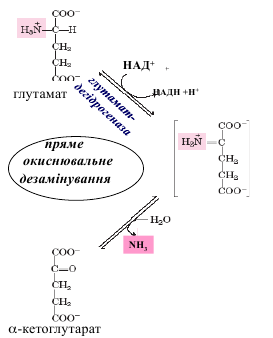
Основным видом прямого дезаминирования является окислительное дезаминирование,
которому подлежит только глутаминовая кислота.Прямое окислительное дезаминирование глутаминовой кислоты осуществляется
помощью фермента глутаматдегидрогеназы (кофермент НАД + или НАДФ +),
локализованного в митохондриях многих органов (максимально в печени) и с высокой
скоростью преобразующего глутамат в α-кетоглутарат. При прямом дезаминированииобразуется свободный аммиак (токсичное вещество), который далее обезвреживается. Большинство
аминокислот участвует в косвенном дезаминировании, первым этапом которого является трансаминирование
44. ТРАНСАМИНИРОВАНИЕ АМИНОКИСЛОТ: БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ, ИСПОЛЬЗОВАНИЕ В ДИАГНОСТИКЕ.ГЛЮКОЗО-АЛАНИНОВЫЙ ЦИКЛ.
Трансаминирование - это перенос аминогруппы от аминокислоты (донора) на α-
кетокислоту (акцептор) с последующим образованием новой α-кетокислоты и новой
аминокислоты без промежуточного выделения аммиака.
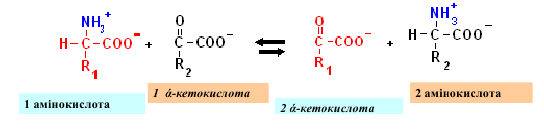
Эту реакцию катализируют аминотрансферазы (трансаминазы). Коферментом
аминотрансфераз является пиридоксальфосфат (Палфи) - активная форма витамина В6, который в качестве посредника принимает аминогруппу от аминокислоты и превращается в пиридоксаминфосфат (Памфа). Аминотрансферазы органоспецифические: аланин-Аминотрансфераза (АЛТ) локализован преимущественно в пеичнци, аспартатаминотрансфераза (АСТ) - в сердце. При повреждении этих органов ферменты
попадают в кровь. Определение их активности в сыворотке крови является очень важным
методом для выявления и контроля за ходом острого гепатита (АлАт) иинфаркта миокарда (АсАт). Активность этих индикаторных ферментов повышается при
данных заболеваниях в 20-30 раз.
Значение реакций трансаминирования:
коллекторная функция - сбор аминогрупп от различных
аминокислот в виде глутаминовой кислоты;
синтез заменимых аминокислот;
перераспределение аминного азота в тканях; начальный этап катаболизма аминокислот, первая
стадия косвенного дезаминирования;
благодаря реакциям трансаминирования углеродный
скелет аминокислот может включаться в другие виды обмена
веществ
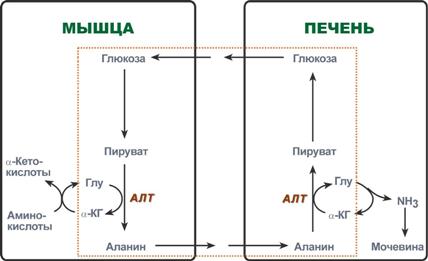
Глюкозо-аланиновый цикл функционирует в мышцах при голодании. При дефиците глюкозы, АТФ синтезируется за счет распад белков и катаболизма аминокислот в аэробных условиях, при этом глюкозо-аланиновый цикл обеспечивает: 1) удаление азота из мышц в нетоксичной форме; 2) синтез глюкозы (печень).
45. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ. ОБРАЗОВАНИЕ И БИОЛОГИЧЕСКАЯ РОЛЬ БИОГЕННЫХ АМИНОВ: ГАММА-АМИНОМАСЛЯНОЙ КИСЛОТЫ (ГАМК), ГИСТАМИНА, СЕРОТОНИНА, ДОФАМИНА. ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ.
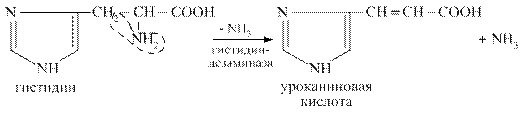
Внутримолекулярное дезаминирование
В процесс внутримолекулярного дезаминирования вступают аминокислоты гистидин, серин, треонин, цистеин. Например, из гистидина происходит выделение NН3 за счёт внутримолекулярной перестройки с образованием уроканиновой кислоты:
Серин в результате внутримолекулярного дезаминирования переходит в пировиноградную кислоту
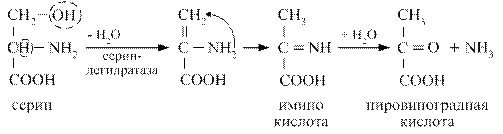
У детей процессы трансаминирования и дезаминирования идут более активно, чем у взрослых.
Декарбоксилирование аминокислот – ферментативный процесс высвобождения СО2 из СООН - групп аминокислот с образованием аминов.
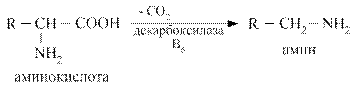
Наиболее активно в процесс деркарбоксилирования включаются аминокислоты гистидин, тирозин, глютамат, триптофан. Образующиеся амины называются биогенными аминами, поскольку они, как правило, обладают широким спектром физиологических эффектов, влияют на тонус сосудов, являются нейромедиаторами, участвуют в воспалительных реакциях. К основным биогенным аминам относятся гистамин, серотонин, катехоламины, гамма - аминомасляная кислота, полиамины.
Гистамин образуется при декарбоксилировании аминокислоты гистидина. Он синтезируется в тучных клетках, накапливается в секреторных гранулах, выделяется при раздражении клеток.
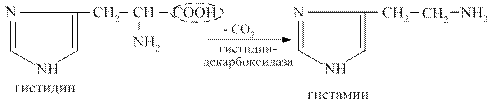
Гистамин оказывает разнообразные биологические эффекты: вызывает расширение сосудов, снижает артериальное давление, увеличивает тканевую проницаемость, вызывает местный отёк, стимулирует желудочную секрецию, обладает бронхоспатическим эффектом. В высокой концентрации он является медиатором воспалительных и аллергических реакций.
Серотонин образуется при декарбоксилировании гидрокситриптофана. Он синтезируется в хромаффиннных клетках кишечника, в некоторых ядрах подкорковых структур, в тромбоцитах.
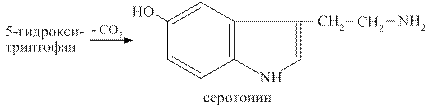
Эффекты серотонина: вызывает спазм сосудов, повышение артериального давления, стимулирует перистальтику кишечника, участвует в терморегуляции, в механизмах сна, памяти, является источником для синтеза гормона мелатонина, влияет на эмоциональные реакции человека.
Катехоламины (дофамин, адреналин, норадреналин) синтезируются из аминокислоты тирозина.
Дофамин – возбуждающий медиатор, при его дефиците развивается болезнь Паркинсона (адинамия, ригидность, тремор). Адреналин вызывает спазм сосудов, повышают артериальное давление, стимулирует работу сердца, является гормоном.
Норадреналин в основном выполняет нейромедиаторные функции.
Гамма - аминомасляная кислота (ГАМК) образуется при декарбоксилировании глютаминовой кислоты, является тормозным медиатором, улучшает кровоснабжение головного мозга, активирует окислительные процессы в нём.
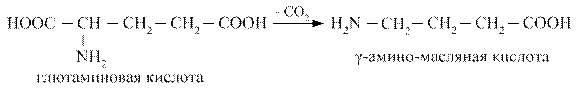
Полиамины (спермин, спермидин) синтезируются из орнитина и метионина, участвуют в регуляции процессов трансляции, транскрипции, репликации.
Так как биогенные амины очень активны, они быстро инактивируются в тканях. Распад биогенных аминов осуществляется несколькими способами: окисление, метилирование, дезаминирование. Основным способом инактивации биогенных аминов является окислительное дезаминирование под действием ферментов аминооксидаз (моноаминооксидаз, полиаминооксидаз).
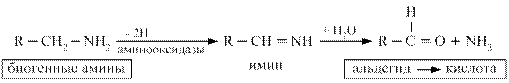
Ингибиторы МАО применяются в качестве терапевтических средств.
46. ИСПОЛЬЗОВАНИЕ БЕЗАЗОТИСТЫХ ОСТАТКОВ АМИНОКИСЛОТ: ПОНЯТИЕ, БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕРЫГЛИКОГЕННЫХ И КЕТОГЕННЫХ АМИНОКИСЛОТ.
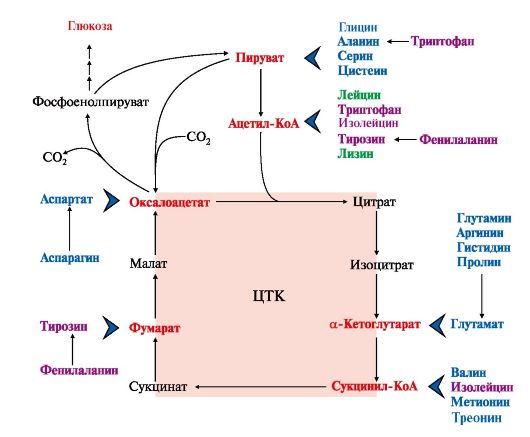
1. Катаболизм всех аминокислот сводится к образованию шести соединений, являющихся метаболитами ОПК (рис. 9.14):
• пируват,
• ацетил-КоА,
• α-кетоглутарат,
• сукцинил-КоА,
• фумарат,
• оксалоацетат.
Аминокислоты, которые в ходе катаболизма превращаются в пируват или другие промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат), в итоге превращаются в оксалоацетат и используются в процессе глюконеогенеза. Эти аминокислоты образуют группу гликогенных аминокислот.
Образование глюкозы из аминокислот стимулирует гормон кортизол, который индуцирует в печени синтез ферментов глюконеогенеза, орнитинового цикла и АЛТ.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат или ацетил-КоА и могут быть источником кетоновых тел - кетогенные аминокислоты: Лиз, Лей.
Катаболизм ряда аминокислот приводит к образованию соединений, которые могут использоваться для синтеза глюкозы, и кетоновых тел, так как превращаются сразу в два продукта - один из метаболитов ОПК и ацетилКоА (Иле) или ацетоацетат(Три, Фен, Тир). Такие аминокислоты называют смешанными или глико-кетогенными (см. рис. 9.14).
| |
2. Полное окисление безазотистых остатков аминокислот до углекислого газа и воды реального энергетического значения не имеет. Основной путь их использования - включение в глюконеогенез. Этот процесс усиливается при голодании и сахарном диабете.
Безазотистые остатки аминокислот используются для восполнения количества метаболитов ОПК, которое затрачивается на синтез биологически активных веществ
Такие реакции называют анаплеротическими. Можно выделить пять анаплеротических реакций:
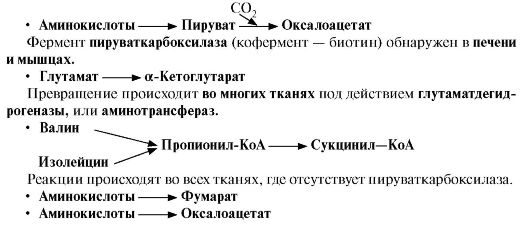 Последние две реакции происходят в печени.
Последние две реакции происходят в печени.Первые две реакции являются основными анаплеротическими реакциями
47. ИСТОЧНИКИ ОБРАЗОВАНИЯ АММИАКА В ОРГАНИЗМЕ. ПРИЧИНЫ ТОКСИЧНОСТИ АММИАКА. ПОНЯТИЕ ГИПЕРАММОНИЕМИИ.
1. Основным источником аммиака является катаболизм аминокислот в
тканях. Небольшая часть аммиака образуется в клетках при распаде азотсодержащих соединений (биогенных аминов, нуклеотидов и др.) (рис. 9.7), а также при гниении белков в кишечнике в результате деятельности микрофлоры, откуда он частично всасывается и поступает в воротную вену. Концентрация аммиака в крови воротной вены существенно выше, чем в общем кровотоке.
| |
Катаболизм аминокислот и образование аммиака происходит во всех тканях организма. Однако концентрация аммиака в крови очень мала, так как он быстро связывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в крови в норме составляет всего 0,4-0,7 мг/л (25-40 мкмоль/л).
Из организма аммиак выводится почками в виде конечных продуктов азотистого обмена:
• мочевины - синтезируется в печени;• аммонийных солей - образуются
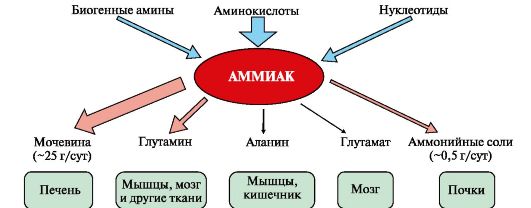 в почках.
в почках.