все вопросы бх. А) Химическая природа ферментов Ферменты(энзимы) биологические катализаторы
 Скачать 6.2 Mb. Скачать 6.2 Mb.
|
|
Синтез триацилглицеролов.Клетки большинства тканей, особенно печени и жировой ткани, обладают способностью накапливать ТАГ. Жировая ткань функционально специализируется на хранении (запасании) и мобилизации ТАГ (рис. 12.1). Предшественниками для синтеза ТАГ являются глицерол-3-фосфат и активированные жирные кислоты. В печени глицерол-3-фосфат может образовываться или в результате фосфорилирования глицерола, или из глюкозы как промежуточный продукт гликолиза. В жировой ткани единственным источником образования глицерол-3-фосфата является гликолиз. Вслед за перевариванием пищи в плазме крови увеличивается концентрация глюкозы, инсулина, липопротеинов, богатых ТАГ. Стимулируется активность ЛПЛ для гидролиза ТАГ в составе липопротеинов, и снижается активность жиромобилизующей липазы в жировой ткани. Наряду с этим стимулируется образование ТАГ в жировой ткани. Натощак или при повышенной потребности в энергии во время физической работы, повышении уровня катехоламинов, гормона роста, АКТГ и глюкагона в плазме крови, снижении секреции инсулина эти процессы меняются на противоположные — увеличивается липолиз в жировой ткани и высвобождаются жирные кислоты. Они используются в качестве источника энергии. Глицерол используется для глюконеогенеза. 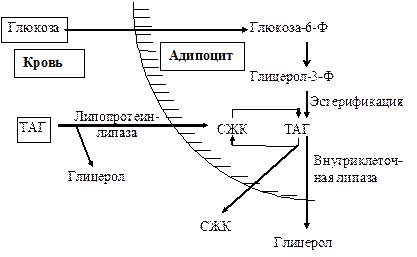 Рис. 12.1. Депонирование и расщепление нейтрального жира в адипоцитах Л 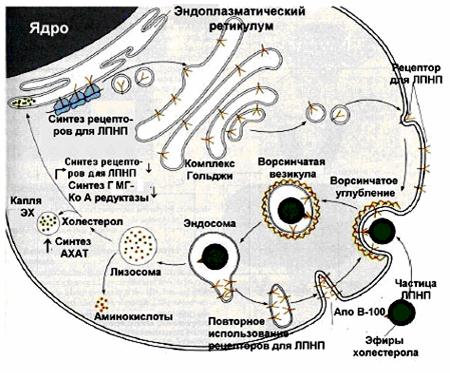 ипопротеины низкой плотности (ЛПНП). ЛПНП удаляются из кровотока путем взаимодействия с рецепторами для ЛПНП (другое их название апо В/Е рецепторы) ипопротеины низкой плотности (ЛПНП). ЛПНП удаляются из кровотока путем взаимодействия с рецепторами для ЛПНП (другое их название апо В/Е рецепторы) (рис. 12.2). Доля этого процесса в удалении всех ЛПНП составляет 75 %. Остальная часть удаляется с помощью «мусорных» рецепторов макрофагов, имеющих низкую способность связывания. Этот путь получил образное название «мусорный пут Рис. 12.2. Поступление ЛПНП в клетки и их внутриклеточный катаболизм После связывания ЛПНП комплекс рецептор — ЛПНП переносится в клетку посредством эндоцитоза; затем он сливается с лизосомами и разрушается. Внутриклеточное высвобождение холестерола, происходящее таким путем, вызывает следующие эффекты: а) снижает синтез ключевого фермента образования собственного, клеточного, холестерола — гидроксиметилглютарил-КоА (ГМГ-КоА) редуктазы; б) снижает синтез рецепторов для ЛПНП; в) активирует фермент ацетил-КоА-холестерол ацилтрансферазу (АХАТ), который катализирует образование из метаболически активной формы — СХ — метаболически неактивной формы — ЭХ (рис. 12.3). 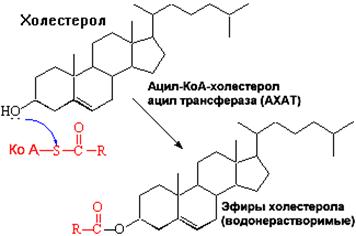 Рис. 12.3. реакция, катализируемая АХАТ В отличие от регуляторного действия рецепторов к ЛПНП на обмен холестерола в клетках, мусорные рецепторы продолжают транспортировать ХС в клетку без торможения по принципу обратной связи. Тем самым макрофаги превращаются в пенистые клетки. Их образование рассматривается как начальный этап атеросклероза. Метаболизм липопротеинов высокой плотности (ЛПВП).ЛПВП синтезируются в клетках печени и кишечника. Сразу после секреции ЛПВП имеют вид плоских дисков, содержащих ФЛ. Белковым компонентом их является апо А. Из тканей и клеточных мембран на них поступает холестерол. Под действием фермента лецитин-холестерол ацилтрансферазы (ЛХАТ) из СХ и жирной кислоты фосфатидилхолина образуются ЭХ. В результате частицы ЛПВП созревают, принимая форму глобулы. Затем ЭХ транспортируются на ЛППП, ЛПНП, обломки ХМ с помощью липидпереносящего белка (ЛПБ) или апо D. 32. Окисление глицерола. Окисление глицерола в клетках. Начинается оно с активирования этого вещества: З-фосфоглицериновый альдегид подвергается дальнейшему окислению с участием ферментов, катализирующих реакции второго этапа гликолиза. При аэробном окислении одной молекулы глицерола генерируется 23 молекулы АТФ: 3-глицеролфосфатдегидрогеназная реакция – 3 АТФ, 3-фосфоглицеральдегиддегидрогеназная реакция – 6 АТФ, фосфоглицераткиназная реакция – 2 АТФ, пируваткиназная реакция – 2 АТФ, пируватдегидрогеназная реакция – 6 АТФ, окисление ацетил-КоА в цикле Кребса – 12 АТФ. Поскольку 1 молекула АТФ затрачивается в глицеролкиназной реакции, то итоговый энергетический эффект всего процесса – 22 молекулы АТФ. β-кисление жирных кислот в клетках С  наибольшей интенсивностью этот процесс протекает в печени, где жирные кислоты окисляются до ацетил-КоА. В сердце и других органах они способны окисляться до углекислого газа и воды. Протекает β-окисление жирных кислот в пространстве между внутренней и наружной мембранами митохондрий. Начинается оно с активирования молекулы жирной кислоты: наибольшей интенсивностью этот процесс протекает в печени, где жирные кислоты окисляются до ацетил-КоА. В сердце и других органах они способны окисляться до углекислого газа и воды. Протекает β-окисление жирных кислот в пространстве между внутренней и наружной мембранами митохондрий. Начинается оно с активирования молекулы жирной кислоты:Так завершается один цикл β-окисления жирной кислоты, во время которого генерируется по одной молекуле ФАД-Н2 и НАД-Н2, окисляемых в дыхательной цепи митохондрий, и ацетил-КоА, способного окисляться в цикле Кребса. Укоротившийся на 2 углеродных фрагмента активированный остаток пальмитиновой кислоты (ацил-КоА) таким же образом, цикл за циклом, подвергается дальнейшему β-окислению. На последнем этапе этого процесса образуется активная форма масляной кислоты (бутирил-КоА). Она также подвергается β-окислениию: 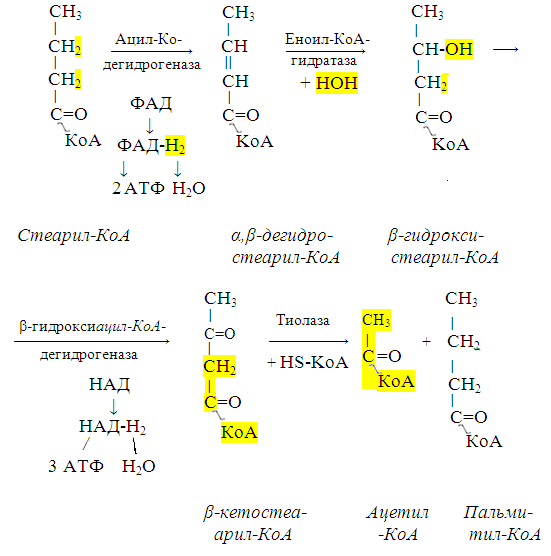 Из этого четырехуглеродной активированной жирной кислоты генерируется 2 молекулы ацетил- КоА, но не по две, а по одной молекуле ФАД-Н2 и НАД-Н2(образовавшаяся молекула ацетил- КоА не подвергается дальнейшему β-окислению). Энергетический эффект β-окисления жирных кислот(Х)рассчитывается по формуле: Х = n/2 X 17 – (5-1), где n – число углеродных атомов, включая группу –СООН; 17 – число молекул АТФ, генерируемых во время одного цикла: при окислении ФАД-Н2 (2 АТФ),НАД-Н2 (3 АТФ) и ацетил-КоА в цикле Кребса.(12 АТФ); 5 – количество АТФ, не образовашегося на последнем этапе β-окисления; 1 – количество АТФ, затрачиваемое на активацию жирной кислоты (образование ацил-КоА). β-окисления жирных кислот в печени. В этом органе основная масса жирных кислот окисляется до ацетил-КоА. Две молекулы последнего последнего соединяются между собой в результате реакции, катализируемой тиолазой. Образовавшаяся ацетоуксусная кислота током крови доставляется в мышечную и другие ткани, где обратно расщепляется до ацетил-КоА, который окисляется в цикле Кребса. Часть молекул ацетоуксусной кислоты, восстанавливаясь ионами водорода, отщепляемыми от НАД-Н2, превращается в β-гидрооксимасляную килоту. Какое-то количество молекул ацетоуксусной кислоты, отщепляя от карбоксильной группы углекислый газ, превращается в ацетон. Общее количество ацетоуксусной, β-гидрооксимасляной кислот и ацетона называют кетоновыми телами. Количество последних в тканях увеличивается (кетоз) при усиленном образовании их и недостаточно эффективном окислении. Окисление пропионовой кислоты,образовавшейся в рубце при расщеплении микроорганизмами клетчатки. Сукцинил-КоА в дальнейшем окисляется в цикле Кребса. 33. β - окисление ЖК Триацилглицерины поэтапно расщепляется тканевыми липазами. Ключевым ферментом липолиза является гормональнозависимая ТАГ-липаза. Образующиеся на этом этапе распада жиров глицерин и жирные кислоты окисляются в тканях с образованием энергии. Различают несколько вариантов окисления жирных кислот: α - окисление, β - окисление, ω - окисление. Основным вариантом окисления жирных кислот является β - окисление. Оно наиболее активно протекает в жировой ткани, печени, почках и сердечной мышце. β - окисление заключается в постепенном отщеплении от жирной кислоты двух углеродных атомов в виде ацетил - КоА с освобождением энергии. Запас жирных кислот в клетках сосредоточен в цитозоле, где протекает активация жирных кислот с образованием ацил - КоА 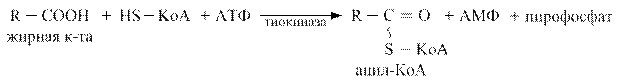 Сам процесс β-окисления ацил-КоА происходит в митохондриях. Митохондриальная мембрана непроницаема для длинноцепочечных ацил - КоА. В переносе их внутрь митохондрий участвует специальный переносчик карнитин (метил, гидроксипроизводное аминомасляной кислоты). Ацил - КоА образует с карнитином комплекс, который после переноса жирной кислоты внутрь митохондрий распадается.  Энергетическая эффективность бета - окисления жирных кислот складывается из энергии окисления ацетил - КоА в цикле Кребса и энергии, освобождающейся в самом бета – цикле. Энергия окисления жирной кислоты тем выше, чем длиннее её углеродная цепь. Количество молекул ацетил - КоА из насыщенной жирной кислоты и количество образующихся из них молекул АТФ определяется по формулам: n=N/2, где n-количество молекул ацетил - КоА, N- число атомов углерода в жирной кислоте. Количество молекул АТФ за счёт окисления молекул ацетил-КоА = (N/2)*12 Число β - циклов окисления на один меньше, чем количество образующихся молекул ацетил-КоА, поскольку в последнем цикле масляная кислота за один цикл переходит в две молекулы ацетил-КоА, и рассчитывается по формуле Количество β - циклов = (N/2)-1 Количество молекул АТФ в β - цикле рассчитывается, исходя из последующего окисления образовавшихся в нём НАДН2 (3 АТФ) и ФАДН2 (2 АТФ) по формуле Количество молекул АТФ, образующихся в β - циклах = ((N/2)-1)*5 2 макроэргические связи АТФ расходуются на активацию жирной кислоты Суммарная формула для подсчёта выхода АТФ при окислении насыщенной жирной кислоты имеет вид: 17(N/2)-7. Окисление ненасыщенных жирных кислот на начальных стадиях представляет обычное β - окисление до места двойной связи. Если эта двойная связь находится в β - положении, то продолжается окисление жирной кислоты со второго этапа (минуя стадию восстановления ФАД→ ФАДН2). Если двойная связь находится не β - положении, то ферментами еноилтрансферазами связь перемещается в β – положение. Таким образом, при окислении ненасыщенных жирных кислот образуется меньше энергии (теряется образование ФАДН2 на каждую двойную связь). Она рассчитывается по формуле: 7(N/2)-7-2m, где m-число двойных связей. Химизм β - окисления насыщенных жирных кислот  34. Этапы биосинтеза высших жирных кислот, характеристика синтазы высших жирных кислот. Высшие жирные кислоты могут быть синтезированы в организме из метаболитов углеводного обмена. Исходным соединением для этого биосинтеза является ацетил-КоА, образующийся в митохондриях из пирувата – продукта гликолитического распада глюкозы. Место синтеза жирных кислот – цитоплазма клеток, где имеется мультиферментный комплекссинтетаза высших жирных кислот. Этот комплекс состоит из шести ферментов, связанных с ацилпереносящим белком, который содержит две свободные SH-группы (АПБ-SH). Синтез происходит путём полимеризации двууглеродных фрагментов, конечным продуктом его является пальмитиновая кислота – насыщенная жирная кислота, содержащая 16 атомов углерода. Обязательными компонентами, участвующими в синтезе, являются НАДФН (кофермент, образующийся в реакциях пентозофосфатного пути окисления углеводов) и АТФ. Ацетил-КоА поступает из митохондрий в цитоплазму при помощи цитратного механизма (рисунок 20.1). В митохондриях ацетил-КоА взаимодействует с оксалоацетатом (фермент –цитратсинтаза), образующийся цитрат переносится через митохондриальную мембрану при помощи специальной транспортной системы. В цитоплазме цитрат реагирует с HS-КоА и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат (фермент – цитратлиаза). 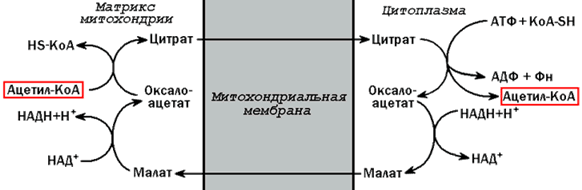 Рисунок 20.1. Перенос ацетильных групп из митохондрий в цитоплазму. Начальной реакцией синтеза жирных кислот является карбоксилирование ацетил-КоА с образованием малонил-КоА (рисунок 20.2). Фермент ацетил-КоА-карбоксилаза активируется цитратом и ингибируется КоА-производными высших жирных кислот.  Рисунок 20.2. Реакция карбоксилирования ацетил-КоА. Затем ацетил-КоА и малонил-КоА взаимодействуют с SH-группами ацилпереносящего белка (рисунок 20.3). 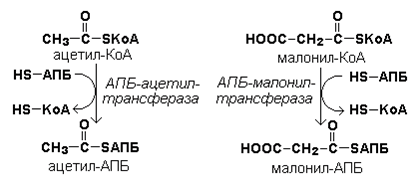 Рисунок 20.3. Взаимодействие ацетил-КоА и малонил-КоА с ацилпереносящим белком. Далее происходит их конденсация, декарбоксилирование и восстановление образовавшегося продукта (рисунок 20.4). 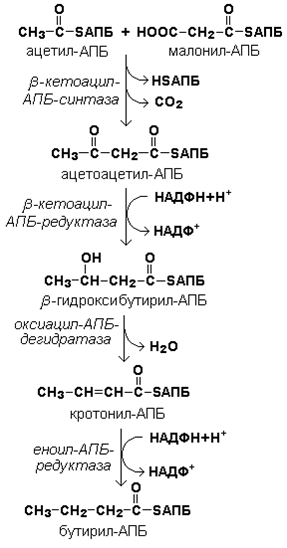 Рисунок 20.4. Реакции одного цикла биосинтеза жирных кислот. Продукт реакции взаимодействует с новой молекулой малонил-КоА и цикл многократно повторяется вплоть до образования остатка пальмитиновой кислоты. Запомните основные особенности биосинтеза жирных кислот по сравнению с β-окислением: синтез жирных кислот в основном осуществляется в цитоплазме клетки, а окисление – в митохондриях; участие в процессе связывания СО2 с ацетил-КоА; в синтезе жирных кислот принимает участие ацилпереносящий белок, а в окислении – коэнзим А; для биосинтеза жирных кислот необходимы окислительно-восстановительные коферменты НАДФН, а для β-окисления – НАД+ и ФАД. 3  5. Уравнения реакций синтеза триацилглицеролов и фосфатидов: фосфатидилхолина… 5. Уравнения реакций синтеза триацилглицеролов и фосфатидов: фосфатидилхолина…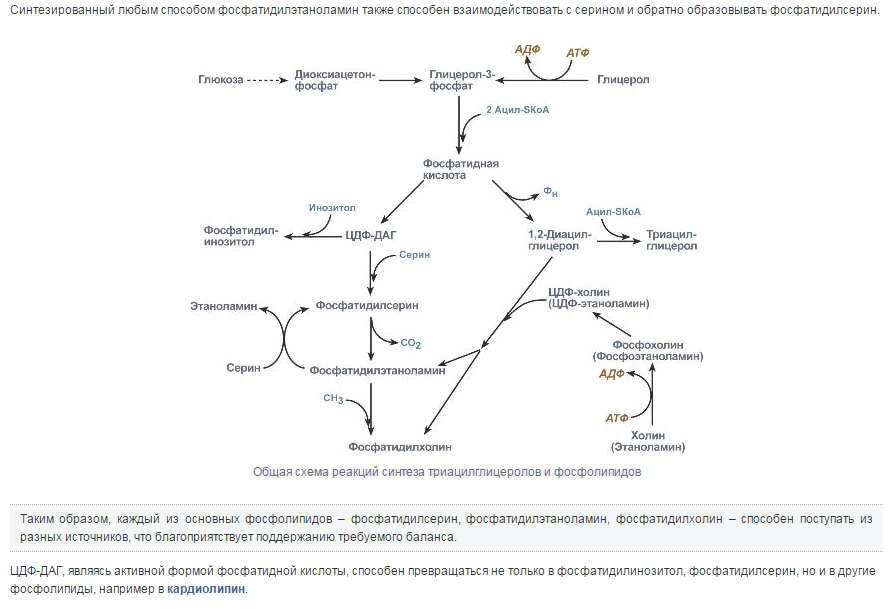 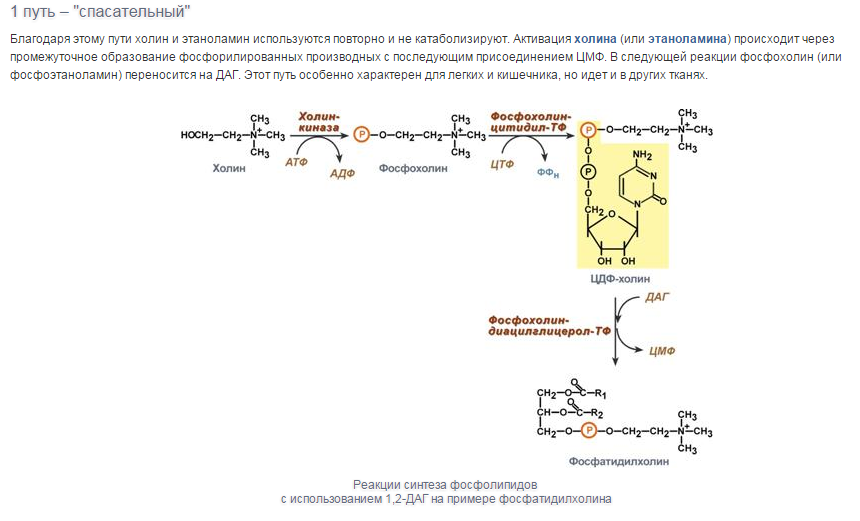 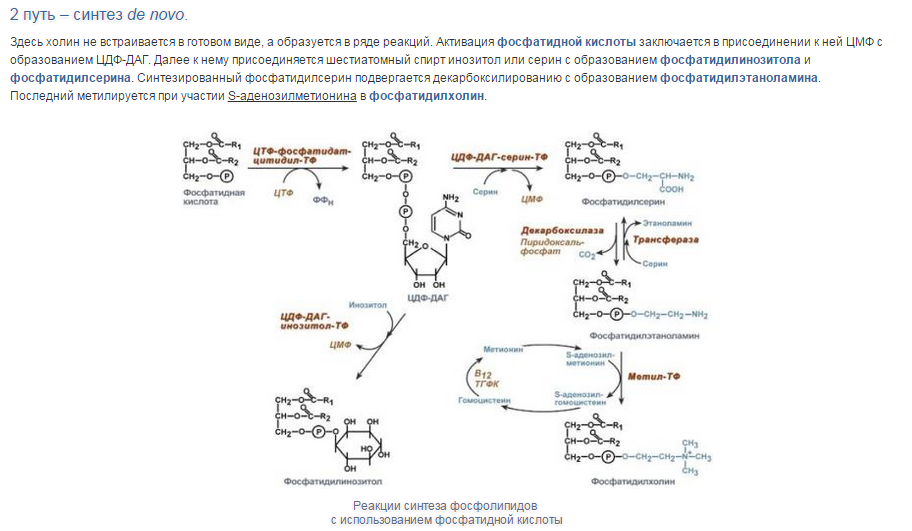 36. Биологическая роль холестерола. Этапы синтеза холестерола и его транспорт по крови. Исходным соединением для синтеза холестерола является ацетил-КоА (см. 20.2.3, рисунок 20.6). Ферменты, катализирующие реакции синтеза, содержатся в цитоплазме и эндоплазматическом ретикулуме многих клеток. Наиболее активно этот процесс происходит в печени. В организме человека в сутки синтезируется около одного грамма холестерола. 21.1.2. Биосинтез холестерола включает три основные стадии (рисунок 21.1). 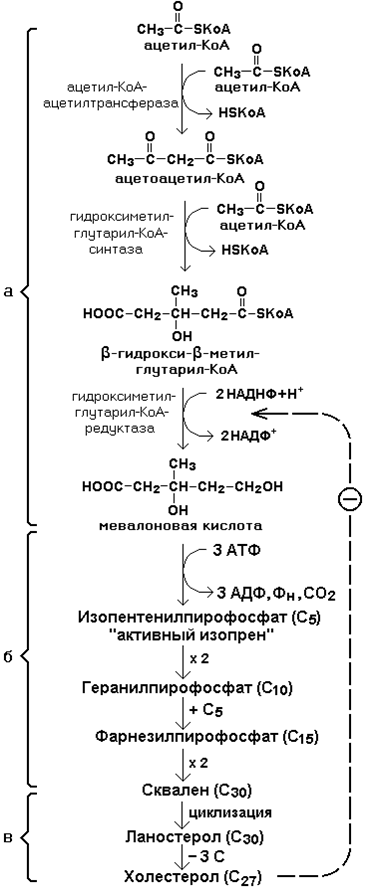 Рисунок 21.1 Синтез холестерола. На первой стадии образуется мевалоновая кислота (рисунок 21.5, а). На второй стадии мевалоновая кислота превращается в изопентенилпирофосфат («активный изопрен»), 6 молекул которого конденсируются в сквален (рисунок 21.5, б). На третьей стадии сквален превращается в холестерол (рисунок 21.5, в). Всего для синтеза 1 молекулы холестерола используется 18 молекул ацетил-КоА: для образования «активного изопрена» требуется 3 молекулы; в последующих реакциях конденсации участвуют 6 молекул «активного изопрена»; 3 × 6 = 18. 21.1.3. Скорость синтеза холестерола в организме регулируется по механизму отрицательной обратной связи (рисунок 21.5, пунктирная стрелка). Фермент β-гидрокси-β-метилглутарил-КоА-редуктаза катализирует лимитирующую реакцию биосинтеза холестерола. Холестерол является корепрессором синтеза данного ферментного белка, что приводит к снижению скорости катализируемой реакции. Поэтому при поступлении избытка холестерола с пищей синтез эндогенного холестерола прекращается. Холестерол является компонентом биологических мембран, из него в организме образуются стероидные гормоны, витамин D3, желчные кислоты (см. 14.1.2). Избыток холестерола превращается в печени в желчные кислоты (см. 20.1.3, рисунок 20.3), а также выделяется с желчью в кишечник и выводится с калом. 21.1.4. Нормальное содержание холестерола в сыворотке крови человека составляет 3,9 – 6,3 ммоль/л. Транспортной формой холестерола в крови являются липопротеины (см. далее 21.4.2). Если нарушается соотношение между поступлением холестерола в организм и его выведением, то содержание холестерола в тканях и крови изменяется. Повышение концентрации холестерола в крови (гиперхолестеролемия) может приводить к развитию атеросклероза и желчно-каменной болезни. 37. Синтез и использование кетоновых тел. Понятие и причины кетонемии и кетонурии. РЕАКЦИИ СИНТЕЗА КЕТОНОВЫХ ТЕЛ 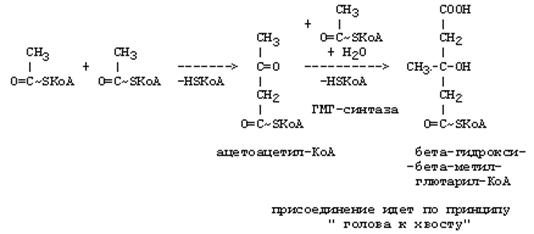 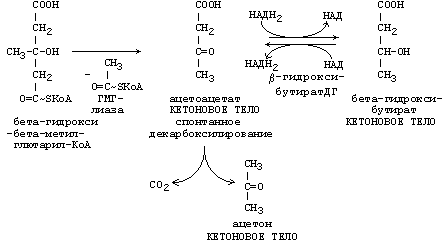 Ацетон, который образуется при спонтанном (неферментативном) декарбоксилировании ацетоацетата, в организме не используется. Он выводится с выдыхаемым воздухом, секретом потовых желёз и мочой. В норме концентрация ацетона в крови мала и обычными реакциями не определяется. Кетоновые тела синтезируются в печени, легко проходят через митохондриальные и клеточные мембраны и поступают в кровь. Кровью они транспортируются во все другие ткани. Используются только ацетоацетат и бета-гидроксибутират. Происходит в митохондриях (кроме клеток печени). Бета-гидроксибутират превращается в ацетоацетат, а ацетоацетат вступает в реакцию с промежуточным продуктом ЦТК - сукцинил-КоА. 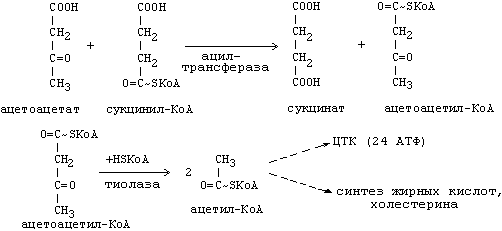 Пути использования образовавшегося из кетоновых тел АцетилКоА зависят от функционального состояния клетки (энергетический заряд) и ее специфики. В ткани, которая получила этот Ацетил-КоА, он может быть использован для разных целей, но чаще всего в ЦТК для получения энергии. В норме процессы синтеза и использования кетоновых тел уравновешены, поэтому концентрация кетоновых тел в крови и в тканях обычно очень низка, и составляет 0.12 - 0.30 ммоль/л. Однако при общем или при углеводном голодании может нарушаться баланс между образованием и утилизацией кетоновых тел. Это связано с тем, что скорость образования кетоновых тел зависит от скорости b-окисления жирных кислот в печени, а процесс b-окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Усиление липолиза может происходить под действием гормона адреналина, при мышечной работе, при голодании. При недостатке инсулина (сахарный диабет) также происходит усиление липолиза. При усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании. Постепенное истощение запасов углеводов при сахарном диабете приводит к относительному отставанию утилизации кетоновых тел от кетогенеза. Причина отставания: не хватает сукцинил-КоА и ЩУК, которые, в основном, являются продуктом обмена углеводов. Поэтому верно выражение: "Жиры сгорают в пламени углеводов". Это означает, что для эффективного использования продуктов распада жира необходимы продукты углеводного обмена: сукцинил-КоА и ЩУК. Таким образом, при углеводном голодании концентрация кетоновых тел в крови увеличивается. На 3-й день голодания концентрация кетоновых тел в крови будет примерно 2 - 3 ммоль/л, а при дальнейшем голодании - гораздо более высокой. Это состояние называют ГИПЕРКЕТОНЕМИЯ. У здоровых людей при мышечной работе и при голодании наблюдается гиперкетонемия, но она незначительна. Похожая ситуация характерна для САХАРНОГО ДИАБЕТА. При сахарном диабете клетки постоянное сильнейшее углеводное голодание, потому что глюкоза плохо проникает в клетки. Наблюдается активация липолиза и повышается образование кетоновых тел. При тяжелых формах сахарного диабета концентрация кетоновых тел в крови может быть еще выше, и достигать опасных для жизни значений: до 20 ммоль/л и более. Почему же накопление кетоновых тел является опасным для организма? Все кетоновые тела являются органическими кислотами. Их накопление приводит к сдвигу pH в кислую сторону. В клинике повышение концентрации кетоновых тел в крови называется "ГИПЕРКЕТОНЕМИЯ", а сдвиг pH при этом в кислую сторону - "КЕТОАЦИДОЗ". Нарушается работа многих ферментативных систем. Увеличение концентрации ацетоацетата приводит к ускоренному образованию ацетона. Ацетон - токсичное вещество (органический растворитель). Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего - клетки нервной ткани. Это может проявляться потерей сознания (ГИПЕРГЛИКЕМИЧЕСКАЯ КОМА). В очень тяжелых случаях может наступить гибель организма. Организм пытается защититься, поэтому часть кетоновых тел удаляется с мочой. Появление кетоновых тел в моче - это КЕТОНУРИЯ. Для распознавания гипер- и гипогликемической комы применяется экспресс-диагностика кетоновых тел. Основана на том, что гиперкетонемия приводит к выведению кетоновых тел с мочой (кетонурия). Поэтому проводят цветную реакцию на наличие кетоновых тел в моче. Раньше диагноз ставили по запаху ацетона изо рта больного при гипергликемической коме ("запах гнилых яблок"). 37. СИНТЕЗ И ИСПОЛЬЗОВАНИЕ КЕТОНОВЫХ ТЕЛ. ПОНЯТИЕ И ПРИЧИНЫ КЕТОНЕМИИ И КЕТОНУРИИ. Под термином «кетоновые (ацетоновые) тела» подразумевают ацетоук-суснуюкислоту (ацетоацетат) СН3СОСН2СООН, β-оксимасляную кислоту (β-оксибутират, или D-3-гидроксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3. В здоровом организме ацетон в крови присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилирования ацетоацетата и, по-видимому, не имеет определенного физиологического значения. Кетоновые тела образуются в печени. Прежние представления о том, что кетоновые тела являются промежуточными продуктами β-окисления жирных кислот, оказались ошибочными. Во-первых, в обычных условиях промежуточными продуктами β-окис-ления жирных кислот являются КоА-эфиры этихкислот, например β-окси-бутирил-КоА, ацетоацетил-КоА. Во-вторых, β-оксибутирил-КоА, образующийся в печени при β-окисле-нии жирных кислот, имеет L-конфигурацию, в то время как β-оксибутират, обнаруживаемый в крови, представляет собой D-изомер. Именно β-окси-бутират D-конфигурации образуется в ходе метаболического пути синтеза β-окси-β-метилглутарил-КоА (3-гидрокси-3-метилглутарил-КоА): 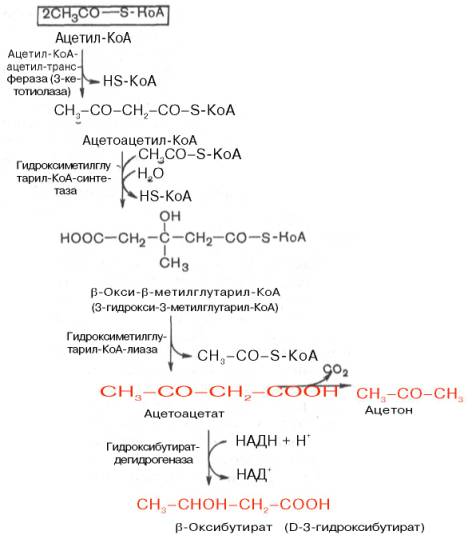 На первом этапе из 2 молекул ацетил-КоА образуется ацетоацетил-КоА. Реакция катализируется ферментом ацетил-КоА-ацетилтрансферазой (3-ке-тотиолазой). Затем ацетоацетил-КоА взаимодействует еще с одной молекулой ацетил-КоА. Реакция протекает под влиянием фермента гидро-ксиметилглутарил-КоА-синтетазы. Образовавшийся β-окси-β-метилглута-рил-КоА способен под действием гидроксиметилглутарил-КоА-лиазы расщепляться на ацетоацетат и ацетил-КоА. Ацетоацетат восстанавливается при участии НАД-зависимой D-3-гид-роксибутиратдегидрогеназы, при этом образуется D-β-оксимасляная кислота (D-3-гидроксибутират). Следует подчеркнуть, что фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры. Существует второй путь синтеза кетоновых тел. Образовавшийся путем конденсации 2 молекул ацетил-КоА ацетоацетил-КоА способен отщеплять коэнзим А и превращаться в ацетоацетат. Этот процесс катализируетсяферментом ацетоацетил-КоА-гидролазой (деацилазой): Однако второй путь образования ацетоуксусной кислоты (ацетоацетата) не имеет существенного значения, так какактивность деацилазы в печени низкая. В настоящее время ясна молекулярная основа изречения, что «жиры сгорают в пламени углеводов». Известно, что ацетил-КоА, образовавшийся при окислении жирных кислот, включается в цикл трикарбоновых кислот в условиях, когда расщепление жиров и углеводов соответствующим образом сбалансировано. Включение ацетил-КоА в цикл Кребса зависит от доступности оксалоацетата для образования цитрата. Однако если расщепление жировпреобладает, судьба ацетил-КоА изменяется. Объясняется это тем, что в отсутствие углеводов или при нарушении их использования концентрация оксалоацетата снижается. При голодании или диабете окса-лоацетат расходуется на образование глюкозы и поэтому не может конденсироваться с ацетил-КоА. В таких условиях путь метаболизма аце-тил-КоА отклоняется в сторону образования ацетоацетата и D-3-гидрокси-бутирата, т.е. кетоновых тел. В крови здорового человека кетоновые тела содержатся лишь в очень небольших концентрациях (в сыворотке крови0,03–0,2 ммоль/л). При патологических состояниях (у лиц с тяжелой формой сахарного диабета, при голодании, а также у животных с экспериментальным острым стрептозотоциновым или аллоксановым диабетом) концентрациякетоновых тел в сыворотке крови увеличивается и может достигать 16–20 ммоль/л. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала. Как отмечалось, основным местом образования ацетоацетата и 3-гид-роксибутирата служит печень. Из митохондрийпечени эти соединения диффундируют в кровь и переносятся к периферическим тканям. Действительно, сердечная мышца и корковый слой почек предпочтительно используют в качестве «топлива» ацетоацетат, а не глюкозу. В противоположность этому глюкоза является главным «топливом» для мозга у лиц, получающих сбалансированную пищу. При голодании и диабете мозг адаптируется к использованию ацетоацетата. Установлено, что в условиях длительного голодания 75% потребности мозга в «топливе» удовлетворяется за счет ацетоацетата. Известно, что в периферических тканях 3-гидроксибутират (β-оксимас-ляная кислота) способен окисляться до ацетоацетата, а последний активируется с образованием соответствующего КоА-эфира (ацетоацетил-КоА). Ацетоацетат может быть активирован путем переноса КоА с сукцинил-КоА в реакции, катализируемой специфической КоА-трансферазой. Образовавшийся ацетоацетил-КоА далее расщепляется тиолазой с образованием 2 молекулацетил-КоА, которые затем включаются в цикл Кребса: 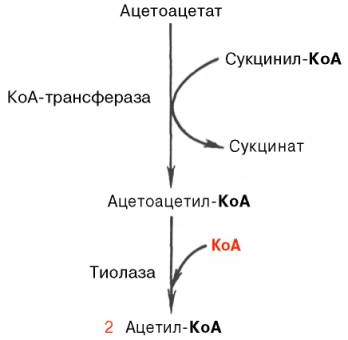 Не исключено, что существует и второй путь активации ацетоацетата – это использование АТФ и HS-KoA аналогично тому, как при активации жирных кислот: 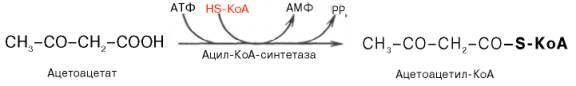 38. ЛИПОПРОТЕИНЫ СЫВОРОТКИ КРОВИ: БИОЛОГИЧЕСКАЯ РОЛЬ, ОСОБЕННОСТИ СОСТАВА И РАЗНОВИДНОСТИ. ПОНЯТИЕ АТЕРОГЕННЫХ И АНТИАТЕРОГЕННЫХ ЛИПОПРОТЕИНОВ. Липиды не растворимы в воде и транспортируются в крови в составе липопротеинов В сферических частицах липопротеинов неполярные липиды — эфиры холестерина и триглицериды образуют гидрофобное ядро, полярные липиды — холестерин и фосфолипиды совместно с амфипатическими белками — аполипопротеинами располагаются в гидрофильном поверхностном слое. Аполипопротеины придают липопротеинам стабильность, выполняют функцию лигандов клеточных рецепторов, определяют метаболическую судьбу липопротеинов. Липопротеины участвуют в транспорте липидов пищи (экзогенный путь) и липидов, синтезированных в организме (эндогенный путь). Экзогенный путь — всасывание липидов пищи в тонком кишечнике с помощью хиломикронов. Они образуются в энтероцитах, состоят из пищевых триглицеридов в комплексе с фосфолипидами и аполипопротеином В-48, поступают в кровоток через лимфатический грудной проток. После секреции хиломикроны получают аполипопротеины А-I, A-II, A-IV, С-II/С-III и Е. В крови триглицериды хиломикронов подвергаются липолизу под влиянием фермента эндотелия сосудов — липопротеидлипазы. Хиломикроны с истощенным содержанием триглицеридов становятся остатками хиломикронов (ремнанты). Эти остатки захватываются гепатоцитами при участии рецепторов апо В/Е. Эндогенная система включает липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности, липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). ЛПОНП синтезируются в печени. Они обогащены триглицеридами, содержат холестерин и аполипопротеины. Для секреции ЛПОНП из гепатоцитов в кровь необходим апоВ-100, затем в крови присоединяются апо Е и апо С-II/С-III. Триглицериды ЛПОНП гидролизуются эндотелиальной липопротеидлипазой (ее активатор — апо С-II). Жирные кислоты триглицеридов используются для ресинтеза жира в жировой ткани или окисляются в скелетных мышцах. Часть ЛПОНП превращается в ЛПНП через стадию липопротеинов промежуточной плотности. Таблица 74.Классы липопротеинов
Примечание. ЛПОНП — липопротеины очень низкой плотности, ЛПНП — липопротеины низкой плотности, ЛПВП — липопротеины высокой плотности. 39. НАРУШЕНИЯ ЛИПИДНОГО ОБМЕНА: а) гиперхиломикронемия; Тип I. Основное изменение в ЛП крови: высокое содержание ХМ в плазме крови натощак. Содержание ТГ крови резко повышено, уровень ХС — либо в пределах нормы, либо слегка повышен. Плазма крови выглядит, как молоко. При ее стоянии всплывает сливкообразный слой ХМ. Причиной накопления ХМ является генетически обусловленная недостаточность или даже полное отсутствие липопротеидлипазы, расщепляющей ХМ. Клинически нарушения обмена липидов, свойственные I типу ГЛП, проявляются в детском возрасте. Наиболее характерными симптомами являются гепатоспленомегалия, внезапные приступы абдоминальной колики, явления панкреатита. При увеличении содержания ТГ в плазме крови до 17,0 ммоль/л (1500 мг/дл) отмечается появление эруптивных ксантом, которые не имеют определенной локализации и легко рассасываются при нормализации уровня ТГ. Примечательно, что у лиц с I типом ГЛП практически не развивается атеросклероз и не встречается ИБС. Случаи первичной гиперхиломикронемии в популяциях чрезвычайно редки. Б)Стеаторея Стеаторея - (steatorrhoea) - выделение избыточного количества жира с каловыми массами (более 5 г/день) вследствие нарушения всасывания жиров в кишечнике .
Симптомы Стеатореи: У больных, страдающих стеатореей, часто наблюдается выделение обильного, неприятного и жирного стула, который расплывается по поверхности и с трудом смывается. Диарея является обычным характерным признаком заболевания. Наличие у больного желтухи с обесцвеченным стулом и темной мочой указывает на нарушение оттока желчи, которая играет существенную роль во всасывании жиров и растворимых в жирах витаминах. У больных с хроническим панкреатитом отмечаются неопределенные боли в эпигастральной области, иррадиирующие в спину и усиливающиеся во время еды. Боли в эпигастральной области, усиливающиеся во время еды, могут наблюдаться у больных с синдромом Золингера-Эллисона, характеризующимся чрезмерным образованием желудочного сока (снижение рН желудочного химуса), вызывающего инактивацию липазы. Это обычно наблюдается у больных с симптомами пептической язвы, неподдающейся консервативной терапии. Боли в правой подвздошной области, наблюдаемые у больных с болезнью Крона, обусловлены терминальным илеитом У больных с болезнью глютеновой недостаточности нередко отмечается задержка роста, неадекватное питание, сопровождающееся развитием анемии и атрофией мышц. У них наблюдаются боли вследствие деминерализации, мозжечковая атаксия и периферическая нейропатия. При болезни Уипла, возбудителем которой является Tropheryma whippleii, у больных помимо стеатореи наблюдаются боли в суставах, повышение температуры, пигментация кожи и увеличение периферических лимфатических узлов. Стеаторея является основным проявлением кишечной лимфомы. Кроме того, у больного могут наблюдаться боли в животе и повышение температуры тела, а иногда явления кишечной непроходимости. Болезнь Крона характеризуется образованием язв на слизистой полости рта, перианальных абсцессов, болями в правой подвздошной области и выделением крови из прямой кишки. Абеталипопротеинемия, наследственное заболевание (аутосомно-рецессивное наследование), развивающаяся в результате отсутствия а-полипопротеина В и сопровождающаяся нарушением образования хиломикрона, характеризуется развитием у больного атаксии и ночной слепоты вследствие пигментной дегенерации сетчатки (пигментный ретинит). Ранее перенесенная резекция кишечника, включая терминальный отдел подвздошной кишки, способствует нарушению всасывания жира вследствие снижения циркуляции желчных солей между печенью и кишечником. Более того, при уменьшении протяженности всасывающей поверхности кишечника уменьшается и период пассажа кишечного содержимого по кишечнику и, соответственно, уменьшается всасывание жира. Состояния, сопровождающиеся застоем кишечного содержимого, снижением перистальтической активности кишечника и уменьшением секреции желудочного сока, способствуют интенсивному размножению бактериальной флоры и ускоренному расщеплению желчных солей. Стеаторея часто сопровождается нарушением всасывания в кишечнике, и у больных может развиватьсякахексия. Наличие язв на слизистой полости рта наблюдается у больных с болезнью Крона или болезнью глютеновой недостаточности. Пальцы в виде барабанных палочек наблюдаются у больных с болезнью Крона, циррозом печени, болезнью глютеновой недостаточности и кистозным фиброзом. Некоторые сопровождаются нарушением экзокринной функции поджелудочной железы. Желтуха может наблюдаться у больных с непроходимостью желчных путей и поражением печени. Появление на теле кровоподтеков обусловлено нарушением свертываемости, вследствие дефицита витамина К, а причиной болей в костях, выявляемых при исследовании, является остеомаляция в результате дефицита витамина D. Классическая сыпь герпетиформного дерматита может наблюдаться у больных с болезнью глютеновой недостаточности. Узелковая эритема (нодозная эритема) является характерным признаком болезни Крона, которая также сопровождается болезненностью в правой подвздошной области, развитием перианальных абсцессов и свищей. У больных с поражением печени нередко наблюдается гепатомегалия, а спленомегалия наблюдается при кишечной лимфоме.
Причины Стеатореи: Наблюдается преимущественно при заболеваниях поджелудочной железы, при закупорке Вирсунгианова протока, иногда и при б-нях Базедова и Аддисона. С. может также иметь место в результате введения с пищей чрезмерно больших количеств жира. Макроскопически каловые массы при С. приобретают характерный серовато-глинистый оттенок и дают при стоянии на поверхности налет, имеющий вид застывшего сала. В случаях резкого нарушения процессов расщепления и утилизации жиров (напр. при тяжелых поражениях поджелудочной железы) сухой остаток кала может содержать до 50— 80% жира. У б-ных с нарушенной функцией поджелудочной железы после дачи 250 г масла испражнения приобретают макроскопически легко определяемый, характерный вид «жирного стула». Недостаточная утилизация жиров, resp. стеаторея, может иметь однако место и при относительно хорошем, а в ряде случаев даже неизмененном процессе расщепления жира. Так, при хронических панкреатитах нормальное расщепление жира может наблюдаться при потере его с калом в количестве 70—80% (Gross). В) Семейная гиперхолестеринемия Семейная гиперхолестеринемия (сокращенно СГ) - это генетическая болезнь, характеризующаяся высоким уровнем холестерина в крови, в частности, очень высоким уровнем липопротеидов низкой плотности (ЛПНП, т.н. "плохой холестерин"), а также ранним (в молодом возрасте) возникновением сердечно-сосудистых заболеваний. У многих пациентов происходят мутации в гене рецептора ЛПНП, кодирующего соответствующий белок ЛПНП-рецептора (обычно отвечающего за поглощение ЛПНП с кровотока) или аполипопротеина В (апо-В), который является частью ЛПНП, который связывается с рецептором (процесс, необходимый для связывания ЛПНП с рецептором). Мутации в других генах проявляются в относительно редких случаях. У пациентов, имеющих одну аномальную копию (гетерозиготная форма СГ) ЛПНПР гена сердечно-сосудистые заболевания могут возникать преждевременно (часто в возрасте от 30 до 40 лет). Наличие двух аномальных копий (гомозиготная форма СГ) может вызвать тяжелые сердечно-сосудистые заболевания даже у детей. Гетерозиготная СГ является распространенным генетическим заболеванием, встречающимся в общей популяции в большинстве стран у 1:500 человек.Гомозиготная СГ проявляется намного реже и встречается в 1:1000000 новорожденных. Гетерозиготную СГ, как правило, лечат статинами, секвестрантами желчных кислот или другими гиполипидемическими средствами, снижающими уровень холестерина. Обычно, первое обнаружение СГ у больных требует проведения генетической консультации. Гомозиготная СГ требует серьезного лечения, поскольку медикаментозная терапия часто не дает достаточного эффекта, и может требовать других видов лечения, включая аферез ЛПНП (удаление ЛПНП, данный метод имеет сходство с диализом или плазмоферезом) и, в отдельных случаях, трансплантацию печени. Признаки и симптомы Физикальные ризнаки Обычно, высокий уровень холестерина, особенно в молодом возрасте, не вызывает никаких симптомов. Холестерин может откладываться в различных частях тела и может быть видимым снаружи, например, в желтоватых пятнах вокруг век (ксантелазма), на внешней границе радужной оболочки глаза (роговичная дуга) и в виде комков в сухожильях рук, локтей, коленей и стоп, особенно ахилловом сухожилии (ксантома сухожилия). Изменения в системе кровообращения Ускоренное отложение холестерина на стенках артерий приводит к атеросклерозу, который является основной причиной сердечно-сосудистых заболеваний. Самой распространенной проблемой при СГ является развитие ишемической болезни сердца (атеросклероз коронарных артерий, поставляющих сердце кровью) в более раннем возрасте, чем можно было бы ожидать в общей популяции. Это может привести к стенокардии (сжатие в груди при физической нагрузке) или сердечного приступа. Реже страдают артерии головного мозга, что может привести к транзиторной ишемической атаке (короткие эпизоды слабости в одной стороне тела или неспособность говорить), а иногда к ишемическому инсульту. Периферический облитерирующий эндартериит (закупорка артерий ног) происходит в основном у людей с СГ, которые курят, что может вызвать боль в икроножных мышцах при ходьбе, и во время отдыха (перемежающаяся хромота) и проблемы связанные с уменьшением кровоснабжения ног (например гангрена). Если липиды начали проникать в аортальный клапан (клапан сердца между левым желудочком и аортой) или восходящую аорту (непосредственно над клапаном), утолщение стенок аорты может привести к сужению прохода, что называется аортальным стенозом. Надклапанный аортальный стеноз (отвердения аорты выше уровня аортального клапана) может проявляться более чем в половины гомозиготных пациентов, в то время как гетерозиготные реже бывают пораженными. Аортальный стеноз характеризуется одышкой, болями в груди, временными головокружениями или потерей сознания и часто симптомы напоминают стенокардию. С возрастом увеличивается риск заболевания атеросклерозом и у тех, кто курит, имеет диабет, высокое кровяное давление и семейную историю сердечно-сосудистых заболеваний. Г) жировое перерождение печени; Жировой гепатоз печени является хроническим заболеванием печени, при котором наблюдается перерождение гепатоцитов (нормальных клеток печени) в жировую ткань. Заболевание невоспалительное, связано с обменным нарушением на клеточном уровне и различными дистрофическими процессами непосредственно в паренхиме печени. Первоначально это происходит безболезненно, без ярко выраженных неприятных симптомов. Спустя некоторые время заболевание начнет развиваться лавинообразно: могут проявиться проблемы с другими системами организма и органами, которые работают за счет печени. Это, свою очередь, снова ударит по печени: она будет плохо снабжаться кровью, в нее будут поступать токсины из кишечника и т.д. Сущность данного патологического процесса заключается в том, что в гепатоцитах – функционально нормальных клетках печени начинают накапливаться жирные кислоты (липиды), в большей степени триглицериды (смесь глицерина и жирных кислот). В тяжелых случаях доля триглицеридов может составить до половины массы печени. Переполненные триглицеридами гепатоциты будут погибать и замещаться соединительной фиброзной тканью – печень начнет сильно деградировать. |
