все вопросы бх. А) Химическая природа ферментов Ферменты(энзимы) биологические катализаторы
 Скачать 6.2 Mb. Скачать 6.2 Mb.
|
Причины токсичности аммиака1. Аммиак сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата. В результате снижается концентрация -кетоглутарата, что вызывает угнетение обмена аминокислот (переаминирова-ние) и гипоэнергетическое состояние (угнетение цикла Кребса). 2. Аммиак усиливает синтез глутамина из глутамата в нервной ткани. Снижение концентрации глутамата нарушает обмен нейромедиаторов, в частности синтез -аминомасляной кислоты – основного тормозного модуля-тора. Это нарушает проведение нервного импульса и вызывает судороги. 3. Аммиак в крови и цитозоле образует ион NH4+, накопление которого нарушает трансмембранный перенос ионов, в частности Na+ и К+, что также влияет на проведение нервного импульса. 4. Накопление аммиака может сдвигать рН в щелочную сторону, вызывая метаболический алкалоз. Гипераммониемия - это наследственное заболевание обмена веществ, проявляющееся в недостаточности цикла ферментов мочевины, приводящее к отравлению организма аммиаком. Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость. 48. ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА И ИХ ОСОБЕННОСТИ В ПОЧКАХ, ПЕЧЕНИ, НЕРВНОЙ ТКАНИ. В тканях аммиак находится преимущественно в виде иона аммония NН 1. Восстановительное аминирование. Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах - это биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина): 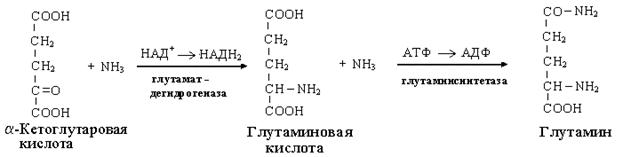 Эта реакция протекает во многих тканях, но наиболее важна для нервной, особенно чувствительной к токсическому действию аммиака. Первая реакция представляет собой обращение глутаматдегидрогеназной реакции (обратная окислительному дезаминированию ГЛУ). Обезвреживание аммиака путем синтеза глутамина имеет и анаболическое значение, поскольку глутамин используется для синтеза ряда соединений. Прежде всего нужно отметить, что глутамин — одна из 20 аминокислот, входящих в белки. Кроме того, амидная группа глутамина используется для синтеза аспарагина, глюкозамина и других аминосахаров, пуриновых и пиримидиновых нуклеотидов. Таким образом, в этих реакциях азот аммиака включается в разнообразные структурно-функциональные компоненты клетки. Глутамин затем может поступать во все ткани, где осуществляется его гидролиз при участии глутаминазы: Подобным образом происходит образование аспарагина (через ЩУК). 2. Образование аммонийных солей. Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки. Но она в несколько раз повышается при ацидозе, т. е. при увеличении содержания кислот в организме. Аммиак в почках образуется главным образом за счет амидной группы глутамина. Глутамин гидролизуется активируемой фосфатом глутаминазой, имеющейся в клетках эпителия канальцев почки. Часть аммиака (примерно 30%) образуется другим путем — в результате непрямого дезаминирования аминокислот. Образующийся аммиак нейтрализует кислоты: NH3 + Н+ → NH4+. Неионизированные аммиак и кислоты в клетках находятся в равновесии с их ионизированными формами. Через клеточные мембраны проникают преимущественно неионизированные аммиак и кислоты, и в просвете почечного канальца (т. е. уже в моче) аммиак акцептирует протон кислоты, образуя аммонийную соль, которая выводится из организма. Экскреция аммиака почками служит для выведения именно кислот, а не азота, на что указывает значительная скорость экскреции при ацидозе, малая — при нормальной кислотности межклеточной жидкости и крови, и отсутствие экскреции аммиака при алкалозе. Одновременно этот процесс обеспечивает сохранение организмом ионов Na+, которые в отсутствие ионов аммония выводились бы с анионами кислот. Потеря таких количеств Na+, которые необходимы для выведения кислот при ацидозе, могла бы вызвать снижение осмотического давления межклеточной жидкости и крови, а вследствие этого уменьшение объема межклеточной жидкости, т. е. обезвоживание тканей. 3. Основным механизмом связывания аммиака в организме является синтез мочевины. Мочевина выводится из организма с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного обмена. На долю мочевины приходится до 80-85 % от всего выводимого из организма азота. Количество выделяемой мочевины зависит от количества белков, поступающих с пищей. Если суточный рацион включает 80–100 г белка, то за сутки образуется и выводится 25–30 г мочевины. Основным местом синтеза мочевины является печень. Синтез мочевины является циклическим метаболическим процессом и носит название орнитинового цикла мочевинообразования Кребса (цикл мочевины Кребса - Хензеляйта). На первом этапе из NН3 и СО2 при участии АТФ синтезируется макроэргическое соединение карбамоилфосфат: 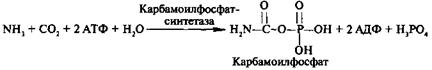 На втором этапе цикла мочевинообразования происходит конденсация карбомоилфосфата и орнитина с образованиемцитруллина. На следующей стадии вначале происходит связывание одной молекулы NН3 путем восстановительного аминирования с образованием (с затратой молекулы АТФ) аспарагиновой кислоты. Затем цитруллин и аспарагиновая кислота взаимодействуют с образованием аргининосукцината, который распадается на аргинин и фумарат при участии аргининосукцинатлиазы. Аргинин расщепляется под действием фермента аргиназы на орнитин и мочевину Образовавшийся орнитин может вступать в следующий цикл мочевинообразования. Хотя аргинин есть во всех клетках организма человека, образование мочевины происходит исключительно в клетках печени - единственном органе, где локализован фермент аргиназа. Мочевина из клеток печени поступает в кровь и выводится из организма через почки. Для синтеза одной молекулы мочевины требуется две молекулы NН3, одна молекула СО2 и три молекулы АТФ. Т.о., исходя из фактических данных о механизмах обезвреживания аммиака в организме часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования a-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот. Наибольшее количество аммиак расходуется на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных. 50,60 ОБМЕН СЕРИНА И ГЛИЦИНА. РОЛЬ ФОЛИЕВОЙ КИСЛОТЫ 1. Серин- заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата в последовательности реакций дегидрирования, трансаминирования и гидролиза под действием фосфатазы (рис. 9.17). В организме серин используется для синтеза: • фосфолипидов (фосфатидилсерины, сфингомиелины); • аминокислот (глицина, цистеина). Основной путь катаболизма серина его дезаминирование с образованием пирувата 2.Глицин образуется из серина под действием сериноксиметилтрансферазы.Коферментом этого фермента является тетрагидрофолиевая кислота (Н4-фолат), которая присоединяет β-углеродный атом серина, образуя метилен - Н4-фолат (рис. 9.18): Глицин является предшественником: • порфиринов (гема), • пуриновых оснований, • коферментов, • глутатиона и др. Катаболизм глицинапроисходит т  акже сучастием Н4-фолата,который связывает а-СН2-группу глицина (см. рис.). акже сучастием Н4-фолата,который связывает а-СН2-группу глицина (см. рис.).3.Н4-фолатобразуется в печени из фолиевой кислоты (фолата) с участием ферментов фолатредуктазы и дигидрофолатредуктазы ( см.рис.). Коферментом этих редуктаз является NADPH.  Метиленовая группа -СН2-в молекуле метилен-Н4-фолата может превращаться в другие одноуглеродные группы:  Н4-фолат способен передавать эти группы на другие соединения и играет роль промежуточного переносчика одноуглеродных групп. Одноуглеродные фрагменты используются для синтеза нуклеотидов и ряда соединений. 4. Фолиевая кислота является витамином для человека и большинства млекопитающих (витамин ВС или В9). Она широко распространена в пищевых продуктах и синтезируется бактериями кишечника. Гиповитаминоз у человека возникает достаточно редко. Причинами его могут послужить: • неправильное питание - недостаточное потребление овощей, фруктов и мясных продуктов; • нарушение всасывания фолиевой кислоты в кишечнике; • гепатит, цирроз и другие поражения печени, вызывающие снижение активности фолатредуктазы. Гиповитаминоз фолиевой кислоты приводит к нарушению синтеза нуклеиновых кислот в организме, что сказывается прежде всего на быстро делящихся клетках крови, и развитию мегалобластной анемии. ОБМЕН МЕТИОНИНА. 1. Метионин - незаменимая аминокислота, необходимая для синтеза белков. Мет-тРНКмет участвует в инициации процесса трансляции каждого белка. Как и многие другие аминокислоты, метионин подвергается транс- и дезаминированию. Особая роль метионина заключается в том, что метильная группа этой аминокислоты используется для синтеза целого ряда соединений в реакциях трансметилирования. Основным донором метильной группы является S-аденозилметионин (SAM) - активная форма метионина, который присутствует во всех типах клеток и синтезируется из метионина и АТФ под действием фермента метионин-аденозилтрансферазы: Структура -S+-CH3 в SAM является нестабильной, метильная группа легко отщепляется, что определяет высокую способность ее к переносу на другие соединения в реакциях трансметилирования  В реакциях трансметилирования SAM превращается в S-аденозилгомо- цистеин (SAr), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина В12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата 2. Метионин и серин необходимы для синтеза условно заменимой аминокислоты цистеина, причем в этом процессе метионин является донором атома серы. Цистеин образуется непосредственно из гомоцистеина в ходе двух реакций, которые происходят с участием пиридоксальфосфата . Генетический дефект этих ферментов приводит к нарушению использования гомоцистеина в организме и превращению его в гомоцистин. Гомоцистин может накапливаться в крови и тканях, выделяться с мочой, вызывая гомоцистинурию. Заболевание сопровождается эктопией (смещением) хрусталика глаза, катарактой, остеопорозом, умственной отсталостью (-50% больных). Причиной заболевания могут служить как наследственные нарушения обмена гомоцистеина, так и гиповитаминоз фолиевой кислоты или витаминов В12 и SАМ как донор метильной группы участвует в синтезе многих веществ (лецитина, адреналина, карнитина, ацетилхолина, креатина и др.), а также в инактивации нормальных метаболитов и обезвреживании токсических веществ в печени.  ОБМЕН ФЕНИЛАЛАНИНА, ТИРОЗИНА 1  . Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется ароматическое кольцо. Основная часть поступающего с пищей фенилаланина используется в синтезе тканевых белков, превращение остальной части начинается с его гидроксилирования, в результате чего образуется тирозин. Реакция эта катализируется специфической монооксигеназой - фенилаланингидроксилазой, коферментом которой является тетрагидробиоптерин (Н4-БП) . Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется ароматическое кольцо. Основная часть поступающего с пищей фенилаланина используется в синтезе тканевых белков, превращение остальной части начинается с его гидроксилирования, в результате чего образуется тирозин. Реакция эта катализируется специфической монооксигеназой - фенилаланингидроксилазой, коферментом которой является тетрагидробиоптерин (Н4-БП) 1. Реакцию катализирует фенилаланингидроксилаза (1), коферментом которой является Н4БП. Кофактором являются ионы Fe2+. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). 2. Регенерация дигидробиоптерина (2) происходит при участии дигидробиоптеринредуктазы с использованием NADPH. 2. Тирозин - условно заменимая аминокислота. Синтезируется только из фенилаланина. Катаболизм Фен и Тир происходит в печени. В результате ряда реакций образуется фумарат и ацетоацетат (рис. 9.23, А). Фумарат используется для синтеза глюкозы (глюконеогенез) или окисляется до СО2 и Н2О. Ацетоацетат - кетоновое тело, которое окисляется в тканях с выделением энергии. Таким образом, Фен и Тир относятся к смешанным (гликокетогенным) аминокислотам по использованию безазотистого остатка. Превращение промежуточного продукта катаболизма Тир - гомогентизиновой кислоты - в фумарилацетоацетат сопровождается расщеплением ароматического кольца. Процессы расщепления ароматических колец в биологических системах катализируются ферментами диоксигеназами. Для катализа диоксигеназам необходимыкофакторы - Fe2+ или гем (для некоторых - Сu+), а также - витамин С. 3. В мозговом веществе надпочечников и нервной ткани из тирозина синтезируются катехоламины (дофамин, норадреналин, адреналин) Тирозин под действием специфической монооксигеназы - тирозингидроксилазы превращается в ДОФА. Для протекания реакции необходимы Н4БП, О2 и Fe2+ (реакция аналогична гидроксилированию фенилаланина,.Тирозингидроксилаза найдена только в надпочечниках и катехоламинэргических нейронах (преимущественно в их нервных окончаниях). Этот фермент является регуляторным и определяет скорость синтеза катехоламинов. Одна из функций последних - регуляция деятельности сердечнососудистой системы. Активность тирозингидроксилазы значительно изменяется в результате: • аллостерической регуляции по принципу ретроингибирования норадреналином; • фосфорилирования с участием цАМР - зависимой протеинкиназы, при этом снижается Км для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы; • индукции синтеза фермента кортизолом. Катехоламины выполняют очень важные функции в организме. Дофамин является медиатором среднего отдела мозга.Норадреналин - тормозный медиатор синаптической нервной системы и разных отделов головного мозга, но может выполнять функцию возбуждающего медиатора в гипоталамусе. Адреналин - гормон интенсивной физической работы, который синтезируется при стрессе и регулирует основной обмен, а также усиливает сокращение сердечной мышцы. В щитовидной железе тирозин используется для синтеза гормонов иодтиронинов (тироксина и трииодтиронина).. В меланоцитах - пигментных клетках кожи, сетчатки глаз тирозин является предшественником пигментов меланинов  Репликация ДНК Реплика́ция (от лат.replicatio — возобновление) — процесс синтеза дочерней молекулыдезоксирибонуклеиновой кислотына матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15—20 различных белков, называемый реплисомой Репликация проходит в три этапа: инициация репликации элонгация терминация репликации. Инициация - это самая начальная фаза репликации (удвоения) молекул ДНК, т.е. зарождение двух новых дочерних нитей ДНК на матрице старой двойной родительской молекулы. 2. Элонгация (удлинение цепи). Комплекс ферментов репликации, называемый реплисомой, движется вдоль молекулы ДНК-матрицы, расплетая ее и наращивая комплементарные цепи ДНК. 3. Терминация (окончание репликации). В ДНК имеются сайты терминации репликации, содержащие специфические последовательности, с которыми связываются терминаторные белки, препятствующие дальнейшему продвижению репликативной вилки. Синтез ДНК заканчивается. ДНК-реплицирующий комплекс включает в себя около 20 компонентов. Отметим главные из них. Геликаза (хеликаза) расплетает ДНК на две отдельные цепи. Образуется репликативная вилка. По-видимому, при этом данный участок расплетённой ДНК отделяется от хромосомных белков. На разъединение комплементарной связи в каждой паре нуклеотидов тратится энергия 2-х молекул АТФ. Молекула ДНК жестко закреплена в некоторых учакстках на ядерном матриксе и поэтому не может свободно вращаться при расплетании. Это блокирует продвижение геликазы по цепи. Топоизомераза надрывает одну из двух нитей ДНК, и она раскручивается вокруг целой нити. Так снимается структурное напряжение при раскручивании спирали. Затем разорванные концы сращиваются обратно тем же ферментом. У бактерий другой вид топоизомеразы (гираза) разрывает сразу обе цепи ДНК, а после раскручивания спирали соединяет их вновь. 51. Биологическая роль и биосинтез креатина. Биосинтез креатина протекает в 2 стадии при участии 3-х аминокислот: аргинина, глицина, метионина. I стадия 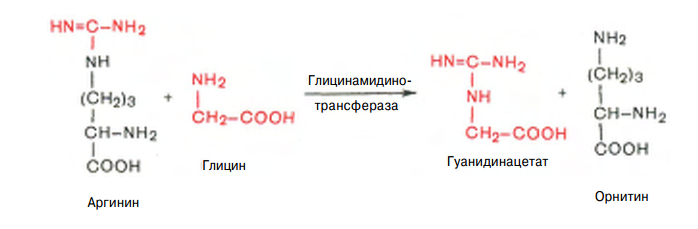 Синтез гуанидинацетата в почках при участии глицинамидинотрансферазы Синтез гуанидинацетата в почках при участии глицинамидинотрансферазы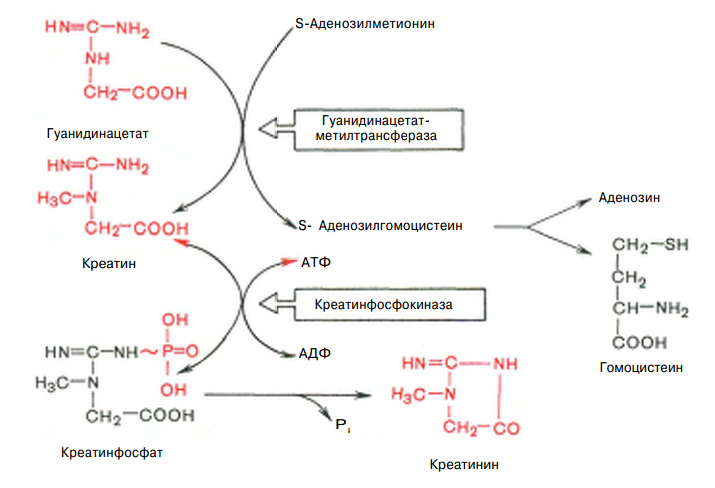 II стадия – в печени при участии гуанидинацетатметилтрансферазы II стадия – в печени при участии гуанидинацетатметилтрансферазыВ дальнейшем креатин подвергается фосфорилированию с образованием креатинфосфата, который после дефосфорилирования (необратимая реакция) превращается в креатинин, выделяющийся с мочой. Биологическая роль. Кретин- азотистое соединение, которое в виде креатинфосфата имеет значение в энергообеспечении функции мышц. Генерация АТФ из креатинфосфата –наиболее быстрый механизм образования АТФ, необходимого для включения мышечного сокращения. За счет действия креатинфосфокиназного (КФК) механизма (креатинфосфат +АДФ = креатин + АТФ) возможно обеспечение интенсивной работы мышц в течении 2-5 с, что необходимо для подключения других энергетических механизмов. 52. Энзимопатии аминокислотного обмена (метаболические блоки и клинические проявления) : 1) цистинурия- врожденная аномалия, которая связана с полным блокированием реабсорбции цистина и частичным нарушением всасывания лизина, аргинина, орнитина в почках. Избыток аминокислот ведет к образованию в организме камней. 2) гомоцистинурия- наследственное заболевание, связанное с расстройством обмена метионина, характеризующееся выделением гомоцистина с мочой,за-держкой умственного развития, эктопией хрусталика, редкими светлыми волосами, тенденцией к судорожным реакциям, анемией, явлениями тромбоэмболии (ИБС) и жировым перерождением печени. В результате снижения активности специального фермента печени (цистатионинсинтетазы) в организме ребенка накапливаются метионин и гомоцистин, оказывающие повреждающее действие на ряд систем организма, что приводит к развитию гомоцистинурии. 3)фенилкетонурия – энзимопатия, связанная с дефектом фенилаланин-4-монооксигеназы. В результате блокировки образования тирозина из фенилаланина последний идет на образование фенилпирувата и фенилацетата, которые в больших количествах накапливаются в организме. Заболевание характеризуется задержкою умственного (фенилпировиноградная олигофрения) и физического развития. 4) алкаптонурия- энзимопатия, вызванная недостатком оксидазы гомогентизиновой кислоты. Характерное проявление- выведение гомогентизиновой кислоты с мочой, которая при окислении кислородом воздуха, становится темного цвета. Накопление гомогентизиновой кислоты в суставах- артриты. 5)альбинизм- энзимопатия, связанная с недостатком тирозиназы, которая катализирует реакции образования пигмента- меланина. Отсутствие меланина приводит к недостаточной (или отсутствующей) пигментации кожи, волос, сетчатки; повышенной чувствительности кожи к солнечному свету и нарушению зрения. 6)болезнь кленового сиропа- наследственная энзимопатия метаболизма аминокислот с разветвленной цепью. Заболевание связано с недостатком дегидрогеназы разветвленных а-кетокислот. В результате блока ферментативной реакции окислительного декарбоксилирования лейцина, изолейцина, валина эти аминокислоты и соответствующие им а-кетокислоты накапливаются в организме. Моча имеет характерный запах кленового сиропа. 53,54 II. СИНТЕЗ ПУРИНОВЫХ НУКЛЕОТИДОВ А. Образование 5-фосфорибозил-1-дифосфата Фосфорибозилдифосфат (ФРДФ), или фос-форибозилпирофосфат (ФРПФ) занимает центральное место в синтезе как пуриновых, так и пиримидиновых нуклеотидов (рис. 10-2). 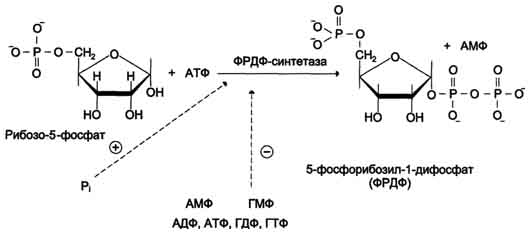 Рис. 10-2. Образование 5-фосфорибозил-1-дифосфата. Он образуется за счёт переноса β,γ-пирофосфатного остатка АТФ на рибозо-5-фосфат в реакции, катализируемой ФРДФ-синтетазой. Источниками рибозо-5-фосфата могут быть: пентозофосфатный путь превращения глюкозы или катаболизм нуклеозидов, в ходе которого под действием нуклеозидфосфорилазы первоначально образуется рибозо-1-фосфат, а затем с помощью соответствующей мутазы фосфатный остаток переносится в 5-положение. ФРДФ участвует не только в синтезе пуриновых и пиримидиновых нуклеотидов из простых предшественников (т.е. de novo), но используется на образование пуриновых нуклеотидов по "запасному" пути и в синтезе нуклеотидных коферментов. Б. Биосинтез пуриновых нуклеотидов DE NOVO Сборка пуринового гетероцикла осуществляется на остатке рибозо-5-фосфата при участии различных доноров углерода и азота ( 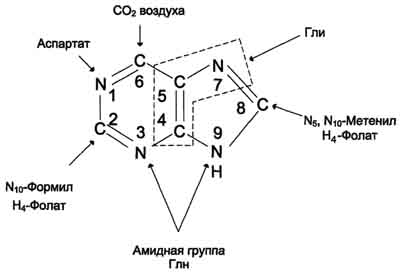 рис 10-3) рис 10-3)Рис. 10-3. Происхождение атомов С и N в пуриновом кольце. Включение простых предшественников в нуриновое кольцо с образованием ИМФ Первая специфическая реакция образования пуриновых нуклеотидов - перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1 -амина (рис. 10-4). Эту реакцию катализирует фермент амидофосфорибозилтрансфераза. При этом формируется β-N-гликозидная связь. Затем к аминогруппе 5-фосфорибозил-1-амина присоединяются остаток глицина, N5,N10-метенил-Н4-фолата ещё одна амидная группа глутамина, диоксид углерода, аминогруппа аспартата и формильный остаток N10-формил Н4-фолата. Результатом этой десятистадийной серии реакций является образование первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ), на синтез которого затрачивается не менее шести молекул АТФ. В отличие от прокариотов, у которых каждую стадию этого процесса катализирует отдельный фермент, у эукариотов за счёт слияния генов возникли полифункциональные ферменты, каждый из которых катализирует несколько реакций. В синтезе пуриновых нуклеотидов de novo это реакции 3,4 и 6, 7-8 и 10-11 соответственно. ИМФ в основном используется на синтез АМФ или ГМФ. Небольшое количество этого продукта обнаруживается также в тРНК в качестве одного из минорных нуклеотидов. Превращение ИМФ в АМФ и ГМФ в обоих случаях включает 2 стадии и идёт с затратой энергии (рис. 10-5). Аденилосукцинатсинтетаза, используя энергию ГТФ, присоединяет аспартат к ИМФ с образованием аденилосукцината, который в реакции, катализируемой аденилосукциназой, отщепляет фумарат и превращается в АМФ. Второй пуриновый нуклеотид (ГМФ) образуется также в 2 стадии. Сначала ИМФ окисляется NAD+-зависимой ИМФ-дегидрогеназой с образованием ксантозин-5'-монофосфата (КМФ). Последующее трансамидирование гидроксильной группы при С2-пуринового кольца КМФ катализирует ГМФ-синтетаза с использованием амидной группы Глн и энергии АТФ. При образовании пуриновых нуклеотидов ГТФ расходуется на синтез АМФ, а АТФ - на синтез ГМФ. Перекрёстное использование пуриновых нуклеозидтрифосфатов на образование конечных продуктов синтеза помогает поддерживать в клетках баланс адениловых и гуаниловых нуклеотидов. Печень - основное место образования пури-новых нуклеотидов, откуда они могут поступать в ткани, не способные к их синтезу: эритроциты, ПЯЛ и частично мозг. В. "Запасные" пути синтеза путиловых нуклеотидов (реутилизация азотистых оснований и нуклеозидов) Огромные затраты энергии для синтеза пуриновых нуклеотидов de novo не способны полностью обеспечить субстратами синтез нуклеиновых кислот в период гаструляции и раннего роста ребёнка. Потребность в большом количестве нуклеотидов привела к развитию "запасных" путей синтеза этих "дорогих" молекул. Наибольшее значение в этом процессе имеют ферменты, осуществляющие превращение пуринов в мононуклеотиды с использованием ФРДФ как донора остатка фосфорибозы. Синтез АМФ и ГМФ из аденина и гуанина ФРДФ-зависимое фосфорибозилирование пуринов катализируют 2 фермента. Аденинфосфорибозилтрансфераза, ответственная за образование АМФ (рис. 10-6). Гипоксантин-гуанинфосфорибозилтрансфераза, катализирующая образование ИМФ и ГМФ из гипоксантина и гуанина соответственно (рис. 10-7). Однако в организме при любых ситуациях этот путь синтеза пуриновых нуклеотидов, получивший название "путь спасения", имеет вспомогательное значение. Нуклеозидкиназы Нуклеозиды, получающиеся при катаболизме нуклеиновых кислот из нуклеотидов под действием нуклеотидаз, могут повторно фосфорилироваться, образуя нуклеозид-5'-монофосфаты за счёт переноса γ-фосфатного остатка АТФ на соответствующий субстрат. У млекопитающих такой путь пополнения запасов пуриновых нуклеотидов в клетке не имеет существенного значения. Основным ферментом этой группы является аденозинкиназа, которая ускоряет реакцию: Аденозин + АТФ → АМФ + АДФ. Из всех способов реутилизации пуринов наиболее активна гипоксантин-гуанинфосфорибозилтрансферазная реакция, поскольку ИМФ, образующийся в этой реакции, вовлекается в синтез АМФ и ГМФ. Использование гипоксантина и гуанина по запасному пути становится жизненно важным событием в клетках, не способных к синтезу пуриновых нуклеотидовde novo. Значение аденинфосфорибозилтрансферазы в повторном использовании аденина менее существенно. По сравнению с аденозином количество аденина в клетках мало, а первый возвращается в фонд нуклеотидов с помощью аденозинкиназы. 527  Рис. 10-6. Фосфорибозилирование аденина в АМФ.  Рис. 10-7. Фосфорибозилирование гипоксантина и гуанина с образованием ИМФ и ГМФ. Г. Регуляция синтеза пуриновых нуклеотидов Основным показателем, от которого зависит синтез пуриновых нуклеотидов, служит концентрация ФРДФ, которая, в свою очередь, зависит от скорости его синтеза, утилизации и разрушения. Количество ФРДФ определяется доступностью рибозо-5-фосфата и активностью ФРДФ синтетазы - фермента, чувствительного к концентрации фосфата и пуриновых нуклеотидов. Внутриклеточная концентрация ФРДФ строго регулируется и обычно низкая. ФРДФ синтетаза - аллостерический фермент. Он активируется неорганическим фосфатом (Рi) и ингибируется пуриновыми нуклеозид- моно-, ди- и трифосфатами, которые по эффективности ингибирования распределяются в следующем порядке: 528 НМФ > НДФ > НТФ (рис. 10-8). ФРДФ служит не только субстратом, но и аллостерическим активатором второй реакции синтеза пуринонуклеотидов de novo, которую катализирует амидофосфорибозилтрансфераза.  Рис. 10-8. Регуляция синтеза пуриновых нуклеотидов. 1 - ФРДФ синтетаза; 2 - амидофоофорибозилтрансфераза; 3 - ИМФ дегидрогеназа; 4 - аденилосукцинатсинтетаза. Пуриновые нуклеотиды, особенно АМФ и ГМФ по механизму отрицательной обратной св1язи ингабируют амидофосфорибозилтрансферазу, которая катализирует первую специфическую реакцию синтеза пуриновых нуклеотидов de novo. Метаболическая цепь образования АМФ и ГМФ de novo регулируется также в месте её разветвления: АМФ ингибирует аденилосукцинатсинтетазу, а ГМФ - реакцию образования ксантиловой кислоты, которую катализирует ИМФ дегидрогеназа. Перекрёстная регуляция путей использования ИМФ служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого. Помимо ферментов основного пути синтеза пуриновых нуклеотидов de novo, регулируется также активность ферментов "запасных" путей: аденинфосфорибозилтрансфераза ингибируется АМФ, а гипоксантин-гуанинфосфорибозилтрансфераза - ИМФ и ГМФ. Рис. 10-4. Синтез пуриновых нуклеотидов de novo. 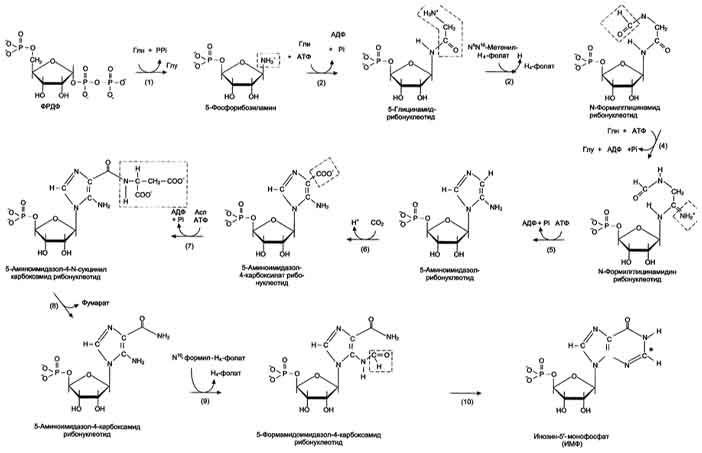 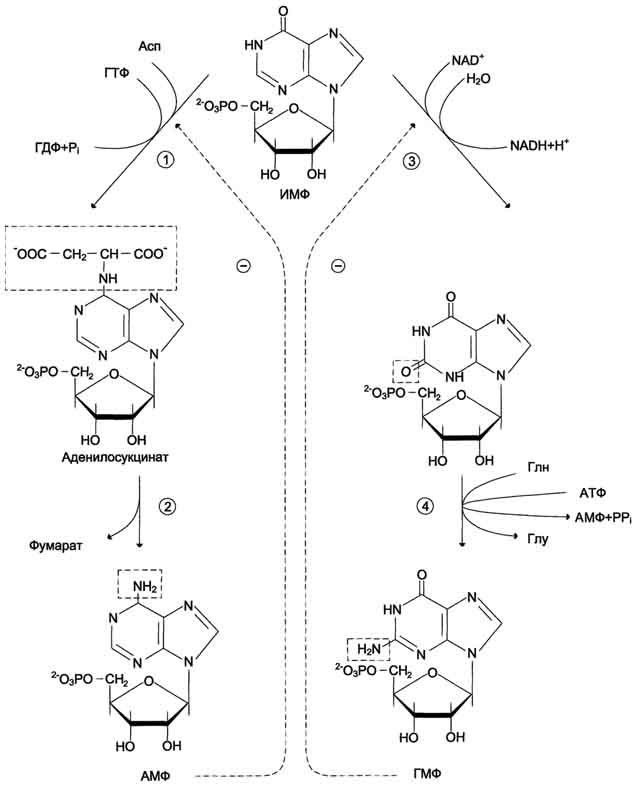 Рис. 10-5. Синтез АМФ и ГМФ из ИМФ. 1 - аденилосукцинатсинтетаза; 2 - аденилосукциназа; 3 - ИМФ-дегидрогеназа; 4 - ГМФ-синтетаза. 56. Синтез пиримидиновых нуклеотидов dе novo его регуляция Субстраты из простых предшественников: СО2, глутамина, и аспарагиновой кислоты и затем связывается с рибозо-5-фосфатом, полученным от ФРДФ. Процесс протекает в цитозоле клеток. Синтез ключевого пиримидинового нуклеотида - УМФ идёт с участием 3 ферментов, 2 из которых полифункциональны. Медленный,многостадийный,энергозатратный (13реак., -6АТФ), контролируется регул. ферментами ( ГМФ, ИМФ-дегидрогеназа, АМФ-аденилосукцинатсинтетаза, ФРПФ-синтаза,амидотрасфераза). Образование дигидрооротата У млекопитающих ключевой, регуляторной реакцией в синтезе пирймидиновых нуклеотидов является синтез карбамоилфосфата из глутамина, СО2 и АТФ, в реакции катализируемой кар-бамоилфосфатсинтетазой II (КФС II), которая протекает в цитозоле клеток (рис. 10-12). В реакции NH 2-гpyппa карбамоилфосфата образуется за счёт амидной группы глутамина, что отличает эту реакцию от реакции синтеза карбамоилфосфата в митохондриях в процессе синтеза мочевины из СО 2, NH 3 и АТФ с участием КФС I. Карбамоилфосфат, использующийся на образование пирймидиновых нуклеотидов, является продуктом полифункционального фермента, который наряду с активностью КФС II содержит каталитические центры аспартаттранскарбамоилазы и дигидрооротазы. Этот фермент назвали "КАД-фермент" - по начальным буквам ферментативных активностей, которыми обладают отдельные каталитические домены этого белка. Объединение первых трёх ферментов метаболического пути в единый полифункциональный комплекс позволяет использовать почти весь синтезированный в первой реакции карбамоилфос-фат на взаимодействие с аспартатом и образование карбамоиласпартата, от которого отщепляется вода и образуется циклический продукт - дигидрооротат. Отщепляясь от КАД-фермента, дигидрооротат подвергается дегидрированию NAD-зависимой дигидрооротатдегидрогеназой и превращается в свободное пиримидиновое основание - оротовую кислоту, или оротат. 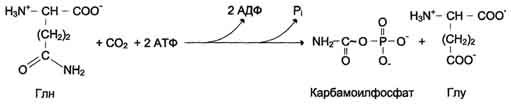 Образование УМФ В цитозоле оротат становится субстратом бифункционального фермента - УМФ-синтазы, которая обнаруживает оротатфосфорибозилтранс-феразную и ОМФ-декарбоксилазную активности. Первоначально фосфорибозильный остаток от ФРДФ переносится на оротат и образуется нук-леотид - оротидин-5'-монофосфат (ОМФ), декарбоксилирование которого даёт уридин-5-монофосфат (УМФ). Таким образом, шесть последовательных реакций синтеза пиримидиновых нуклеотидов осуществляются тремя ферментами, которые кодируются в геноме человека тремя различными структурными генами. Биосинтез УДФ, УТФ и иитидиловых нуклеотидов УМФ под действием специфических нуклео-зидмонофосфат (НМФ) и нуклеозиддифосфат (НДФ) киназ превращается в УДФ и УТФ в результате переноса γ-фосфатного остатка АТФ на соответствующий субстрат. НМФ-киназа катализирует следующую реакцию: УМФ + АТФ → УДФ + АДФ, а НДФ-киназа: УДФ + АТФ → УТФ + АДФ. ЦТФ синтетаза катализирует амидирование УТФ (рис, 10-14), осуществляя АТФ-зависимое замещение кетогругшы урацила на амидную группу глутамина с образованием цитидин-5'-трифосфата (ЦТФ). "Запасные" пути синтеза пиримидиновых нуклеотидов Субстраты свободные азот. основ. из путей катаболизма пуринов. Образование АМФ из аденина с пом. фер. аденинфосфорибозинтранс-за, ГМФ из гуанина с таким же фер., ИМФ из гипоксина с таким же фер. Процесс намного быстрее, но энергосберегающий. Отклонения: с-м Леша-Нихана- отсут. фермента, харак. умств. отсталость с опред. аутоагрессией. Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов с расщеплением пиримидинового кольца. В ресинтезе пиримидинов участвуют некоторые ферменты катаболизма нуклеотидов. Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина. Урацил + Рибозо-1-фосфат → Уридин + Н3РО4 . Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа. |
