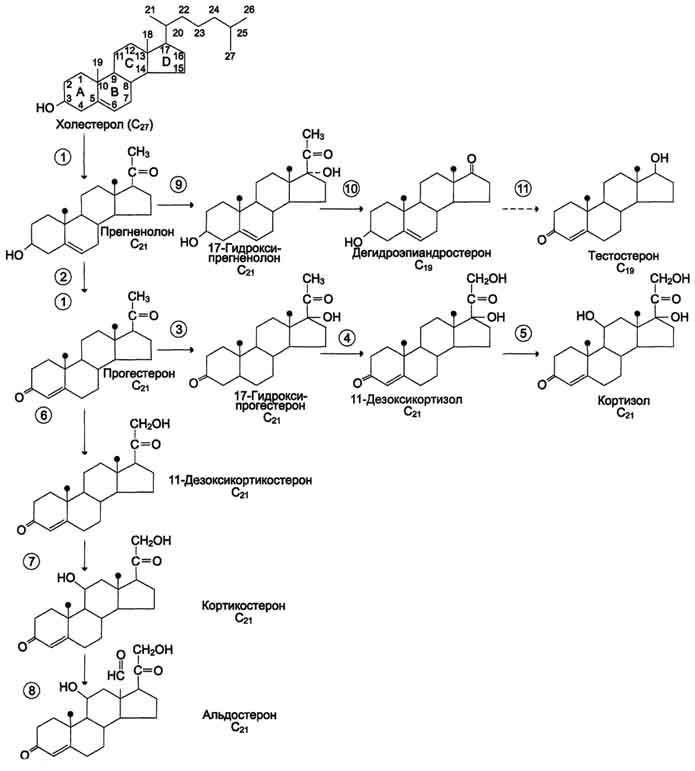
Г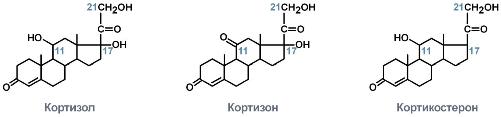 люкокортикоиды являются производными холестерола и имеют стероидную природу. Основным гормоном у человека является кортизол. Синтез осуществляется в сетчатой и пучковой зонах коры надпочечников. Образованный из холестерола прогестерон подвергается окислению17-гидроксилазойпо 17 атому углерода. После этого в действие вступают еще два ключевых фермента:11-гидроксилазаи21-гидроксилаза. В конечном итоге образуется кортизол. люкокортикоиды являются производными холестерола и имеют стероидную природу. Основным гормоном у человека является кортизол. Синтез осуществляется в сетчатой и пучковой зонах коры надпочечников. Образованный из холестерола прогестерон подвергается окислению17-гидроксилазойпо 17 атому углерода. После этого в действие вступают еще два ключевых фермента:11-гидроксилазаи21-гидроксилаза. В конечном итоге образуется кортизол.
Активируют: АКТГ, обеспечивающий нарастание концентрации кортизола в утренние часы, к концу дня содержание кортизола снова снижается. Кроме этого, имеется нервная стимуляция секреции гормонов.
Уменьшают: кортизол по механизму обратной отрицательной связи.
Механизм действия – ЦИТОЗОЛЬНЫЙ. Мишени и эффекты
Мишенью является мышечная, лимфоидная, эпителиальная(слизистые оболочки и кожа),жироваяи костнаяткани, печень.
Белковый обмен
значительное повышение катаболизма белков в мишеневых тканях. Однако в печени в целом стимулирует анаболизм белков.
стимуляция реакций трансаминирования через синтез аминотрансфераз, обеспечивающих удаление аминогрупп от аминокислот и получение углеродного скелета кетокислот,
Углеводный обмен
В целом вызывают повышениеконцентрации глюкозы крови:
усиление мощности глюконеогенеза из кетокислот за счет увеличения синтезафосфоенолпируват-карбоксикиназы,
увеличение синтеза гликогена в печени за счет активации фосфатаз и дефосфорилированиягликогенсинтазы.
снижение проницаемости мембран для глюкозы в инсулинзависимых тканях.
Липидный обмен
стимуляция липолиза в жировой ткани благодаря увеличению синтеза ТАГ-липазы, что усиливает эффект АКТГ, СТГ, глюкагона, катехоламинов, т.е. кортизол оказываетпермиссивное действие (англ. permission - позволение).
Водно-электролитный обмен
слабый минералокортикоидный эффект на канальцы почек вызывает реабсорбцию натрия и потерю калия,
потеря воды в результате подавления секреции вазопрессина и излишняя задержка натрия из-за увеличения активности ренин-ангиотензин-альдостероновой системы.
Противовоспалительное и иммунодепрессивное действие
увеличение перемещения лимфоцитов, моноцитов, эозинофилов и базофилов в лимфоидную ткань,
повышение уровня лейкоцитов в крови за счет их выброса из костного мозга и тканей,
подавление функций лейкоцитов и тканевых макрофагов через снижение синтезаэйкозаноидов посредством нарушения транскрипции ферментов фосфолипазы А2 ициклооксигеназы.
Другие эффекты
Повышает чувствительность бронхов и сосудов к катехоламинам, что обеспечивает нормальное функционирование сердечно-сосудистой и бронхолегочной систем.
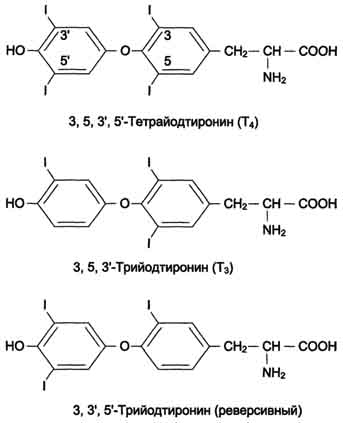
83,84. В щитовидной железе синтезируются гормоны - йодированные производные тирозина. Они объединены общим названием йодтиронины. К ним относят 3,5,3'-трийодтиронин (трийодтиронин, Т3) и 3,5,3',5'-тетрайодтиронин (Т4), или тироксин
Йодтиронины участвуют в регуляции многих процессов метаболизма, развития, клеточной дифференцировки, в регуляции экспрессии генов.
Заболевания, возникающие в результате нарушений синтеза, секреции и функций йодти-ронинов, - наиболее распространённые заболевания эндокринной системы.
1. Биосинтез йодтиронинов
Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) (рис. 11-18) в фолликулах, которые представляют собой морфологическую и функциональную единицу щитовидной железы.
Тиреоглобулин - гликопротеин с молекулярной массой 660 кД, содержащий 115 остатков тирозина. 8-10% массы тиреоглобулина представлено углеводами. Содержание йодида в организме составляет 0,2-1%.
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР Тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточный
коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов.
Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов.
Транспорт йода в клетки щитовидной железы. Йод в виде органических и неорганических соединений поступает в ЖКТ с пищей и питьевой водой. Суточная потребность в йоде составляет 150-200 мкг. 25-30% этого количества йодидов захватывается щитовидной железой. Транспорт йодида в клетки щитовидной железы - энергозависимый процесс и происходит при участии специального транспортного белка против электрохимического градиента (соотношение концентраций I- в железе к концентрации I- в сыворотке крови в норме составляет 25:1). Работа этого йодид-переносящего белка сопряжена с Nа+,К+-АТФ-азой.
Окисление йода. Окисление I- в I+ происходит при участии гемсодержащей тиреоперокси-дазы и Н2О2 в качестве окислителя.
568
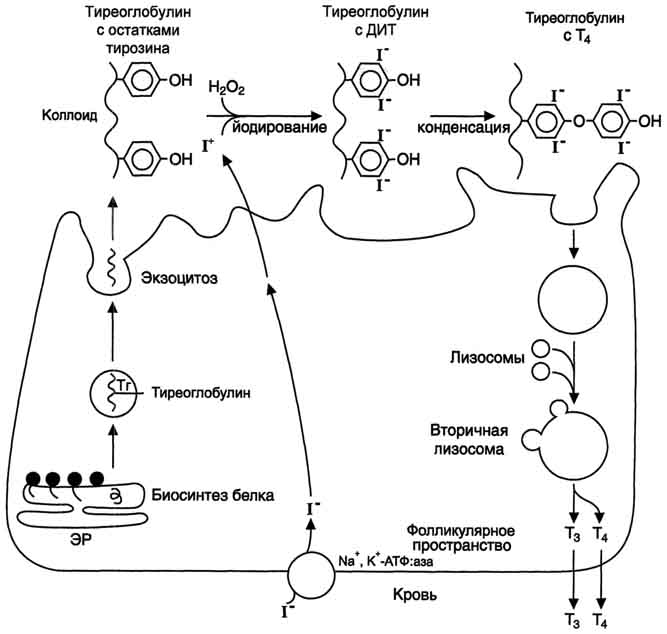 Схема синтеза йодтиронинов. Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3 - трийодтиронин, Т4 - тироксин. Схема синтеза йодтиронинов. Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3 - трийодтиронин, Т4 - тироксин.
Йодирование тирозина. Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой.
Образование йодтиронинов.
Биосинтез тиреоидных гормонов состоит из следующих этапов
1) аккумуляция щитовидной железой йодидов крови (I-) с помощью "йодидный насоса" и их окисления йодидпероксидазою до молекулярного йода:
- 2е-
2 I-  I; 2
2) синтез специфического белка коллоида щитовидной железы тиреоглобулина и йодирования его тирозиновых остатков с образованием монойодтирозинив (МИТ) и
дийодтирозинив (ДИТ). Тиреогло- булин - гликопротеин с м.м. 660 кД, что олигомерные структуру (составляется из двух субъединиц); в со- ди белка - 115 остатков тирозина, 15-20% которых подлежат йодированию;
3) преобразования йодсодержащих тиро- Зилов остатков на йодованитиро- нины (в составе молекулы тиреогло- Булин);
4) секреция йодированного тирео- глобулина в полость фолликула, где этот высокомолекулярный предшественник тиреоидных гормонов сохраняется в составе коллоида;
5) поглощения (в условиях физиоло- гических потребностей и стимуляции тирео- Тропин) йодированного белка тирео- цитамы, включение его в фаголизо- сомы, расщепление молекулы йодо- ного тиреоглобулина (лизосо- минимальными тиреокатепсинамы) с образованием свободных молекул трех йодтиронины (Т3 ) и тетрайод- тиронины (Т4) и выход их из ба зальные мембраны клеток в кровь.
Из двух йодсодержащих тиронины более активен Т3, специфическая гормональная активность которого превышающих соответствующую активность Т4 в 4-5 раз; в периферических тканях большая часть Т4 превращается в Т3, и суммарная биологическое действие ти- реоидних гормонов в организме на 90-95% обеспечивается именно Т3.
Транспорт и метаболизм йодтиронинов. От половины до двух третей Т3 и Т4 находятся в организме вне щитовидной железы. Большая часть их циркулирует в крови в связанной форме в комплексе с белками: тироксинсвязывающим глобулином (ТСГ) и тироксинсвязывающим преальбумином (ТСПА). ТСГ служит основным транспортным белком йодтиронинов, а также формой их депонирования. Он обладает более высоким сродством к Т3 и Т4 и в нормальных условиях связывает почти всё количество этих гормонов. Только 0,03% Т4 и 0,3% Т3 находятся в крови в свободной форме.
Т1/2 Т4 в плазме в 4-5 раз больше, чем Т3. Для Т4 этот период составляет около 7 дней, а для Т3 - 1-1,5 дня. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Т3 - основная биологически активная форма йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у Т4. В периферических тканях в результате дейодирования части Т4 по пятому углеродному атому образуется так называемая "реверсивная" форма Т3, которая почти полностью лишена биологической активности.
Другие пути метаболизма йодтиронинов включают полное дейодирование, дезаминирование или декарбоксилирование. Йодированные продукты катаболизма йодтиронинов конъюгируют-ся в печени с глюкуроновой или серной кислотами (см. раздел 12), секретируются с жёлчью, в кишечнике вновь всасываются, дейодируются в почках и выделяются с мочой.
2. Регуляция синтеза и секреции йодтиронинов
Скорость синтеза и секреции йодтиронинов регулируются гипоталамо-гипофизарной системой по механизму обратной связи (рис. 11-19).
Стимулом для повышения секреции тирео-либерина и тиреотропина служит снижение концентрации йодтиронинов в крови.
3. Механизм действия и биологические
функции йодтиронинов
Клетки-мишени йодтиронинов имеют 2 типа рецепторов к этим гормонам. Основные эффекты йодтиронинов - результат их взаимодействия с высокоспецифичными рецепторами, которые в комплексе с гормонами постоянно находятся в ядре и взаимодействуют с определёнными последовательностями ДНК, участвуя в регуляции экспрессии генов.
Другие рецепторы расположены в плазматической мембране клеток, но это не те же самые белки, что в ядре. Они обладают более низким сродством к йодтиронинам и, вероятно, обеспечивают связывание гормонов для удержания их в непосредственной близости к клетке.
При физиологической концентрации йодтиронинов их действие проявляется в ускорении белкового синтеза, стимуляции процессов роста и клеточной дифференцировки. В этом отношении йодтиронины - синергисты гормона роста. Кроме того, Т3 ускоряет транскрипцию гена гормона роста. У животных при дефиците Т3 клетки гипофиза теряют способность к синтезу гормона роста.
Очень высокие концентрации Т3 тормозят синтез белков и стимулируют катаболические
процессы, показателем чего служит отрицательный азотистый баланс.
Метаболические эффекты йодтиронинов относят в основном к энергетическому метаболизму, что проявляется в повышении поглощения клетками кислорода. Этот эффект проявляется во всех органах, кроме мозга, РЭС и гонад.
В разных клетках Т3 стимулирует работу Nа+,К+-АТФ-азы, на что затрачивается значительная часть энергии, утилизируемой клеткой.
В печени йодтиронины ускоряют гликолиз, синтез холестерола и синтез жёлчных кислот. В печени и жировой ткани Т3 повышает чувствительность клеток к действию адреналина и косвенно стимулирует липолиз в жировой ткани и мобилизацию гликогена в печени. В физиологических концентрациях Т3 увеличивает в мышцах потребление глюкозы, стимулирует синтез белков и увеличение мышечной массы, повышает чувствительность мышечных клеток к действию адреналина.
Йодтиронины также участвуют в формировании ответной реакции на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадренали-ну и стимулируя секрецию норадреналина (см. раздел 6).
4. Заболевания щитовидной железы
Гормоны щитовидной железы необходимы для нормального развития человека.
Гипотиреоз у новорождённых приводит к развитию кретинизма, который проявляется множественными врождёнными нарушениями и тяжёлой необратимой задержкой умственного развития.
Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса.
Наиболее тяжёлые формы гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки, обозначают термином "микседема" (от греч. туха - слизь, oedema - отёк). Отёчность обусловлена избыточным накоплением гликозаминогликанов и воды. В подкожной клетчатке накапливается глюкуроновая и в меньшей степени хондроитинсерная кислоты. Избыток гликозаминогликанов вызывает изменения коллоидной структуры межклеточного матрикса, усиливает его гидрофильность и связывает ионы натрия, что приводит к задержке воды.
Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи. Эти симптомы развиваются вследствие снижения основного обмена, скорости гликолиза, мобилизации гликогена и жиров, потребления глюкозы мышцами, уменьшения мышечной массы и снижения теплопродукции. При возникновении гипотиреоза у детей старшего возраста наблюдают отставание в росте без задержки умственного развития.
В настоящее время у взрослых людей частой причиной гипотиреоза является хронический аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото).
Гипотиреоз может быть также результатом недостаточного поступления йода в организм - эндемический зоб. Эндемический зоб (нетоксический зоб) часто встречается у людей, живущих в районах, где содержание йода в воде и почве недостаточно. Если поступление йода в организм снижается (ниже 100 мкг/сут), то уменьшается продукция йодтиронинов, что приводит к усилению секреции ТТГ (из-за ослабления действия йодтиронинов на гипофиз по механизму отрицательной обратной связи), под влиянием которого происходит компенсаторное увеличение размеров щитовидной железы (гиперплазия), но продукция йодтиронинов при этом не увеличивается.
Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) - наиболее распространённое заболевание щитовидной железы. При этом заболевании отмечают увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2-5 раз и развитие тиреотоксикоза.
Характерные признаки тиреотоксикоза: увеличение основного обмена, учащение сердцебиений, мышечная слабость, снижение массы тела (несмотря на повышенный аппетит) , потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Эти симптомы отражают одновременную стимуляцию йодтиронинами как анаболических (рост и дифференцировка тканей), так и катаболических (катаболизм углеводов, ли-пидов и белков) процессов. В большей мере усиливаются
процессы катаболизма, о чём свидетельствует отрицательный азотистый баланс.
Гипертиреоз может возникать в результате различных причин: развитие опухоли, тиреоидит, избыточное поступление йода и йодсодер-жащих препаратов, аутоиммунные реакции.
Болезнь Грейвса возникает в результате образования антител к тиреоидным антигенам. Один из них, иммуноглобулин (IgG), имитирует действие тиреотропина, взаимодействуя с рецепторами тиреотропина на мембране клеток щитовидной железы. Это приводит к диффузному разрастанию щитовидной железы и избыточной неконтролируемой продукции Т3 и Т4, поскольку образование IgG не регулируется по механизму обратной связи. Уровень ТТГ при этом заболевании снижен вследствие подавления функции гипофиза высокими концентрациями йодтиронинов.
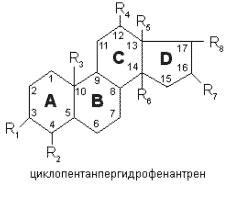
81. Стероидные гормоны - широкая группа биологически активных производных углеводорода стерана, что по химическому строению является замещенным циклопентанпергидрофенантрена:
Минералокортикоиды, С21-стероиды, необходимы для поддержания уровня Na+ и К+. Самый активный гормон этого класса – альдостерон
Минералокортикоиды стимулируют реабсорбцию Na+ в дистальных извитых канальцах и собирательных трубочках почек. Кроме того, они способствуют секреции К+, NH4+ в почках, а также в других эпителиальных тканях: потовых железах, слизистой оболочке кишечника и слюнных железах. В организме человека альдостерон - наиболее активный минералокортикоид.
82. Заболевания коры надпочечников могут проявиться симптомами как гипо-, так и гиперпродукции гормонов.
Большинство клинических проявлений надпочечниковой недостаточности обусловлено дефицитом глюкокортикоидов и минералокортикоидов.
Острая надпочечниковая недостаточность представляет большую угрозу для жизни, так как сопровождается декомпенсацией всех видов обмена и процессов адаптации. Она проявляется сосудистым коллапсом, резкой адинамией, потерей сознания. Такое состояние возникает вследствие нарушения обмена электролитов, которое приводит к потере ионов Na+ и Сl- с мочой, обезвоживанию за счёт потери внеклеточной жидкости, повышению уровня К+ в сыворотке крови, в межклеточной жидкости и клетках, в результате чего может нарушаться сократительная способность миокарда. Изменение углеводного обмена проявляется в снижении уровня сахара в крови, уменьшении запаса гликогена в печени и скелетных мышцах.
Острая недостаточность функции коры надпочечников может быть следствием декомпенсации хронических заболеваний, а также развивается у больных, лечившихся длительное время глюкокортикоидными препаратами по поводу неэндокринных заболеваний, например инфекционно-аллергических заболеваний.
В результате длительного приёма глюкокортикоидов подавляется функция гипоталамо-гипофизарно-надпочечниковой системы и развивается атрофия клеток коры надпочечников. Резкая отмена гормональных препаратов может сопровождаться острой надпочечниковой недостаточностью (так называемый синдром "отмены").
Первичная недостаточность надпочечников (болезнь Аддисона) развивается в результате поражения коры надпочечников туберкулёзным или аутоиммунным процессом. Основные клинические проявления выражаются в снижении массы тела, общей слабости, снижении аппетита, тошноте, рвоте, снижении АД и типичной для первичной надпочечниковой недостаточности гиперпигментацйи кожи ("бронзовая болезнь") . Причина гиперпигментации - повышение продукции ПОМК - предшественника АКТГ и меланоцитстимулирующего гормона.
Вторичная недостаточность надпочечников может развиться при дефиците АКТГ, что, в свою очередь, может быть следствием опухоли или инфекционного поражения гипофиза. При вторичной недостаточности надпочечников, в отличие от болезни Аддисона, отсутствует гиперпигментация.
При врождённой гиперплазии надпочечников нарушается синтез кортизола. В 95% случаев при этой патологии обнаруживается дефект 21-гидроксилазы (реже 11-гидроксилазы). Снижение продукции кортизола сопровождается увеличением секреции АКТГ, накоплением промежуточных продуктов синтеза кортикостероидов, в частности, предшественников андрогенов.
Избыток андрогенов ведёт к усилению роста тела, раннему половому созреванию у мальчиков и развитию мужских половых признаков у девочек (адреногенитальный синдром).
При частичной недостаточности 21-гидроксилазы у женщин может нарушаться менструальный цикл.
Гиперпродукция глюкокортикоидов (гиперкортицизм) может быть следствием повышения уровня АКТГ при опухолях гипофиза (болезнь Иценко-Кушинга) и опухолях других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества,
576
или избыточного синтеза кортизола при гормонально-активных опухолях коры надпочечников (синдром Иценко-Кушинга).
При гиперкортицизме наблюдаются гипергликемия и снижение толерантности к глюкозе, обусловленные стимуляцией глюконеогенеза ("стероидный диабет"), усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани. Характерно своеобразное перераспределение отложений жира ("лунообразное лицо", выступающий живот). Гипернатриемия, гипертензия, гипокалиемия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.
Для выявления первичной причины гиперкортицизма, помимо определения концентрации АКТГ в плазме крови, используют тесты с применением высоких доз синтетического глюкокортикоида дексаметазона (структурного аналога кортизола). Дексаметазон подавляет секрецию АКТГ по механизму отрицательной обратной связи.
Для болезни Иценко-Кушинга характерно снижение концентрации кортизола после применения дексаметазона более чем на 50%. Отсутствие реакции на введение дексаметазона может указывать на наличие опухоли надпочечников или внегипофизарной секреции АКТГ.
Основная патология мозгового вещества надпочечников - феохромоцитома, опухоль, образованная хромаффинными клетками и продуцирующая катехоламины. Клинически феохромоцитома проявляется повторяющимися приступами головной боли, сердцебиения, потливости, повышением АД и сопровождается характерными изменениями метаболизма
85. Биохимические характеристики гипо- и гиперфункции щитовидной железы.
Гиперфункция щитовидной железы (гипертиреоз)
Гиперфункция щитовидной железы является весьма распространенным заболеванием. Чаще отмечается у женщин, чем у мужчин, в отношении 7:1. Заболевание характеризуется чрезмерным выделением гормонов щитовидной железы (Т3 и Т4) и нарушением обратной связи между гипоталамусом, гипофизом и щитовидной железой.
Симптомы гиперфункции щитовидной железы — это потеря массы тела (несмотря на повышенный иногда аппетит), постоянное ощущение жара, усиленное сердцебиение (тахикардия), жажда, чрезмерное потоотделение, иногда значительная мышечная слабость, дрожание рук, повышенная нервная возбудимость. Эти симптомы могут быть поначалу незначительными, однако иногда сразу же проявляются остро.
Гиперфункция щитовидной железы может возникнуть после тяжелых нервных потрясений (личных переживаний), транспортной аварии, перенесенной инфекции, приема некоторых лекарств (например, под воздействием неконтролируемого приема йода, при передозировке принимаемых в лечебных целях гормонов щитовидной железы). Перемежающаяся гиперфункция может быть также вызвана воспалительным состоянием щитовидной железы.
Имеется также определенная наследственная предрасположенность к возникновению этих заболеваний.
Гиперфункция щитовидной железы проявляется чаще всего в виде базедовой болезни, преимущественно характеризующейся равномерным увеличением щитовидной железы, а в некоторых случаях пучеглазием. Пучеглазие может быть иногда весьма сильным, и тогда ему могут сопутствовать слезотечение, отек век, светобоязнь, двоение в глазах (диплопия).
Второй формой гиперфункции щитовидной железы является узловатый зоб с неравномерным узловатым разрастанием щитовидной железы без пучеглазия.
Первая форма возникает иногда внезапно у молодых людей, а вторая развивается медленно, чаще всего у пожилых, и ей могут сопутствовать нарушения со стороны системы кровообращения.
Каждый вид гиперфункции щитовидной железы требует лечения у врача. В отсутствие терапии гиперфункция, даже первоначально незначительная, может перейти в очень тяжелое болезненное состояние, называемое тиреотоксическим кризом.
Лечение гиперфункции щитовидной железы дает в целом хорошие результаты и в большинстве случаев заканчивается излечением.
Известно три способа лечения:
• фармакологическое;
• хирургическое;
• радиоизотопом радиоактивного йода.
Гипофункция щитовидной железы (гипотиреоз)
Гипофункция щитовидной железы возникает в результате отсутствия или уменьшения синтеза гормонов щитовидной железы. Это может быть вызвано врожденным отсутствием щитовидной железы, полным или частичным хирургическим удалением щитовидной железы, передозировкой лекарств, воздействующих на щитовидную железу, повреждением железы в результате воспалительного процесса или воздействия радиации (например, облучение шеи или грудной клетки рентгеновскими лучами после проводимого ранее лечения гиперфункции щитовидной железы радиоактивным йодом). Гипофункция щитовидной железы может также возникать по причинам, не связанным с собственно железой, а именно в результате повреждения гипофиза или гипоталамуса, что вызывает отсутствие или нарушение продукции гормонов, стимулирующих щитовидную железу (TSH и TRH) (вторичная гипофункция щитовидной железы).
Проявления гипофункции, независимо от ее причины, схожи: замедление всех метаболических процессов в организме; у детей происходит запаздывание в развитии, они имеют характерный внешний вид - открытый рот, большой язык, сухая шелушащаяся кожа (часто симптомом гипофункции бывает пупочная грыжа в результате ослабленности мышц живота).
Важной является ранняя диагностика гипофункции, поскольку отсутствие гормонов щитовидной железы ведет к нарушениям умственного и физического развития ребенка.
Гипофункция щитовидной железы у взрослых дает столь характерные симптомы, что опытный врач может ее диагностировать по внешнему виду пациента. Больной жалуется на чувство усиливающегося замедления мыслительных процессов и движения (хотя интеллект, в принципе, остается сохранным), кожа становится сухой, шелушащейся, отмечается постоянное чувство холода, часто отмечается ослабление слуха, голос становится хриплым, мышцы и суставы болезненными, лицо, особенно веки, отечными, иногда возникают отеки конечностей. Это так называемый гипотиреоидный отек (микседема).
Концентрация холестерина в сыворотке крови преимущественно повышена, часто отмечается анемия.
Без лечения гипофункция щитовидной железы может окончиться трагично и перейти в коматозное состояние, вывести из которого больного бывает очень трудно.
Несмотря на столь характерные симптомы, гипофункция щитовидной железы не всегда диагностируется, и ошибочно предпринимается лечение болезней почек, сердца, анемии или ревматизма.
86. Паратгормон: структура, механизм действия и роль в метаболизме кальция и фосфатов.
Па́ратирео́идный гормо́н (пара́тгормо́н, ПТГ, паратирин) — гормон, производимый околощитовидными железами. По химическому строению является одноцепочечным полипептидом, состоящим из 84 аминокислотных остатков, лишённым цистеина. Образуется в паращитовидных железах. Стимулом для секреции паратгормона в кровь является снижение концентрации катионов кальция в крови. Физиологическое действие паратгормона заключается в угнетении формирования костной ткани посредством влияния на популяцию остеобластов и остеоцитов.
Паратгормон опосредованно увеличивает канальцевую реабсорбцию катионов кальция, экскрецию фосфатов почками, а также кишечную абсорбцию кальция. Результатом действия паратгормона является повышение концентрации кальция в плазме крови и снижение содержания кальция в костях (деминерализация костного матрикса), снижение содержания фосфатов в плазме крови.
Паратгормон (ПТГ) - одноцепочечный полипептид, состоящий из 84 аминокислотных остатков (около 9,5 кД), действие которого направлено на повышение концентрации ионов кальция и снижение концентрации фосфатов в плазме крови.
1. Синтез и секреция ПТГ
ПТГ синтезируется в паращитовидных железах в виде предшественника - препрогормона, содержащего 115 аминокислотных остатков. Во время переноса в ЭР от препрогормона отщепляется сигнальный пептид, содержащий 25 аминокислотных остатков. Образующийся прогормон транспортируется в аппарат Гольджи, где происходит превращение предшественника в зрелый гормон, включающий 84 аминокислотных остатка (ПТГ1-84). Паратгормон упаковывается и хранится в секреторных гранулах (везикулах). Интактный паратгормон может расщепляться на короткие пептиды: N-концевые, С-концевые и срединные фрагменты. N-концевые пептиды, содержащие 34 аминокислотных остатка, обладают полной биологической активностью и секретируются железами наряду со зрелым паратгормоном. Именно N-концевой пептид отвечает за связывание с рецепторами на клетках-мишенях. Роль С-концевого фрагмента точно не установлена. Скорость распада гормона уменьшается при низкой концентрации ионов кальция и увеличивается, если концентрация ионов кальция высока.
Секреция ПТГ регулируется уровнем ионов кальция в плазме: гормон секретируется в ответ на снижение концентрации кальция в крови.
2. Роль паратгормона в регуляции обмена кальция и фосфатов
Органы-мишени для ПТГ - кости и почки. В клетках почек и костной ткани локализованы специфические рецепторы, которые взаимодействуют с паратгормоном, в результате чего инициируется каскад событий, приводящий к активации аденилатциклазы. Внутри клетки возрастает концентрация молекул цАМФ, действие которых стимулирует мобилизацию ионов кальция из внутриклеточных запасов. Ионы кальция активируют киназы, которые фосфорилируют особые белки, индуцирующие транскрипцию специфических генов.
В костной ткани рецепторы ПТГ локализованы на остеобластах и остеоцитах, но не обнаружены на остеокластах. При связывании паратгормона с рецепторами клеток-мишеней остеобласты начинают усиленно секретировать инсулиноподобный фактор роста 1 и цитокины. Эти вещества стимулируют метаболическую активность остеокластов. В частности, ускоряется образование ферментов, таких как щелочная фосфатаза и коллагеназа, которые воздействуют на компоненты костного матрикса, вызывают его распад, в результате чего происходит мобилизация Са2+ и фосфатов из кости во внеклеточную жидкость (рис. 1).
В почках ПТГ стимулирует реабсорбцию кальция в дистальных извитых канальцах и тем самым снижает экскрецию кальция с мочой, уменьшает реабсорбцию фосфатов.
Кроме того, паратгормон индуцирует синтез кальцитриола (1,25(OH)2D3), который усиливает всасывание кальция в кишечнике.
Таким образом, паратгормон восстанавливает нормальный уровень ионов кальция во внеклеточной жидкости как путём прямого воздействия на кости и почки, так и действуя опосредованно (через стимуляцию синтеза кальцитриола) на слизистую оболочку кишечника, увеличивая в этом случае эффективность всасывания Са2+ в кишечнике. Снижая реабсорбцию фосфатов из почек, паратгормон способствует уменьшению концентрации фосфатов во внеклеточной жидкости.
3. Гиперпаратиреоз
При первичном гиперпаратиреозе нарушается механизм подавления секреции паратгормона в ответ на гиперкальциемию. Это заболевание встречается с частотой 1:1000. Причинами могут быть опухоль околощитовидной железы (80%) или диффузная гиперплазия желёз, в некоторых случаях рак паращитовидной железы (менее 2%). Избыточная секреция паратгормона приводит к повышению мобилизации кальция и фосфатов из костной ткани, усилению реабсорбции кальция и выведению фосфатов в почках. Вследствие этого возникает гиперкальциемия, которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляются общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц, увеличивается риск переломов позвоночника, бедренных костей и костей предплечья. Увеличение концентрации фосфата и ионов кальция в почечных канальцах может служить причиной образования в почках камней и приводит к гиперфосфатурии и гипофосфатемии.
Вторичный гиперпаратиреоз встречается при хронической почечной недостаточности и дефиците витамина D3 и сопровождается гипокальциемией, связанной в основном с нарушением всасывания кальция в кишечнике из-за угнетения образования кальцитриола поражёнными почками. В этом случае секреция паратгормона увеличивается. Однако повышенный уровень паратгормона не может нормализовать концентрацию ионов кальция в плазме крови вследствие нарушения синтеза кальцитриола и снижения всасывания кальция в кишечнике. Наряду с гипокальциемией, нередко наблюдают гиперфостатемию. У больных развивается повреждение скелета (остеопороз) вследствие повышения мобилизации кальция из костной ткани. В некоторых случаях (при развитии аденомы или гиперплазии околощитовидных желёз) автономная гиперсекреция паратгормона компенсирует гипокальциемию и приводит к гипер-кальциемии (третичный гиперпаратиреоз).
4. Гипопаратиреоз
Основной симптом гипопаратиреоза, обусловленный недостаточностью паращитовидных желёз, - гипокальциемия. Понижение концентрации ионов кальция в крови может вызвать неврологические, офтальмологические нарушения и нарушения ССС, а также поражения соединительной ткани. У больного гипопарати-реозом отмечают повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
87. Кальцитонин: структура, механизм действия и роль в метаболизме кальция и фосфатов.
Кальцитонин — это одноцепочечный пептид из 32 аминокислот. Восемь из них, включая С-концевой пролинамид и цистеины в положениях 1 и 7 (образующие дисульфидный мостик), консервативны и необходимы для проявления биологической активности гормона
Кальцитонин- полипептидный гормон, регулятор кальциево-фосфорного обмена, вырабатываемый у млекопитающих и у человека парафолликулярными клетками щитовидной железой, паращитовидной железой и вилочковой железой. Кальцитонин принимает участие в регуляции фосфорно-кальциевого обмена в организме, а также баланса активности остеокластов и остеобластов, функциональный антагонист паратгормона. Кальцитонин понижает содержание кальция и фосфата в плазме крови за счёт усиления захвата кальция и фосфата остеобластами. Он также стимулирует размножение и функциональную активность остеобластов. Одновременно кальцитонин тормозит размножение и функциональную активность остеокластов и процессы резорбции кости.
88. Кальцитриол: структура, этапы синтеза, механизм действия и роль в метаболизме кальция и фосфатов. Рахит.
Витамин D регулирует обмен кальция. Этот витамин должен присутствовать в крови в достаточном количестве, чтобы обеспечивать всасывание кальция в кишечнике. Хотя его называют витамином, на самом деле он представляет собой гормон, который вместе с ПТГ выполняет функцию основного регулятора концентрации кальция в крови. Витамин D обладает типичными признаками гормона:
1) он синтезируется в коже, причем в идеальных условиях этого синтеза может быть вполне достаточно (то есть поступление его с пищей может быть и не обязательным),
2) он переносится с кровью к другим органам, где активируется строго регулируемыми ферментами,
3) его активная форма (кальцитриол) связывается со специфическими рецепторами тканей-мишеней, что приводит в конечном счете к повышению концентрации кальция в крови.
Кальцитриоловые рецепторы имеются на многих клетках, включая клетки костного мозга, лимфоциты, эпидермальные клетки, клетки островков поджелудочной железы, мышечные и нервные клетки; активация этих рецепторов сопровождается разнообразными эффектами, не связанными с обменом кальция. Витамин D поддерживает нормальные концентрации кальция и фосфата в плазме посредством следующих механизмов:
1) усиление всасывания этих ионов в тонкой кишке,
2) их высвобождение из костей,
3) снижение их почечной экскреции.
Рахит — заболевание детей грудного и раннего возраста, протекающее с нарушением образования костей и недостаточностью их минерализации, обусловленное главным образом дефицитом кальция и его активных форм в период наиболее интенсивного роста организма.. Витамин D в отличие от других витаминов не только поступает в организм с пищей, но и образуется в коже под действием солнечных лучей и искусственного УФ облучения. Витамин D регулирует обмен кальция и фосфора и необходим для нормального образования костей. Он повышает всасывание этих минеральных веществ пищи из кишечника, способствует их усвоению организмом и отложению в костях. Соответственно, выделяют следующие основные пpичины возникновения pахита:
• недостаточное пpебывание под солнечными лучами (недостаток ультрафиолета) — поэтому риск развития рахита увеличивается зимой;
• недостаточное поступление витамина D с пищей и дефицит минеpальных веществ в pационе питания.
Кpоме того, рахит может возникать вследствие:
• лечения пpотивосудоpожными пpепаpатами;
• наpушенного всасывания витамина D в кишечнике пpи некотоpых заболеваниях и др.
89. Проявления гипо- и гиперкальциемии.
Гиперкальциемия:
Причины: гиперпаратиреоз
Проявления: Изменения в костях ( фиброзная остеодистрофия, остеопароз, остеомаляция, десквамация костей, множественные переломы, образование кист, расшатывание и выпадение зубов)
Почки: почено-каменная болезнь и ХПН.
Миалгии.
Кальцификация сосудов, клапанов сердца, артериальная гипертензия.
Осложнения: гиперпаратиреоидный криз
Гипокальциемия:
Причины: снижение количества паратгормона
Нарушение секреции кальцитонина
Проявления: в крови: нарушение мембранного транспорта и как следствие нарушение соотношения K-Na внутри и вне клетки.
Повешенная возбудимость мышечной и нервной тканей и судороги, как следствие- сардоническая улыбка, эпистотонус, ларингоспазм.
Спазм гладких мышц, отсюда – боль.
Остеосклероз, кальцификация хрящей, закрытие зон роста, кариес зубов, замедление их прорезывания, открытый прикус, пародонтоз.
90. Эйкозаноиды:классификация, этапы бисинтеза, примеры соединений. Биологические эффекты эйкозаноидов. Механизм действия нестероидных противовоспалительных препаратов на примере аспирина.
Эйкозаноиды -это большая группа веществ, которые могут синтезироваться почти всеми типами клеток, за исключением эритроцитов, и как гормоны местного действия оказывают эффекты по паракринному или аутокринному механизму через специфические рецепторы. Главные биологические эффекты эйкозаноидов:
• участвуют в регуляции сокращений гладкой мускулатуры (разные типы эйкозаноидов вызывают вазоконстрикцию или вазодилатацию, бронхоконстрикцию или бронходилатацию);
• регулируют экскрецию воды и Na+ почками и артериальное давление;
• участвуют в развитии воспаления;
• регулируют свертываемость крови
Исходными субстратами для синтеза эйкозаноидов являются полиеновые жирные кислоты с 20 атомами углерода («эйкоза» по-гречески - 20). Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота .
В разных тканях из арахидоновой кислоты под действием специфического для этой ткани набора ферментов образуются различные эйкозаноиды. Обычно в каждом типе клеток синтезируется преимущественно один тип эйкозаноидов.
Ингибиторами синтеза эйкозаноидов являются:
- глюкокортикоиды, которые индуцируют синтез группы белков - липокортинов, ингибирующих активность фосфолипазы А2, и таким образом подавляют синтез всех типов эйкозаноидов, участвующих в воспалении. Эти препараты обладают сильным противовоспалительным свойством, так как подавляют синтез всех эйкозаноидов.
- аспирин и другие нестероидные противовоспалительные препараты необратимо ингибируют циклооксигеназу
Биосинтез
После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеется 2 основных пути превращения арахидоновой кислоты: циклооксигеназный, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, и липоксигеназный, заканчивающийся образованием лейкотриенов. (Рис.4)
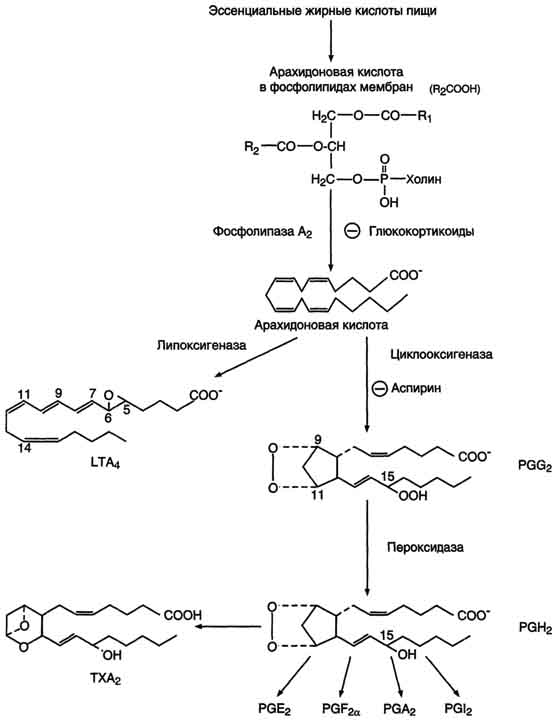 Нестероидные противовоспалительные препараты (НПВП) – это лекарственные препараты, которые обладают обезболивающими и жаропонижающими свойствами в сочетании с выраженной противовоспалительной активностью, которая по своей силе приближается к противовоспалительной активности стероидных гормонов, но препараты эти имеют другую химическую структуру.Самым первым препаратом этой группы был аспирин. Аспирин (международное непатентованное название - ацетилсалициловая кислота) относится к группе НПВП и обладает обезболивающим, жаропонижающим, противовоспалительным и антиагрегантным (предотвращает тромбообразование) действием. Механизм действия аспирина основан на том, что он угнетает действие ферментов циклооксигеназ, которые принимают участие синтезе простагландинов. Простагландины – это биологически активные жировые вещества, содержащиеся во всех органах и тканях организма. Они образуются из ненасыщенных жирных кислот под воздействием особых белков-ферментов - так называемых циклооксигеназ и обладают многогранной физиологической активностью, в том числе являются активными участниками воспалительных процессов. Аспирин угнетает действие циклооксигеназ, в результате чего снижается выработка простагландинов и, соответственно - уменьшаются их многочисленные и разнообразные эффекты, в том числе уменьшаются воспалительные процессы в тканях.Жаропонижающее и обезболивающее действие аспирина связано с его влиянием на центры терморегуляции и болевой чувствительности, которые находится в головном мозге.Аспирин также снижает тромбообразование, воздействуя на процессы агрегации (склеивания) тромбоцитов, поэтому он нашел применение в лечении и профилактике тромбозов.Из отрицательных воздействий на организм человека, прежде всего, нужно отметить его раздражающее действие на слизистую оболочку желудочно-кишечного тракта (вплоть до образования язв с последующим кровотечением) и способность вызывать аллергические реакции. Нестероидные противовоспалительные препараты (НПВП) – это лекарственные препараты, которые обладают обезболивающими и жаропонижающими свойствами в сочетании с выраженной противовоспалительной активностью, которая по своей силе приближается к противовоспалительной активности стероидных гормонов, но препараты эти имеют другую химическую структуру.Самым первым препаратом этой группы был аспирин. Аспирин (международное непатентованное название - ацетилсалициловая кислота) относится к группе НПВП и обладает обезболивающим, жаропонижающим, противовоспалительным и антиагрегантным (предотвращает тромбообразование) действием. Механизм действия аспирина основан на том, что он угнетает действие ферментов циклооксигеназ, которые принимают участие синтезе простагландинов. Простагландины – это биологически активные жировые вещества, содержащиеся во всех органах и тканях организма. Они образуются из ненасыщенных жирных кислот под воздействием особых белков-ферментов - так называемых циклооксигеназ и обладают многогранной физиологической активностью, в том числе являются активными участниками воспалительных процессов. Аспирин угнетает действие циклооксигеназ, в результате чего снижается выработка простагландинов и, соответственно - уменьшаются их многочисленные и разнообразные эффекты, в том числе уменьшаются воспалительные процессы в тканях.Жаропонижающее и обезболивающее действие аспирина связано с его влиянием на центры терморегуляции и болевой чувствительности, которые находится в головном мозге.Аспирин также снижает тромбообразование, воздействуя на процессы агрегации (склеивания) тромбоцитов, поэтому он нашел применение в лечении и профилактике тромбозов.Из отрицательных воздействий на организм человека, прежде всего, нужно отметить его раздражающее действие на слизистую оболочку желудочно-кишечного тракта (вплоть до образования язв с последующим кровотечением) и способность вызывать аллергические реакции.
91. Гормоны половых желез: классификация по химической структуре, механизм действия, регуляция их синтеза и секреции, влияние на обмен веществ.
А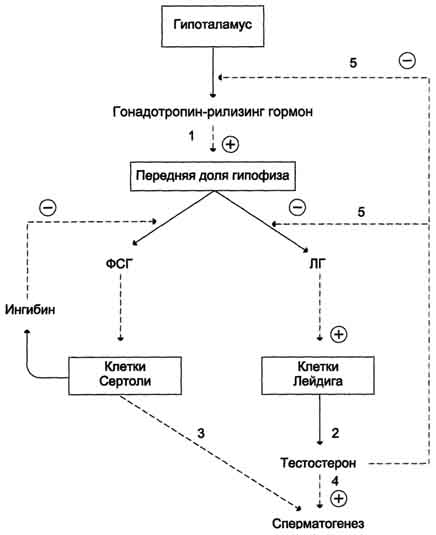 ндрогены( тестостерон , дигидротестостерон) ндрогены( тестостерон , дигидротестостерон)
Синтезируются в семенниках, частично в яичках и надпочечниках.
Стероидная природа, образуются из холестерола.
Механизм действия: по внутриклеточно-ядерному
Учавствуют в:
Половой дифференцировке и формировании вторичных половых признаков
Сперматогенезе
Характерном для мужчин поведении
Росте скелетно-мышечной системы
 Индукции синтеза ферментов тканевого дыхания и липолиза Индукции синтеза ферментов тканевого дыхания и липолиза
Гипофункция: Евнухоидизм, ожирение, ложная гинекомастия, крипторхизм (недоразвитие наружных половых органов).
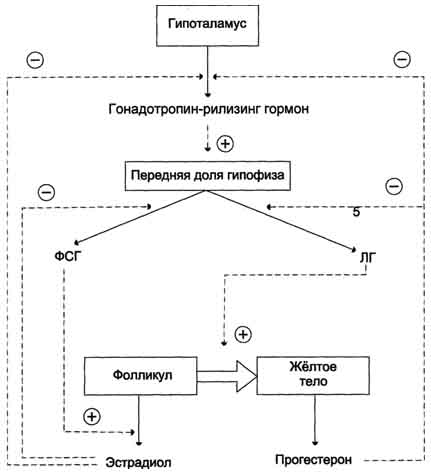
Эстрогены(эстрадиол,эстриол) Прогестины( прогестерон)
синтезируются в яичниках, желтом пятне, а также плаценте, коре надпочечников и небольшое количество в семенниках.
Стероидная природа, синтез заверш-ся ароматизацией 1 кольца с помощью аромотазы.
Механизм действия: по внутриклеточно-ядерному
Регулируют:
Половую дифференцировку
Формирование вторичных половых признаков
Овуляцию
Рост и развитие хрящей
Синтез белков и ферментов гликолиза, ПФП, липогенеза.
Гиперфункция прогестерона: Аменорея, увеличение молочных желез за счет из отечности, повышение либидо.
Гипофункция прогестерона: Дисменорея, уменьшение массы молочных желез, бесплодие.
92. Белки крови: общая характеристика, роль, отдельные представители. Белки острой фазы воспаления. Парапротеины.
Из 9-10% сухого остатка плазмы крови на долю белков приходится 6,5-8,5%. Белки плазмы крови: альбумин(40-50г/л), глобулины(20-30г/л), фибриноген(2-4г/л).Роль белков плазмы крови:
поддержание онкотического давления(за счет альбуминов); поддержание вязкости крови; участие в сверывающей системе крови; поддержание рН крови; поддержание иммунитета; поддержание уровня катионов в крови; резерв аминокислот; транспортная функция-перенос питательных веществ, метаболитов, гормонов, лекарственных веществ.
отдельные представители: глобулины, α2-макроглобулин, α1-антитрипсин, гаптоглобин, трансферрин, церулоплазмин, криоглобулин, С-реактивный белок, интерфероны.
Белки острой фазы синтезируются в печени.
Синтез белков острой фазы воспаления в печени стимулируют: 1). ИЛ-6, 2); ИЛ-1 и сходные с ним по действию (ИЛ-1 а, ИЛ-1Р, факторы некроза опухолей ФНО-ОС и ФНО-Р); 3). Глюкокортикоиды; 4). Факторы роста (инсулин, факторы роста гепатоцитов, фибробластов, тромбоцитов).
Выделяют 5 групп белков острой фазы:
1. К «главным» белкам острой фазы у человека относят С-реактивный белок (СРВ) и амилоидный А белок сыворотки крови. Уровень этих белков возрастает при повреждении очень быстро (в первые 6-8 часов) и значительно (в 20-100 раз, в отдельных случаях - в 1000 раз).
2. Белки, концентрация которых при воспалении может увеличиваться в 2-5 раз в течение 24 часов. Это кислый α1-гликопротеид, α1-антитрипсин, фибриноген, гаптоглобин.
3. Белки, концентрация которых при воспалении или не изменяется или повышается незначительно (на 20-60% от исходного). Это церулоплазмин, С3-компонент комплемента.
4. Белки, участвующие в острой фазе воспаления, концентрация которых, как правило, остается в пределах нормы. Это α1-макроглобулин, гемопексин, амилоидный Р белок сыворотки крови, иммуноглобулины.
5. Белки, концентрация которых при воспалении может снижаться на 30-60%. Это альбумин, трансферрин, ЛПВП, преальбумин. Уменьшение концентрации отдельных белков в острой фазе воспаления может быть обусловлено снижением синтеза, увеличением потребления, либо изменением их распределения в организме.
парапротеины
общее название белков, образующихся в организме при некоторых патологических состояниях; обычно П. называют иммуноглобулины, продуцируемые патологическим клоном иммунокомпетентных клеток при миеломной болезни
93. Небелковыекомпоненты плазмы крови. Остаточный азот плазмы крови. Понятие азотемии и причины ее возникновения.
Органические небелковые соединения плазмы делятся на две группы.I группа - азотсодержащие небелковые компоненты.
В состав небелкового азота крови входит азот промежуточных и конечных продуктов обмена простых и сложных белков. Раньше небелковый азот называли остаточный азот (остается после осаждения белков):
1) азот мочевины (50 %);2) азот аминокислот (25 %);3) низкомолекулярные пептиды;4) креатин;5) креатинин;6) билирубин;7) индикан;8) некоторые другие азотсодержащие вещества.
При некоторых заболеваниях почек, а также при патологии, сопровождающейся массивным разрушением белков (например, тяжелые ожоги), может повышаться небелковый азот крови, т. е. наблюдается азотемия. Однако наиболее часто нарушается не общее содержание небелкового азота в крови, а соотношение между отдельными компонентами небелкового азота. Поэтому сейчас в плазме определяют азот отдельных компонентов.
В понятие "остаточный азот" включают и низкомолекулярные пептиды. Среди низкомолекулярных пептидов есть много пептидов, обладающих высокой биологической активностью (например, гормоны пептидной природы).
II группа - безазотистые органические вещества.
К безазотистым (не содержат азот) органическим веществам плазмы крови относятся:
1) углеводы, липиды и продукты их метаболизма (глюкоза, ПВК, лактат, кетоновые тела, жирные кислоты, холестерин и его эфиры и др.);
2) минеральные вещества кров.
Азотемия – это нахождение в крови повышенного содержания азотистых продуктов переработки белка, сигнализирующее о развитии почечной недостаточности.Азотемию по причинам возникновения выделяют: ренальную, постренальную и преренальную. Рассмотрим основные факторы появления различных ее видов: Ренальная – развивается при остром тубулярном некрозе, остром гломерулонефрите (поражении паренхимы почек), острой почечной недостаточности, вследствие интоксикации химическими средствами, токсинами, нефротоксическими ядами и т. д. При данном виде азотемии может наблюдаться возникновение уремии; Преренальная – возникает из-за уменьшения уровня циркулирующей крови (при обезвоживании, сильной кровопотере и т. д.), шока, развития сердечной недостаточности, кровоизлияния; Постренальная – причинами азотемии этого типа являются любые механические преграды, препятствующие оттоку мочи: камни в мочеточнике, опухоли сжимающие уретру, гиперплазия простаты, беременность (увеличенная матка оказывает давление на мочеточник).
94. Ферменты сыворотки крови: их происхождение и значение для диагностики заболеваний.
Название фермента
|
Происхождение
|
Повышение
|
Понижение
|
Аминотрансферазы (трансаминазы)
Аланинаминотрансфераза (АлАТ) - фермент, который вырабатывается клетками печени и поступает в кровь, при их повреждении.
Аспартатаминотрансфераза (AсАT) - попадает в кровь при повреждении клеток печени, мышц (в том числе сердечной мышцы) и головного мозга
|
трансферазы
|
- при инфаркте миокарда (особенно повышена концентрация ACT);
- при остром вирусном гепатите (концентрация АЛТ выше, чем ACT);
- при циррозе печени (концентрация ACT выше, чем АЛТ);
- при опухолях печени;
- при мышечной дистрофии и дерматомиозите (повышается содержание ACT).
|
- недостаточность витамина В6 (пиридоксина);
- вследствие повторных процедур гемодиализа;
- почечная недостаточность;
- беременность
|
Гамма-глутамилтранспептидаза (ГГТП)
Фермент наиболее активен в печени, почках, поджелудочной железе.
|
пептидаза
|
- при заболеваниях печени (особенно алкогольном гепатите);
- при застойной сердечной недостаточности;
- при панкреатитах и опухолях поджелудочной железы;
- изредка — при инфаркте миокарда.
|
|
Амилаза
Амилаза образуется в поджелудочной железе и слюнных железах.
|
гидролаза
|
- острый панкреатит и хронический панкреатит;
- киста поджелудочной железы;
- закупорка протока поджелудочной железы, или его спазм;
- эпидемический паротит;
- иногда как следствие почечной недостаточности, прободений язвы желудка или двенадцатиперстной кишки и при диабетическом ацидозе.
|
-при гепатитах;
-при недостаточности функции поджелудочной железы;
-при токсикозе беременных
| Креатинфосфокиназа (КФК)
|
трансфераза
|
-при различных повреждениях мышц (инфаркт миокарда, травмы);
-при мышечной дистрофии;
-при миозите и сильной мышечной нагрузке (бег);
-при пониженной функции щитовидной железы;
-при инсульте
|
отмечается у людей, ведущих очень малоподвижный образ жизни, со сниженной мышечной массой, и большого клинического значения не имеет
|
Лактатдегидрогеназа (ЛДГ)
|
оксидоредуктаза
|
отмечается при любом повреждении тканей, содержащих АДГ в большом количестве (сердце, скелетные мышцы, печень, эритроциты)
|
|
Липаза — фермент, вырабатывающийся в поджелудочной железе и расщепляющий жиры.В норме содержание липазы в циркулирующей крови очень низкое.
|
эстераза
|
острой панкреатит, обострение хронического панкреатита или при закупорке протока поджелудочной железы.
|
| Щелочная фосфатаза
|
гидролаза
|
- при закупорке желчных протоков или их воспалении и иногда при застойной (холестатической) форме гепатита;
- при повреждении клеток печени вирусом гепатита, циррозе печени, раке печени, рахите, остеомаляции, опухолях костей, болезни Педжета, саркоидозе, повышенной функции паращитовидных желез.
- при заживлении переломов костей, при заболеваниях кишечника, у беременных женщин и у детей при нормальном росте костей повышение щелочной фосфатазы незначительное.
|
при гипотиреозе и при замедленном росте у детей
|
Кислая фосфатаза
|
гидролаза
|
у мужчин с большой долей вероятности свидетельствует о раке простаты.
Умеренное повышение активности кислой фосфатазы типично для простатитов, особенно после некоторых диагностических и лечебных манипуляций в области предстательной железы
|
|
Билирубин
|
Продукт распада гемоглобина
|
Непрямой билирубин. происходит при гемолитических анемиях или усиленном распаде эритроцитов по другой причине, а также при отсутствии или дефиците некоторых ферментов
Прямой и общий.
у здоровых людей, длительно соблюдающих низкокалорийную диету, или при голодании более 2 дней.
|
| |
 Скачать 6.2 Mb.
Скачать 6.2 Mb.


 Схема синтеза йодтиронинов. Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3 - трийодтиронин, Т4 - тироксин.
Схема синтеза йодтиронинов. Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3 - трийодтиронин, Т4 - тироксин.

 Нестероидные противовоспалительные препараты (НПВП) – это лекарственные препараты, которые обладают обезболивающими и жаропонижающими свойствами в сочетании с выраженной противовоспалительной активностью, которая по своей силе приближается к противовоспалительной активности стероидных гормонов, но препараты эти имеют другую химическую структуру.Самым первым препаратом этой группы был аспирин. Аспирин (международное непатентованное название - ацетилсалициловая кислота) относится к группе НПВП и обладает обезболивающим, жаропонижающим, противовоспалительным и антиагрегантным (предотвращает тромбообразование) действием. Механизм действия аспирина основан на том, что он угнетает действие ферментов циклооксигеназ, которые принимают участие синтезе простагландинов. Простагландины – это биологически активные жировые вещества, содержащиеся во всех органах и тканях организма. Они образуются из ненасыщенных жирных кислот под воздействием особых белков-ферментов - так называемых циклооксигеназ и обладают многогранной физиологической активностью, в том числе являются активными участниками воспалительных процессов. Аспирин угнетает действие циклооксигеназ, в результате чего снижается выработка простагландинов и, соответственно - уменьшаются их многочисленные и разнообразные эффекты, в том числе уменьшаются воспалительные процессы в тканях.Жаропонижающее и обезболивающее действие аспирина связано с его влиянием на центры терморегуляции и болевой чувствительности, которые находится в головном мозге.Аспирин также снижает тромбообразование, воздействуя на процессы агрегации (склеивания) тромбоцитов, поэтому он нашел применение в лечении и профилактике тромбозов.Из отрицательных воздействий на организм человека, прежде всего, нужно отметить его раздражающее действие на слизистую оболочку желудочно-кишечного тракта (вплоть до образования язв с последующим кровотечением) и способность вызывать аллергические реакции.
Нестероидные противовоспалительные препараты (НПВП) – это лекарственные препараты, которые обладают обезболивающими и жаропонижающими свойствами в сочетании с выраженной противовоспалительной активностью, которая по своей силе приближается к противовоспалительной активности стероидных гормонов, но препараты эти имеют другую химическую структуру.Самым первым препаратом этой группы был аспирин. Аспирин (международное непатентованное название - ацетилсалициловая кислота) относится к группе НПВП и обладает обезболивающим, жаропонижающим, противовоспалительным и антиагрегантным (предотвращает тромбообразование) действием. Механизм действия аспирина основан на том, что он угнетает действие ферментов циклооксигеназ, которые принимают участие синтезе простагландинов. Простагландины – это биологически активные жировые вещества, содержащиеся во всех органах и тканях организма. Они образуются из ненасыщенных жирных кислот под воздействием особых белков-ферментов - так называемых циклооксигеназ и обладают многогранной физиологической активностью, в том числе являются активными участниками воспалительных процессов. Аспирин угнетает действие циклооксигеназ, в результате чего снижается выработка простагландинов и, соответственно - уменьшаются их многочисленные и разнообразные эффекты, в том числе уменьшаются воспалительные процессы в тканях.Жаропонижающее и обезболивающее действие аспирина связано с его влиянием на центры терморегуляции и болевой чувствительности, которые находится в головном мозге.Аспирин также снижает тромбообразование, воздействуя на процессы агрегации (склеивания) тромбоцитов, поэтому он нашел применение в лечении и профилактике тромбозов.Из отрицательных воздействий на организм человека, прежде всего, нужно отметить его раздражающее действие на слизистую оболочку желудочно-кишечного тракта (вплоть до образования язв с последующим кровотечением) и способность вызывать аллергические реакции. ндрогены( тестостерон , дигидротестостерон)
ндрогены( тестостерон , дигидротестостерон)  Индукции синтеза ферментов тканевого дыхания и липолиза
Индукции синтеза ферментов тканевого дыхания и липолиза