АХ лабораторный практикум2012. Аналитическая химия лабораторный практикум
 Скачать 4.82 Mb. Скачать 4.82 Mb.
|
Определение солей аммония методом обратного титрованияЦель работы: определить массу NН4Cl в пробе (г). Сущность работы. Ион аммония NН4Cl + NaOHизбыток = NН3↑ + Н2О + NаCl Остаток щелочи после реакции с NН4Cl титруют стандартным раствором кислоты: NaOHостаток + HCl = NaCl + Н2О Оборудование и реактивы: мерная колба, пипетка, бюретка, конические колбы, электрическая плитка, стандартные растворы NaOH (или KOH) и HCl, индикатор метиловый оранжевый, универсальная индикаторная бумага. Выполнение работы
 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ Лабораторная работа № 14 Стандартизация раствора перманганата калия Цель работы: установить точную концентрацию раствора KMnO4. Сущность работы. Точную концентрацию раствора перманганата калия устанавливают через 8–10 дней после его приготовления по щавелевой кислоте H2C2O4 ∙ 2H2O или оксалату натрия Na2C2O4 и другим веществам. За это время происходит окисление восстановителей, присутствующих в дистиллированной воде (пыль, следы органических соединений), и концентрация KMnO4 стабилизируется. Оксалат натрия и щавелевая кислота являются наиболее удобными установочными веществами, так как они не токсичны и устойчивы при хранении. В основе титрования лежит реакция Факторы эквивалентности перманганата и оксалата определяются, исходя из полуреакций: Титрование оксалат-ионов перманганатом калия проводят в сильнокислой среде по следующим причинам: – образуются бесцветные ионы Mn2+, которые не мешают фиксировать конечную точку титрования; – окислительная способность KMnO4 в кислой среде намного выше, чем в нейтральной и слабощелочной среде: Среда создается избытком H2SO4. Нельзя использовать HNO3 и HCl, так как в их присутствии протекают побочные реакции. Реакция взаимодействия перманганата калия с оксалат-ионами относится к типу автокаталитических. Она катализируется продуктом реакции – ионами Mn2+. Первые капли KMnO4 даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов Mn2+ возрастает и скорость реакции увеличивается. Нагревание титруемого раствора способствует увеличению скорости реакции. Кроме того, при нагревании увеличивается величина скачка титрования, следовательно, повышается точность определения. Титрование проводится без индикатора, так как все продукты реакции бесцветны и одна лишняя капля KMnO4 после точки эквивалентности придаст раствору собственную малиновую окраску. Оборудование и реактивы: бюретка, пипетка Мора, конические колбы, мерная колба, мерный цилиндр (10–25 мл), электрическая плитка, 0,05 н. раствор KMnO4, кристаллический H2C2O4 ∙ 2H2O или Na2C2O4 (х. ч.), 2 н. раствор H2SO4. Выполнение работы. Навеску установочного вещества, рассчитанную для приготовления 0,05 н. раствора, взвешивают в тигле на технических весах, затем уточняют массу на аналитических весах и переносят вещество без потерь в мерную колбу. На тех же аналитических весах взвешивают тигель с остатками вещества и по разности определяют массу установочного вещества. Растворяют навеску в дистиллированной воде, разбавляют раствор до метки и тщательно перемешивают. Зная точную массу вещества и вместимость мерной колбы, вычисляют молярную концентрацию эквивалента оксалат-ионов в растворе. Заполняют бюретку раствором KMnO4 и устанавливают уровень жидкости на нуле. Отсчеты объема при титровании перманганатом калия целесообразно делать по верхнему краю мениска уровня жидкости, так как нижний край мениска не виден из-за интенсивной окраски раствора. Помещают в коническую колбу для титрования 10 мл 2 н. раствора H2SO4 и нагревают, не допуская закипания. Пипеткой берут из мерной колбы аликвотную часть раствора установочного вещества и вносят в нагретый раствор серной кислоты (нагревать и кипятить кислые растворы оксалатов не следует, так как они разлагаются). Горячий раствор титруют перманганатом калия по каплям, энергично перемешивая. Каждую следующую каплю прибавляют только после того, как исчезнет окраска от предыдущей. Титруют перманганатом до появления не исчезающей в течение 30 с слабо-розовой окраски. По результатам титрования рассчитывают точную концентрацию раствора перманганата калия, моль-экв/л. В некоторых случаях по указанию преподавателя раствор KMnO4 может быть приготовлен из фиксанала или установление концентрации KMnO4 может быть проведено по приготовленному из фиксанала раствору оксалата.
Лабораторная работа № 15 Перманганатометрическое определение восстановителей Цель работы: определить перманганатометрическим методом: – проба А – массу Fe2+ или соли Мора (NH4)2SO4 ∙ FeSO4·6H2O (г); – проба Б – окисляемость водопроводной или технологической воды (мг О2/л); – проба В – массовую долю нитритов в пищевой добавке Е 250 (%). Сущность работы. Перманганатометрическое титрование применяют преимущественно для определения веществ, играющих по отношению к KMnO4 роль восстановителей, таких, как H2O2, NO2–, Fe2+, карбоновые кислоты, соединения с гидразогруппами R–NH–NH–R, для определения общей окисляемости воды и почвы (т. е. для определения суммы восстановителей, присутствующих в этих объектах). Для этих целей используют прямое или обратное перманганатометрическое титрование в сильнокислой среде, которую создают добавлением раствора H2SO4. Фиксирование к. т. т. проводят без индикатора, поскольку первая лишняя капля раствора титранта KMnO4, добавленная после точки эквивалентности, окрашивает раствор в розовый цвет. Определение Fe2+ основано на реакции Факторы эквивалентности Fe2+ и MnO4– определяются, исходя из полуреакций:
Реакция окисления железа(II) перманганатом калия протекает быстро при комнатной температуре. Образующиеся при реакции ионы Fe3+ окрашивают раствор в желтый цвет, поэтому их маскируют, связывая в бесцветные фосфатные комплексы добавлением фосфорной кислоты. За счет этого переход окраски от бесцветной к розовой наблюдается более отчетливо. Окисляемость воды определяется количеством окислителя (или эквивалентным количеством кислорода), затраченным на окисление примесей. Окисляемость характеризует загрязненность воды органическими компонентами, а также сульфитами, сульфидами, хлоридами, нитритами и выражается массой (мг) кислорода, расходуемого на окисление 1 л воды. Например, окисляемость воды в производстве алкогольных и безалкогольных напитков не должна превышать 3 мг О2/л. Определение основано на окислении восстановителей, находящихся в воде, перманганатом в кислой среде. Поскольку некоторые из восстановителей окисляются медленно, то применяют «двойное» обратное титрование. В анализируемую воду вводят точно отмеренный избыток стандартного раствора KМnО4, затем – точно отмеренный избыток стандартного раствора щавелевой кислоты, которая взаимодействует с остатком KМnО4. Не вступившую в реакцию щавелевую кислоту титруют раствором перманганата калия и по полученным результатам рассчитывают окисляемость воды:  Определение нитритов основано на реакции Поскольку нитриты разлагаются в кислой среде с образованием оксидов азота то при проведении перманганатометрического титрования в кислой среде изменяют порядок титрования на обратный (реверсивное титрование): стандартный раствор перманганата титруют анализируемым раствором нитрита. Оборудование и реактивы: бюретка, пипетка Мора, мерная колба, коническая колба, мерный цилиндр (50–100 мл), стандартный раствор KMnO4, 2 н. раствор H2SO4. Для анализа пробы А дополнительно: H3РO4 (конц.) в капельнице. Для анализа пробы В дополнительно: электроплитка. Для анализа пробы Б: электроплитка, 0,01 моль/л стандартный раствор H2C2O4, 0,01 моль/дм3 стандартный раствор KMnO4, 2 моль/л раствор H2SO4, бюретка, пипетки Мора (10,00 и 100,00 мл), мерная колба (100,0 мл), конические колбы для титрования из термостойкого стекла (250 мл), мерный цилиндр (10 мл), химический стакан (100 мл), часовое стекло, водопроводная или технологическая вода. Выполнение работы Проба А. Fe2+или соль Мора. Получают у лаборантов анализируемый раствор в мерную колбу. К содержимому колбы прибавляют 20–40 мл 2 н. H2SO4, затем доводят объем дистиллированной водой до метки и перемешивают. Пипеткой берут из мерной колбы аликвотную часть анализируемого раствора и переносят в коническую колбу для титрования. Перед титрованием в раствор вводят 3–4 капли фосфорной кислоты из капельницы. Титруют до появления неисчезающей слабо-розовой окраски, вызываемой одной избыточной каплей раствора KMnO4. По полученным данным рассчитывают массу Fe2+ илисоли Мора (NH4)2SO4 ∙ FeSO4 ∙ 6H2O в пробе (г). Проба Б. Водопроводная или технологическая вода. В коническую колбу помещают 100,00 мл анализируемой воды, добавляют 5 мл серной кислоты и 10,00 мл стандартного раствора перманганата калия из бюретки. Закрывают колбу часовым стеклом, нагревают под тягой до кипения и кипятят 10 мин. К горячему раствору добавляют 10,00 мл стандартного раствора щавелевой кислоты, тщательно перемешивают. Обесцветившийся горячий раствор титруют раствором KМnО4 до появления устойчивой бледно-розовой окраски. Если концентрации стандартных растворов KMnO4 и H2C2O4 равны и для проведения реакций (3) и (4) взяты их одинаковые объемы, то объем раствора KMnO4, который затрачен на титрование по реакции (5), будет равен объему раствора KMnO4, пошедшему на взаимодействие с восстановителями в реакции (3). Следовательно, суммарную молярную концентрацию эквивалента восстановителей в анализируемой воде рассчитывают по формуле 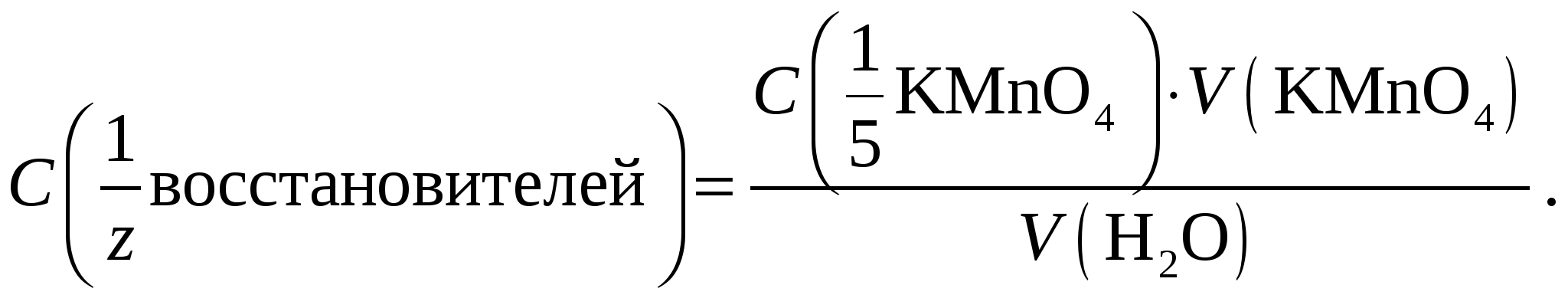 Далее переходят к расчету окисляемости воды, т. е. массовой концентрации О2, мг/л: 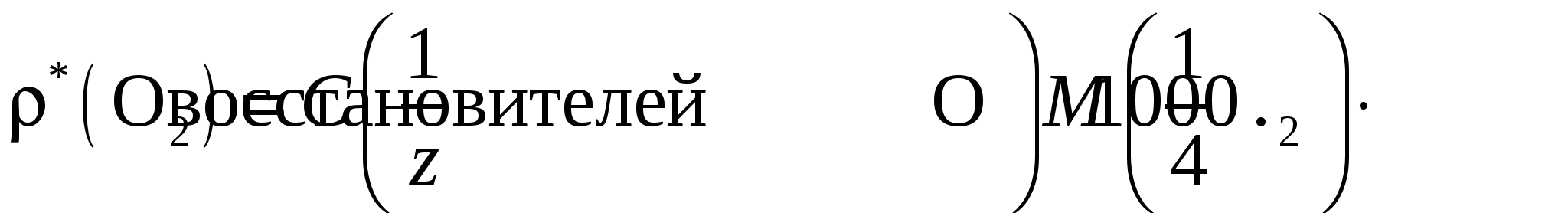 Фактор эквивалентности О2 определяется, исходя из полуреакции: Проба В. Нитриты. Поскольку для анализа предложена сухая смесь соли NaNO2 с индифферентными примесями (пищевая добавка Е 250), то рассчитывают ориентировочную навеску образца, необходимую для приготовления раствора NaNO2 заданной концентрации в имеющейся мерной колбе. Затем берут навеску на аналитических весах, переносят в мерную колбу, растворяют в дистиллированной воде, доводят до метки и перемешивают. Полученным раствором заполняют бюретку. В коническую колбу для титрования вместимостью 250 мл переносят пипеткой аликвотную часть стандартного раствора перманганата калия, добавляют 10 мл 2 н. раствора H2SO4 и 100 мл дистиллированной воды. Слегка нагрев разбавленный раствор перманганата калия, титруют его раствором нитрита натрия до обесцвечивания розовой окраски раствора от одной капли титранта. По результатам титрования рассчитывают массовую долю NaNO2 в образце (%).
Лабораторная работа № 16 Стандартизация раствора тиосульфата натрия Цель работы: установить точную концентрацию раствора Na2S2O3, моль-экв/л. Сущность работы. Рабочие растворы тиосульфата натрия готовят из перекристаллизованного препарата Na2S2O3 ∙ 5H2O с последующим установлением точной концентрации по иоду, дихромату калия, металлической меди или другому веществу. По точной навеске кристаллического тиосульфата натрия раствор не готовят, так как кристаллогидрат Na2S2O3 ∙ 5H2O выветривается, ионы Точную концентрацию раствора тиосульфата натрия устанавливают через 8–10 дней после приготовления. В качестве установочного вещества обычно применяют дихромат калия K2Cr2O7. Он не содержит кристаллизационной воды, растворы его очень устойчивы. При установке точной концентрации раствора тиосульфата натрия по дихромату калия применяют метод замещения. К определенному количеству раствора дихромата прибавляют избыток вспомогательного раствора иодида калия и кислоту, затем выделившийся I2 оттитровывают тиосульфатом натрия: Факторы эквивалентности веществ определяются на основании полуреакций: Для фиксирования конечной точки титрования используется специфический индикатор крахмал, образующий с иодом соединение интенсивно синего цвета. Крахмал добавляют вблизи конечной точки титрования, когда основное количество иода уже оттитровано. В противном случае крахмал образует очень прочное соединение с иодом, что приведет к перерасходу тиосульфата натрия. Оборудование и реактивы: мерная колба, бюретка, пипетка Мора, мерные цилиндры (10–20 мл), коническая колба большой вместимости (250 мл), часовые стекла, 0,05 н. раствор Na2S2O3, 10%-ный раствор KI, кристаллический K2Cr2O7 (х. ч.), 2 н. раствор H2SO4, раствор крахмала. Выполнение работы. Навеску K2Cr2O7, рассчитанную для приготовления 0,05 н. раствора в мерной колбе определенной вместимости, взвешивают на аналитических весах и переносят в мерную колбу. Растворяют навеску и доводят содержимое колбы до метки дистиллированной водой. Тщательно перемешивают полученный раствор и рассчитывают точную концентрацию K2Cr2O7 в нем (моль-экв/л). В коническую колбу помещают 10–15 мл KI и 10 мл 2 н. раствора H2SO4. К полученной смеси прибавляют пипеткой аликвотную часть раствора K2Cr2O7 и, накрыв колбу часовым стеклом, чтобы предупредить потери от улетучивания иода, оставляют смесь на 5 мин в темноте. Затем снимают часовое стекло и ополаскивают его над колбой дистиллированной водой. Прибавляют в колбу еще 100 мл воды, чтобы раствор сильно разбавился и ионы Cr3+ не мешали фиксированию конечной точки титрования своей собственной серо-синей окраской. Титруют содержимое колбы стандартным раствором тиосульфата до бледно-желтой окраски, которая указывает на то, что основная часть выделившегося иода уже оттитровалась. Затем прибавляют раствор крахмала до появления интенсивно-синей окраски и продолжают титровать далее до ее исчезновения. Титрование повторяют до получения результатов, отличающихся не более чем на 0,1 мл. По результатам титрования рассчитывают точную концентрацию раствора тиосульфата натрия, моль-экв/л; В некоторых случаях по указанию преподавателя раствор Na2S2O3 может быть приготовлен из фиксанала или установление концентрации тиосульфата натрия может быть проведено по приготовленному из фиксанала раствору K2Cr2O7.
Лабораторная работа № 17 Иодометрическое определение окислителей Цель работы: определить иодометрическим методом: – проба А – массу меди(II) или соли CuSO4 ∙ 5H2O в пробе (г); – проба Б – массовую концентрацию «активного хлора» в водопроводной воде (мг Cl2/л). | ||||||||||||||||||||||||
