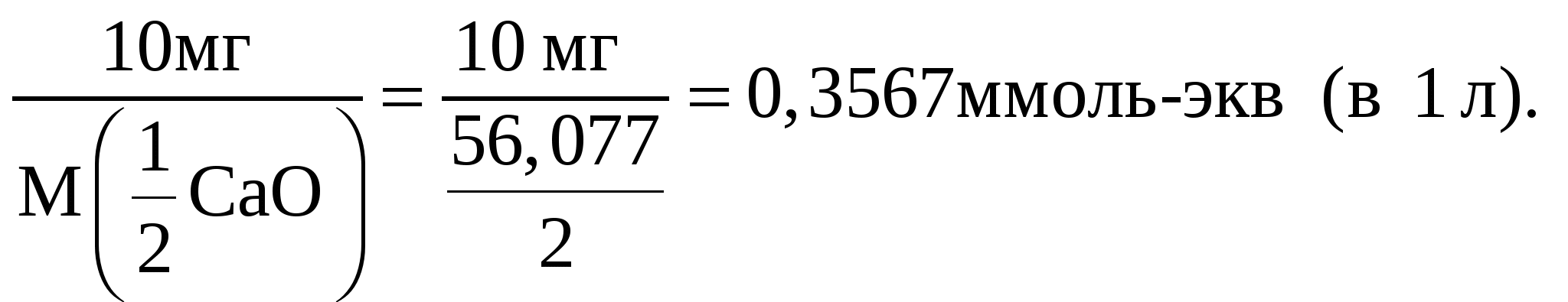АХ лабораторный практикум2012. Аналитическая химия лабораторный практикум
 Скачать 4.82 Mb. Скачать 4.82 Mb.
|
Сущность работы. В иодометрии применяют растворы восстановителей Na2S2O3 и KI, но прямое титрование ими окислителей невозможно, поскольку реакции между окислителями и Na2S2O3 идут нестехиометрично, а между окислителями и KI – медленно. Кроме того, раствор KI неустойчив и нет возможности зафиксировать к. т. т. при титровании этим раствором.Поэтому для определения окислителей используют титрование заместителя: окислитель замещают эквивалентным количеством иода, затем титруют выделившийся йод раствором тиосульфата: 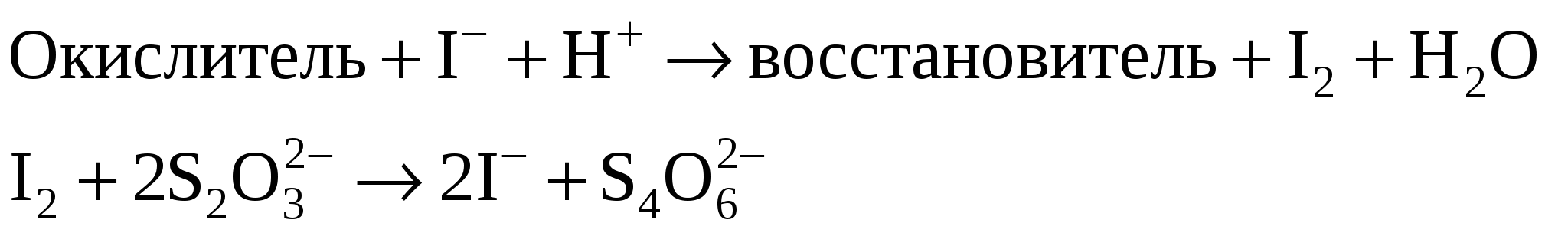 В качестве рабочего раствора используют стандартный раствор Na2S2O3, в качестве вспомогательных – растворы KI и Н2SO4. Специфический индикатор крахмал добавляют вблизи т. э. Определение Cu2+ основано на взаимодействии ионов Cu2+ с иодид-ионами и последующем титровании выделившегося иода стандартным раствором тиосульфата натрия: 2Cu2+ + 4I– = I2 + 2CuI↓ Значение стандартного потенциала пары I2/2I– (0,54 В) заметно превышает соответствующее значение пары Cu2+/Cu+ (0,16 В), поэтому окисление иодида ионами меди(II) представляется нереальным. Однако на самом деле реакция между Cu2+ и I– протекает количественно. Это обусловлено образованием малорастворимого осадка CuI, что существенно повышает потенциал пары Cu2+/Cu+. Реакцию следует проводить в кислой среде для подавления гидролиза ионов меди(II). Факторы эквивалентности веществ определяются на основании полуреакций: Cu2+ + е– = Cu+ fэкв(Cu2+) = 1 Определение «активного хлора». Под термином «активный хлор» понимают суммарное содержание в воде свободного хлора Cl2, хлорноватистой кислоты НСlO, гипохлорит-ионов СlO– и хлораминов NH2Cl, NHCl2, NCl3. При подкислении анализируемой воды и прибавлении к ней иодида калия все перечисленные вещества выделяют иод: Сl2 + 2I– = I2 + 2Сl– (6) СlO– + 2Н+ + 2I– = I2 + Сl– + Н2O НСlO + 2I– + Н+ = I2 + Сl– + Н2O NH2Cl + 2Н+ + 2I– = I2 + NH4+ + Cl– Выделившийся иод оттитровывают тиосульфатом натрия в присутствии крахмала. Содержание «активного хлора» выражают в мг/л в пересчете на хлор. Оборудование и реактивы: мерная колба, бюретка, пипетка Мора, мерные цилиндры (10–20 мл), коническая колба, часовые стекла. Для анализа пробы А: стандартный 0,05 н. раствор Na2S2O3, 5%-ный раствор KI, 2 н. раствор H2SO4, раствор крахмала. Для анализа пробы Б: стандартный 0,01 н. или 0,005 н. раствор Na2S2O3, KI (крист.), 30%-ный раствор CH3COOН, 0,5%-ный раствор крахмала, ацетатный буферный раствор с рН = 4,5. Выполнение работы Проба А. Cu2+ или соль CuSO4× 5H2O. Получают у лаборантов анализируемый раствор в мерную колбу, доводят объем дистиллированной водой до метки и тщательно перемешивают. Переносят пипеткой аликвотную часть раствора в коническую колбу, добавляют цилиндром 3 мл 2 н. раствора H2SO4 и 10–15 мл раствора KI. Накрыв колбу часовым стеклом, оставляют смесь в темноте на 5 мин для завершения реакции. В ходе реакции образуется I2, придающий раствору бурую окраску, и осадок CuI цвета слоновой кости, за счет чего раствор в колбе будет мутным. Выделившийся I2 начинают титровать тиосульфатом. Когда окраска раствора станет бледно-желтой, добавляют раствор крахмала до появления темно-синего окрашивания и продолжают титрование. В конечной точке титрования эта окраска исчезнет, в растворе останется только светлая муть (осадок CuI). По полученным данным рассчитывают массу меди(II) или соли CuSO4 × 5H2O в пробе (г). Проба Б. Определение «активного хлора». В коническую колбу, снабженную притертой стеклянной пробкой, наливают 50,00 или 100,00 мл анализируемой воды, вносят 0,5 г иодида калия и добавляют 10 мл уксусной кислоты. Через 5 мин оттитровывают выделившийся иод стандартным раствором тиосульфата натрия. В конце титрования прибавляют 1–2 мл раствора крахмала. При содержании «активного хлора» выше 1 мг/л используют 0,01 н. Na2S2O3, а при содержании от 0,1 до 1 мг/л – 0,005 н. Na2S2O3. По результатам титрования рассчитывают суммарную молярную концентрацию эквивалента хлорсодержащих соединений-окислителей в анализируемой воде: 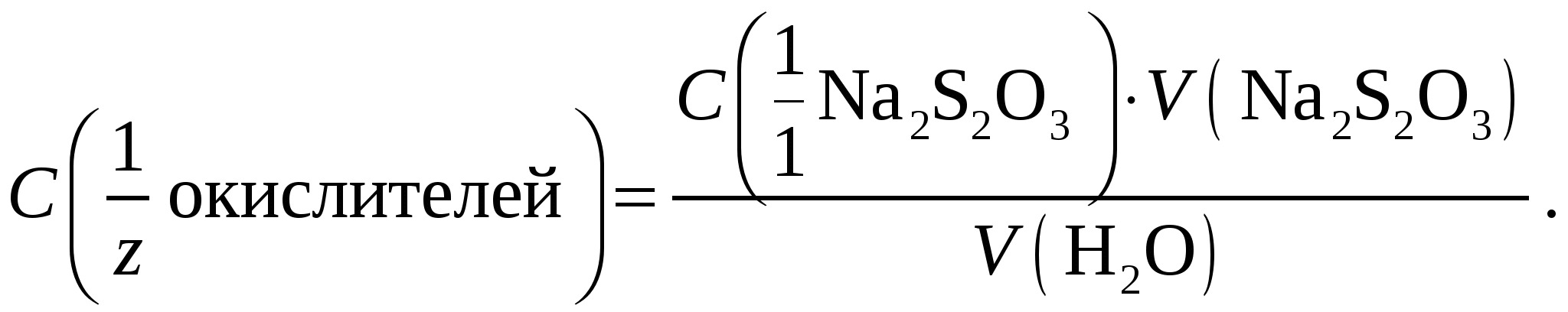 Далее переходят к расчету массовой концентрации «активного хлора» в пересчете на хлор (мг Cl2/л): 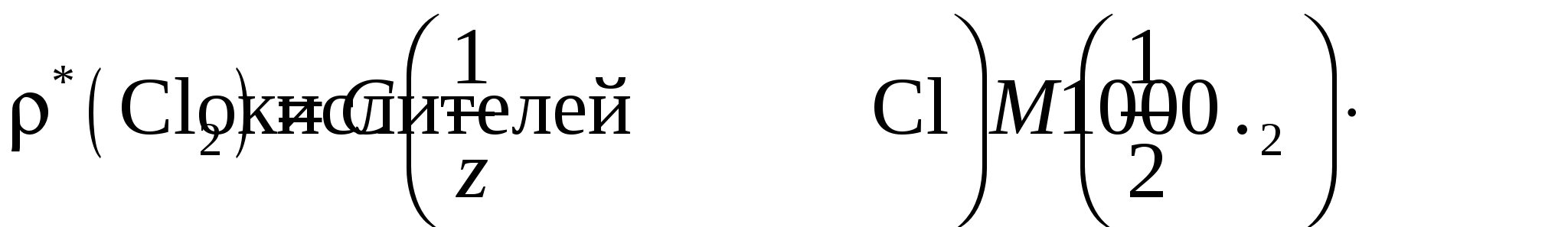 Фактор эквивалентности Cl2 определяется по полуреакции
 Комплексонометрическое титрование Лабораторная работа № 18 Стандартизация раствора комплексона III Цель работы: установить точную концентрацию раствора комплексона III (моль-экв/л). Сущность работы. Основным рабочим раствором в комплексонометрии является раствор комплексона III (ЭДТА, трилон Б). Для его приготовления применяют динатриевую соль этилендиаминтетрауксусной кислоты Na2C10H14O8N2 · 2H2O (условно – Na2H2YилиH2Y2–). Она легко получается в чистом виде, хорошо растворима в воде, растворы устойчивы при хранении. При обычных условиях препарат содержит примерно 0,3% влаги, поэтому титрованные растворы ЭДТА можно готовить по точной навеске (с учетом 0,3% H2O). Однако обычно его точную концентрацию устанавливают по раствору соли цинка. Определение основано на реакции взаимодействия комплексона III с ионами цинка в среде аммиачного буфера: Zn2+ + H2Y2– = ZnY2– + 2H+ В этой реакции fэкв(Zn2+) = Конечная точка титрования фиксируется с помощью индикатора эриохрома черного Т, который имеет синюю окраску, а его комплекс с ионами Zn2+ – сиреневую. Оборудование и реактивы: мерная колба, бюретка, пипетка Мора, мерный цилиндр (50–100 мл), коническая колба, 0,05 н. раствор комплексона III, кристаллический ZnSO4 ∙ 7H2O (х. ч.), аммиачный буфер с рН 9, индикатор эриохром черный Т в смеси с NaCl (1 : 100). Выполнение работы. Рассчитывают навеску соли ZnSO4 ∙ 7H2O, необходимую для приготовления требуемого объема 0,05 н. раствора. Взвешивают ее на аналитических весах, переносят в мерную колбу, растворяют в воде и доводят объем до метки. Рассчитывают точную концентрацию приготовленного раствора (моль-экв/л). В колбу для титрования переносят пипеткой аликвотную часть стандартного раствора соли цинка, добавляют 20–25 мл аммиачного буфера и индикатор на кончике шпателя. Титруют раствором комплексона III до перехода сиреневой окраски раствора в синюю. По результатам титрования рассчитывают точную концентрацию раствора комплексона III, моль-экв/л В некоторых случаях по указанию преподавателя раствор комплексона III может быть приготовлен из фиксанала или стандартизирован по растворам солей Zn(II), Mg(II) и др., приготовленным из фиксаналов.
Лабораторная работа № 19 Определение кальция и магния Цель работы: определить комплексонометрическим методом: – проба А – общую жесткость воды, ммоль экв/л; – проба Б – массу кальция и магния в пробе, г. Сущность работы. Ионы Са2+ и Mg2+ образуют комплексонаты, которые устойчивы в щелочной среде, поэтому их титруют стандартным раствором ЭДТА в присутствии аммиачного буфера. Если использовать индикатор эриохром черный Т, то в к. т. т. наблюдается переход окраски раствора от сиреневой (комплексы индикатора с Са2+ и Mg2+) к синей (свободная форма индикатора в этих условиях). Жесткость воды – это суммарный показатель качества воды. Она обусловлена наличием ионов Са2+ и Mg2+. Общая жесткость воды показывает, сколько миллимоль эквивалентов Са2+ и Mg2+ в сумме содержится в 1 л воды. Суммарное содержание Са2+ и Mg2+ определяют прямым титрованием пробы воды в аммонийном буфере стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т: Me2+ + H2Y2– = MeY2– + 2H+ fэкв(Me2+) = Поскольку концентрация Са2+ и Mg2+ в воде незначительна, для титрования берут большие аликвоты анализируемой воды (50,00 или 100,00 мл) с помощью специальных пипеток большой вместимости. Раздельное определениеСа2+ и Mg2+ при совместном присутствии в растворе основано на титровании пробы с разными индикаторами в разных условиях. Сначала определяют суммарное содержание кальция и магния в пробе. С этой целью титруют аликвоту анализируемого раствора комплексоном III с индикатором эриохромом черным Т в среде аммиачного буфера. При этом протекают следующие реакции: Ca2+ + H2Y2– = CaY2– + 2H+, Mg2+ + H2Y2– = MgY2– + 2H+ fэкв(Ca2+) = Затем определяют содержание кальция, титруя такую же аликвоту раствором ЭДТА с индикатором мурексидом в сильнощелочной среде. При добавлении щелочи ионы магния маскируются за счет осаждения в виде Mg(OH)2 и не реагируют с ЭДТА. Следовательно, титруются только ионы кальция: Ca2+ + H2Y2– = CaY2– + 2H+ Свободная форма индикатора мурексида в этих условиях имеет сиренево-фиолетовую окраску, а комплекс его с кальцием – кирпично-красную. Содержание магния в пробе находят по разности. Оборудование и реактивы: бюретка, мерный цилиндр (25 мл), стандартный раствор ЭДТА, аммиачный буфер с рН 9, индикатор эриохром черный Т в смеси с NaCl (1 : 100). Для анализа пробы А дополнительно: пипетка Мора большой вместимости (50,00 или 100,00 мл), конические колбы большой вместимости (250 мл). Для анализа пробы Б дополнительно: мерная колба, пипетка Мора, конические колбы, гранулированный NaOH, мурексид в смеси с NaCl (1 : 100). Выполнение работы Проба А. Определение общей жесткости воды. Получают у лаборантов анализируемый раствор в коническую колбу. Отбирают пипеткой аликвоту 50,00 или 100,00 мл и переносят в другую коническую колбу. Прибавляют 20–25 мл аммонийного буфера, индикатор на кончике шпателя и титруют раствором комплексона III до перехода окраски раствора от сиреневой к синей. По результатам титрования рассчитывают общую жесткость воды (ммоль-экв/л): 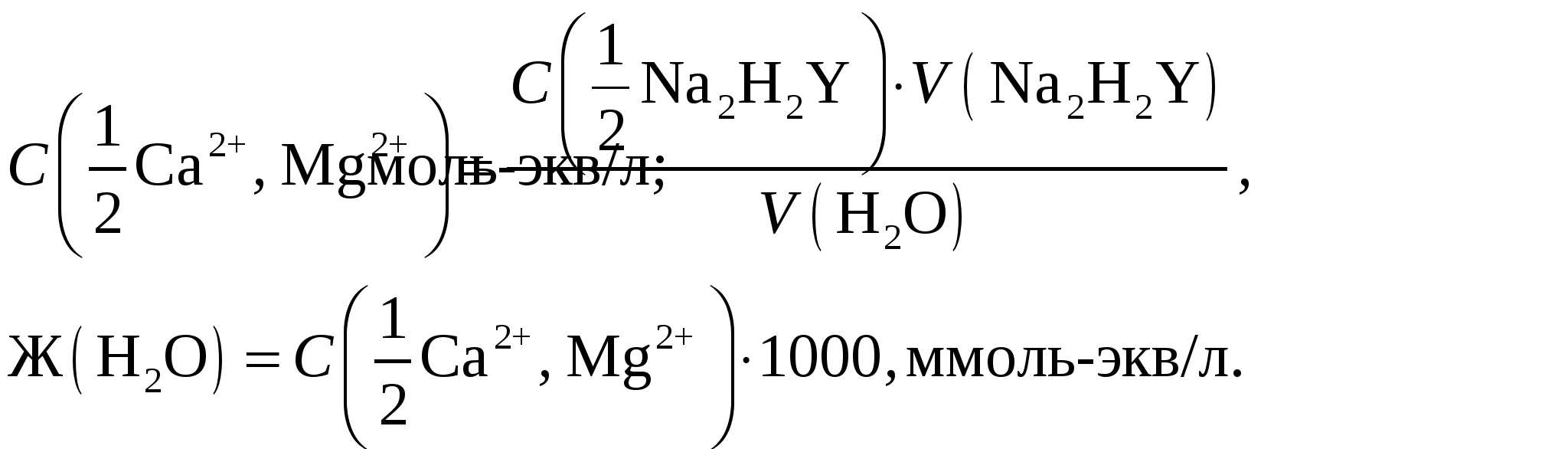 Делают вывод о характеристике воды, используя справочные данные (см. ). Проба Б. Раздельное определение кальция и магния. Получают у лаборантов анализируемый раствор в мерную колбу, доводят до метки и перемешивают. Для определения суммарной концентрации кальция и магния отбирают пипеткой аликвоту анализируемого раствора в колбу для титрования, добавляют 20–25 мл аммиачного буфера и индикатор эриохром черный Т на кончике шпателя. Титруют раствором ЭДТА до перехода сиреневой окраски раствора в синюю. Усредняют полученные близкие объемы ЭДТА и получают среднее значение объема титранта V1(Na2H2Y), который затрачен на титрование Ca2+ и Mg2+ в сумме. Для определения кальция отбирают пипеткой такую же аликвоту анализируемого раствора, вносят в него 2–3 гранулы NaOH (для создания сильнощелочной среды, проверить с помощью универсальной индикаторной бумаги!), мурексид на кончике шпателя и титруют раствором ЭДТА до перехода кирпично-красной окраски в сиренево-фиолетовую. Усредняют полученные близкие объемы ЭДТА и получают среднее значение объема титранта V2(Na2H2Y), который затрачен на титрование Ca2+. По разности находят объем титранта, пошедший на титрование Mg2+: V3(Na2H2Y) = V1(Na2H2Y) – V2(Na2H2Y). Исходя из полученных значений объемов V2(Na2H2Y) и V3(Na2H2Y), рассчитывают массу кальция и магния в пробе (г).
Лабораторная работа № 20 Комплексонометрическое определение ионов поливалентных металлов Цель работы: определить по указанию преподавателя массу определяемого иона металла в растворе (г) или массовую долю (%) соли металла в образце (табл. 15). Таблица 15 Задания для выполнения лабораторной работы
Сущность работы. Важнейшим достоинством комплексонометрии является возможность определения практически всех катионов поливалентных металлов. В зависимости от устойчивости комплексонатов металлов и их комплексов с индикатором, а также других особенностей титруемой системы применяют методы прямого, обратного титрования или титрования по замещению. Прямым титрованием определяют Mg2+, Ca2+, Zn2+, Cd2+, Pb2+, Co2+, Ni2+, Cu2+, Mn2+, Fe3+ и др. Если реакция с ЭДТА протекает слишком медленно (Al3+, Cr3+), отсутствует подходящий индикатор для условий существования иона в растворе (Hg2+), то применяют обратное титрование. Определение Co2+, Ni2+, Cu2+ основано на прямом комплексонометрическом титровании в присутствии мурексида при значении рH 7–8, которое поддерживается с помощью аммиачного буфера. При более высоких значениях pH происходит образование аммиачных комплексов Me2+ + 6NH3 = и разрушение комплекса металла с индикатором, что снижает точность титрования. Определение Fe3+ проводится прямым титрованием в присутствии сульфосалициловой кислоты при pH < 3. Для увеличения скорости реакции комплексообразования титрование лучше вести при температуре 60оС. Определение Al3+ проводится обратным титрованием солью цинка (II) в присутствии ксиленолового оранжевого или солью меди(II) в присутствии индикатора ПАН. Оборудование и реактивы: технические и аналитические весы, мерные колбы, бюретка, пипетка Мора, мерный цилиндр, конические колбы, стандартный раствор ЭДТА. Для анализа пробы А: аммиачный буферный раствор, мурексид. Для анализа пробы Б: ацетатный буферный раствор pH 2,5, 25 %-ный раствор сульфосалициловой кислоты, кислота для растворения сухой соли, водяная баня. Для анализа пробы В: кристаллический ZnSO4 · 7H2O, 0,25 М раствор ацетата натрия, 1 М раствор HCl, ксиленоловый оранжевый, водяная баня. Выполнение работы. Если проводят анализ раствора, то получают его в мерную колбу, доводят до метки дистиллированной водой и перемешивают. Затем отбирают отдельные аликвоты анализируемого раствора в колбы для титрования, создают необходимые условия и проводят титрование в соответствии с описанными ниже методиками. По результатам титрования рассчитывают массу определяемого иона в пробе (г). Если для анализа предложена сухая смесь соли с индифферентными примесями, то рассчитывают навеску соли, необходимую для приготовления раствора заданной концентрации в имеющейся мерной колбе. Затем берут навеску, переносят в мерную колбу, растворяют в дистиллированной воде (в случае солей Fe3+ – с добавлением кислоты), доводят до метки и перемешивают. Затем отбирают отдельные аликвоты полученного раствора в колбы для титрования, создают необходимые условия и проводят титрование в соответствии с описанными ниже методиками. По результатам титрования рассчитывают массовую долю кристаллогидрата в образце (%). Проба А. Определение Co2+,Ni2+,Cu2+. К аликвоте раствора медленно, по каплям, при перемешивании добавляют аммиачный буферный раствор. При этом вначале протекает образование осадка гидроксида металла, а затем его растворение с образованием аммиачного комплекса. Как только осадок растворится, добавление буферного раствора прекращают. К раствору добавляют мурексид на кончике шпателя и титруют раствором ЭДТА до перехода окраски к яркой фиолетово-сиреневой. Проба Б. Определение Fe3+. К аликвоте раствора добавляют 5 мл ацетатного буферного раствора, нагревают до 60оС, добавляют 1 мл раствора сульфосалициловой кислоты и титруют раствором ЭДТА до перехода окраски от красно-фиолетовой к бледно-желтой. Проба В. Определение Al3+. Готовят 0,05 н. стандартный раствор сульфата цинка по точной навеске, как описано в лабораторной работе № 18. К аликвоте раствора, содержащего Al3+, добавляют 20,00 мл стандартного раствора ЭДТА и 2 мл 1 М HCl. Нагревают до кипения и оставляют на кипящей водяной бане на 10 минут. После охлаждения добавляют в колбу 10 мл раствора ацетата натрия, ксиленоловый оранжевый на кончике шпателя и титруют раствором сульфата цинка до перехода окраски от желтой к красной.
Программа курса 1. ВВЕДЕНИЕ Предмет аналитической химии. Значение аналитической химии. Аналитический контроль технологических процессов. Классификация методов аналитической химии: методы разделения, методы обнаружения и методы определения. Цели и задачи методов. Общая схема аналитического определения. Выбор метода анализа. Отбор пробы и пробоподготовка. Метрологические основы аналитической химии. Статистическая обработка результатов анализа. 2. ОБЩИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ 2.1. Общие вопросы теории растворов Раствор как среда для проведения аналитических реакций. Влияние физико-химических характеристик растворителя на химико-аналитические свойства ионов. Основы теории сильных электролитов. Активность, коэффициент активности, ионная сила растворов. 2.2. Основные типы химических реакций, используемых в аналитической химии Кислотно-основное равновесие.Равновесие в водных растворах кислот, оснований и амфолитов. Буферные растворы, их состав и свойства. Расчет рН протолитических систем на основе теории Бренстеда–Лоури. Применение реакций кислотно-основного взаимодействия в аналитической химии. Значение буферных систем в химическом анализе. Окислительно-восстановительное равновесие.Сопряженная окислительно-восстановительная пара. Окислительно-восстановитель-ный потенциал и факторы, влияющие на его значение. Окислительно-восстановительные реакции, их константа равновесия, направление и скорость. Автокаталитические и индуцированные реакции, их роль в химическом анализе. Применение реакций окисления-восстановления в аналитической химии. Равновесие комплексообразования. Строение и свойства комплексных соединений. Полидентантные лиганды, хелатные комплексы, хелатный эффект. Равновесия в растворах комплексных соединений, константы устойчивости комплексных ионов. Использование реакций комплексообразования в аналитической химии. Равновесие в системе осадок–раствор. Гетерогенное химическое равновесие в растворах малорастворимых электролитов. Правило произведения растворимости и его использование в аналитической химии. Константа растворимости (произведение активностей). Факторы, влияющие на растворимость малорастворимых соединений: солевой эффект, влияние одноименных ионов и конкурирующих реакций. Использование гетерогенных систем в аналитических целях. 2.3. Органические аналитические реагенты Особенности органических аналитических реагентов: высокая чувствительность и избирательность действия. Применение органических аналитических реагентов в анализе. 3. Химические МЕТОДЫ РАЗДЕЛЕНИЯ И ОБНАРУЖЕНИЯ 3.1. Общие вопросы качественного анализа Цели и задачи качественного анализа. Классификация методов качественного анализа в зависимости от величины пробы. Техника эксперимента: качественные пробирочные, капельные и микрокристаллоскопические реакции. Аналитический эффект. Аналитические химические реакции и условия их проведения. Общие, групповые и характерные (селективные и специфические) реакции. Аналитические классификации катионов и анионов. Аналитические группы ионов и Периодический закон Д. И. Менделеева. Систематический и дробный качественный анализ. Использование реакций осаждения, комплексообразования, кислотно-основных и окислительно-восстановительных реакций в качественном анализе. Органические аналитические реагенты, их преимущества и применение в качественном анализе. 3.2. Методы разделения и обнаружения ионов, имеющих наибольшее значение в химической технологии I аналитическая группа катионов. Общая характеристика. Характерные реакции ионов Na+, K+, NH4+ и Mg2+. Методы разложения и удаления солей аммония. Систематический ход анализа смеси катионов I группы. II аналитическая группа катионов. Общая характеристика, групповой реагент. Характерные реакции ионов Ca2+ и Ba2+. Оптимальные условия осаждения катионов II группы. Систематический ход анализа смеси катионов II группы и смеси катионов I–II групп.III аналитическая группа катионов. Общая характеристика, групповой реагент. Характерные реакции ионов Al3+, Сr3+, Fe3+, Fe2+, Mn2+ и Zn2+. Оптимальные условия осаждения катионов III группы. Систематический ход анализа смеси катионов III группы и смеси катионов I–III групп. I аналитическая группа анионов. Общая характеристика, групповой реагент. Характерные реакции ионов CO32–, SO42–, PO43–. II аналитическая группа анионов. Общая характеристика, групповой реагент. Характерные реакции ионов Cl–, I–. III аналитическая группа анионов. Общая характеристика. Характерные реакции ионов NO2–, NO3–. Анализ смеси анионов I–III групп. 3.3. Анализ неизвестного вещества Основные этапы проведения качественного химического анализа: подготовка вещества к анализу, отбор средней пробы, растворение твердых веществ, предварительные испытания, анализ катионов и анионов. 4. ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА 4.1. Общие вопросы количественного анализа Цели и задачи количественного анализа. Классификация химических методов количественного анализа. Требования к точности измерений и точности вычислений в количественном анализе. Метрологические характеристики химических методов количественного анализа. 4.2. Гравиметрический метод анализа Сущность и основные операции метода. Классификация гравиметрических методов анализа – методы осаждения, прямые и косвенные методы отгонки, методы выделения. Аналитические возможности, достоинства и недостатки гравиметрического метода анализа. Общая схема аналитического определения по методу осаждения. Осаждаемая и гравиметрическая форма, требования к ним. Неорганические и органические осадители, требования к ним. Выбор осадителя и расчет его количества. Расчет результатов гравиметрического определения. Кристаллические и аморфные осадки, механизм их образования и оптимальные условия получения. Процессы коагуляции и пептизации при образовании осадков. Основные причины загрязнения осадков. Соосаждение, его роль в химическом анализе. Типы соосаждения. Способы уменьшения соосаждения и очистки осадков от соосажденных примесей. Осаждение с коллектором как эффективный способ концентрирования микроколичеств веществ. 4.3. Титриметрические методы анализа Сущность и основные операции метода. Классификация титриметрических методов анализа. Требования к реакциям, которые используются в титриметрии. Точка эквивалентности (стехиометричности). Закон эквивалентов. Конечная точка титрования и ее фиксирование. Общая схема титриметрического анализа. Стандартные растворы, их виды и способы приготовления. Способы выражения концентрации стандартных растворов (молярная концентрация, молярная концентрация эквивалента, массовая концентрация, титр, титр по определяемому веществу). Расчеты, связанные с приготовлением стандартных растворов. Способы титрования: прямое титрование, обратное титрование, титрование заместителя. Расчет результатов титриметрического определения. Метод кислотно-основного титрования. Сущность метода, его общая характеристика. Аналитические возможности, достоинства и недостатки метода. Стандартные растворы, их приготовление, стандартизация и условия хранения. Кислотно-основные индикаторы. Теория индикаторов, основное уравнение теории индикаторов. Основные количественные характеристики индикаторов: интервал перехода, показатель титрования. Кривые кислотно-основного титрования, их расчет и прогнозирование. Факторы, влияющие на величину скачка. Кривые титрования сильных и слабых кислот основаниями, сильных и слабых оснований кислотами. Кривые титрования солей слабых кислот и солей слабых оснований. Кривые титрования многоосновных кислот. Кривые титрования смесей кислот и смесей оснований. Правило выбора индикатора. Индикаторные ошибки титрования. Методы окислительно-восстановительного титрования. Сущность, общая характеристика и классификация методов окислительно-восстановительного титрования. Требования к окислительно-восстановительным реакциям, которые применяются в титриметрии. Расчет факторов эквивалентности веществ, участвующих в окислительно-восстановительных реакциях. Кривые окислительно-восстановительного титрования. Факторы, влияющие на величину скачка. Способы фиксирования конечной точки титрования. Безындикаторное титрование. Окислительно-восстановительные индикаторы, механизм их действия, интервал перехода. Правило выбора индикатора. Перманганатометрия. Сущность и основные реакции метода. Стандартные и вспомогательные растворы метода, их приготовление, стандартизация и условия хранения. Фиксирование конечной точки титрования. Условия проведения перманганатометрических определений. Аналитические возможности, достоинства и недостатки перманганатометрического метода анализа. Иодометрия. Сущность и основные реакции метода. Стандартные и вспомогательные растворы метода, их приготовление, стандартизация и условия хранения. Фиксирование конечной точки титрования. Условия проведения иодометрических определений. Аналитические возможности, достоинства и недостатки иодометрического метода анализа. Методы комплексометрического титрования. Сущность, общая характеристика и классификация методов комплексометрического титрования. Требования к реакциям комплексообразования, которые применяются в титриметрии. Комплексонометрия.Сущность метода. Комплексоны, их строение и свойства. Реакции взаимодействия комплексонов с ионами металлов, их стехиометрия. Побочные реакции, влияющие на равновесие образования комплексонатов. Кривые комплексонометрического титрования. Факторы, влияющие на величину скачка. Способы фиксирования конечной точки титрования в комплексонометрии. Металлохромные индикаторы, механизм их действия, интервал перехода и правило выбора. Стандартные и вспомогательные растворы метода, их приготовление, стандартизация и условия хранения. Условия проведения комплексонометрических определений. Аналитические возможности и достоинства метода комплексонометрического титрования. Методы осадительного титрования. Сущность, общая характеристика и классификация методов осадительного титрования. Представление об основных методах, кривых титрования, индикаторах, стандартных и вспомогательных растворах. Аналитические возможности, достоинства и недостатки методов осадительного титрования. ПРИЛОЖЕНИЕ Форма 1. Отчет о выполнении лабораторной работы по качественному анализу
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||