Бакалаврская работа тема работы Проект узла окисления атактического полипропилена
 Скачать 292.69 Kb. Скачать 292.69 Kb.
|
         3  C Н C CH C Н C C Н C CH C Н C  CH3 Н Н Н Н Атактический полипропилен (АПП): CH3 CH3 Н CH3                      Н C Н C Н C Н C Н C Н C Н C Н CC C C    Н Н Н НCHC Н Н  Н Н Н 3 Н Н Н 3 Стереорегулярный полипропилен (состоит из блоков ИПП и СПП) Лишь стереорегулярная структура полипропилена обеспечивает образование полимеров с высокой степенью кристалличности, обладает наиболее привлекательными свойствами, такими как более высокая плотность, температура плавления, вязкость, степень кристалличности (данные свойства описаны в таблице 1). В этом плане наиболее привлекательными является изотактический полипропилен [5,6]. Таблица 1 - Сравнение свойств полипропилена разной структуры
Свойства атактического и изотактического полипропилена очень сильно отличаются, но несмотря на это оба этих полимера находят широкое применение в промышленности. Изотактический полипропилен – твердое, белое вещество с высокой температурой плавления, высокой прочностью и жесткостью, трудно растворимое в органических растворителях. Атактический полипропилен – каучукоподобное, мягкое, эластическое вещество, светло-желтого цвета, очень хорошо растворяется в органических растворителях (гептан) [7]. В промышленности разделение изотактического от атактического полипропилена основано на их разной растворимости. Пропилен является одним из непредельных соединений, подвергшихся всестороннему исследованию. В первую очередь изучалась его полимеризация в присутствии галогенидов металлов. Исследование реакции полимеризации в присутствии бромистого алюминия при низких, температурах показало, что образуются низкомолекулярные продукты. Другими катализаторами полимеризации пропилена являются серная и фосфорная кислоты, фтористый бор с добавками трикрезилфосфата или этилового спирта и комплекс фтористого бора с фосфорной кислотой [8]. Под влиянием 90-92%-ной серной кислоты пропилен димеризуется в 4- метилпентен-1; 98%-ная серная кислота способствует получению более высокомолекулярных продуктов. В присутствии олеума и особенно при повышенных температурах пропилен полимеризуется почти полностью. Но во всех случаях не удавалось получить из пропилена высокомолекулярных полимеров, пригодных для изготовления пластмасс. Продукты полимеризации представляли собой либо подвижные жидкости (димеры, тримеры, тетрамеры), либо более или менее вязкие продукты консистенции смазочных масел [7]. Некоторые низкомолекулярные полимеры пропилена, в частности тетрамер (н-додецен), нашли применение в промышленности основного органического синтеза для получения алкиларилсульфокислот, являющихся одними из наиболее дешевых и доступных моющих средств. Активными веществами, вызывающими полимеризацию пропилена до низкомолекулярных продуктов, являются тетраэтилсвинец, относящийся к группе металлалкилов, азо- и диазосоединения, нитросоединения, оксимы и производные гидразина. Однако наиболее практический интерес представляет высокомолекулярный полипропилен стереорегулярной структуры, полученный в 1954 году на катализаторе Циглера – Натта. Впервые такой полипропилен был получен в 1956 году в Италии [8].   Для получения полипропилена использовался катализаторный комплекс треххлористого титана, который является очень реакционноспособным: Для получения полипропилена использовался катализаторный комплекс треххлористого титана, который является очень реакционноспособным:Cl + Cl C2 H5  TiCl3 + Al( C2 H5 ) 3 TiCl3 + Al( C2 H5 ) 3Ti Al      Cl C2 H5 Cl C2 H5 C2 H5 Образованный комплекс содержит в своей структуре противоположно заряженные ионы, а также химические связи координационного типа, поэтому эти катализаторы носят название ионно-координационные катализаторы. В таком катализаторе катион титана способен взаимодействовать с π – электронной системой молекулы пропилена и поляризовать эту молекулу [8]. Первым этапом является поляризация мономера катионом титана, ориентация полярного мономера положительным концом к отрицательно заряженному комплекс - иону, после чего происходит втягивание молекулы мономера в отрицательный комплекс – ион, при этом происходит восстановление положительно заряженного иона титана и стабилизация растущей полимерной цепи в комплекс – ионе. CH 3 Cl + Cl C2 H5 CH 3 Cl Cl C H    + - + + - +Ti Al + - + 2 5     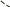    CH CH2 CH CH2Cl C2 H5 C2 H5 CH CH2 Ti Al   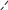     Cl C2 H5 Cl C2 H5П-комплекс  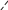  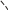    C2 H5 C2 H5Далее образование комплекса переходит в более стабильную форму, способную к образованию комплекса с новой молекулой мономера и повторению описанного выше цикла превращений, приводящий к росту полимерной цепи. Полимерная цепь растет в результате присоединения молекул мономера к полимерной цепи с конца, которой связан с катализатором. Т.к рост молекулы происходит в близи поверхности кристалла, то молекулы мономера для того чтобы вступить в реакцию, должны занимать определенное пространственное положение, которое фиксируется после раскрытия двойной связи. Эти, по-видимому, и объясняется стереорегулярность образующихся полимеров [9]. 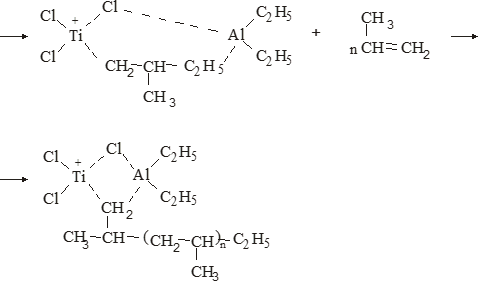 Далее происходит обрыв цепи: 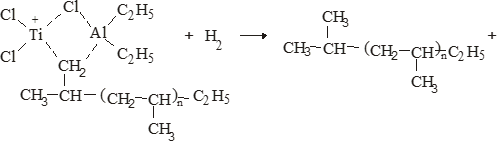 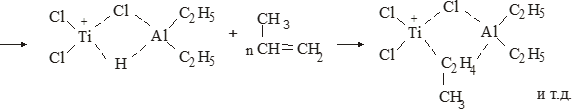 Получение АПП как целевого продукта. Существуют несколько способов образования АПП и все они связаны с изменением каталитического комплекса. Атактический полипропилен долгое время считался нежелательным побочным продуктом. Актуальность решения проблемы снижения выхода АПП сохраняется для некоторых действующих производств полипропилена, основанных на суспензионной технологии полимеризации с использованием катализаторов I и II поколений. Применение более эффективных сферических катализаторов позволило уменьшить выход АПП, образующегося в качестве побочного продукта, с 8 ÷ 10 % до 0,5 ÷ 1 ,0 % и отказаться от его утилизации сжиганием или захоронением [10]. На современных производствах, основанных на полимеризации пропилена в сжиженном мономере на нанесенных титан-магниевых катализаторах, АПП не выделяется после по- лимеризации, а входит в состав целевого продукта - изотактического полипропилена (ИПП). Значительное сокращение выхода АПП и повышение потребностей различных отраслей промышленности в нем стимулируют разработку и создание по технологии прямого синтеза специальных производств АПП как самостоятельного продукта, который используется для получения композиционных материалов и химического модифицирования [10]. Марочный ассортимент этого АПП и его свойства легко изменяются в процессе синтеза. Три фирмы США, включая ведущую фирму "Himont", выпускают с 1987 года АПП на трех заводах общей мощностью 70 тыс.т/год. Стоимость АПП, получаемого по технологии прямого синтеза, несколько выше (900 долл/т) стоимости АПП, получаемого в виде побочного продукта. Состав АПП полученного прямым способом, регулируется, он имеет однородную структуру и имеет лучшее качество. Перспективными катализаторами для промышленного получения АПП являются бис-циклопентадиенильные производные циркония и титана [10], которые обладают высокой активностью и обеспечивают образование атактического полимера с высокой молекулярной массой (до 500000 при низких температурах). Основным способом получения АПП на действующих промышленных установках является сополимеризация пропилена с α- олефинами с использованием низкостереоспецифичных каталитических систем. В состав каталитической системы входит растворимое в углево- дороде соединение переходного металла, полученное реакцией растворимых в углеводороде карбоксилата магния и соли переходного металла (титана, циркония или гафния), и активатор на основе галогенида алкилалюминия [10]. Полимерный продукт выделяют из раствора выпариванием. Он содержит менее 0,03% переходного металла, и поэтому его очистка для большинства областей применения не требуется. Известен способ получения некристаллических мягких сополимеров олефинов путем сополимеризации в присутствии катализатора на основе переходного металла смеси мономеров, содержащей 50-98% пропилена, 0,2- 30% этилена и 0,2-45% α-олефина с неразветвленной цепью. Для полимеризации используется катализатор, состоящий из носителя (хлорид или оксид магния) и нанесенных соединений (соединения титана: тетрахлорид титана, этоксититантрихлорид, триметоксититанхлорид). В качестве сокатализатора применяют алюминий-органические соединения. АПП синтезируют полимеризацией пропилена в углеводородном растворителе в присутствии каталитической системы, состоящего из твердого титансодержащего компонента и АОС. Твердый компонент получают взаимодействием бутилмагнийхлорида, хлористого алюминия и триэтоксифенилсилана. Производительность каталитической системы очень высокая полученный ПП содержит 85% растворимой атактической фракции [10]. На ООО «Томскнефтехим» действует технологический процесс полимеризации пропилена в среде «тяжёлого» углеводородного растворителя гептана, с использованием в качестве катализатора отечественного микросферического трёххлористого титана в сочетании с диэтилалюминий- хлоридом (C2H5)2AlCl. Полученный полипропилен содержит до 5% раство- римой в гептане атактической фракции [11]. Выделяют АПП выпариванием в отпарном аппарате, а затем проводят его грануляцию. На производстве полипропилен используется эффективный катализатор, который позволяет получать с высоким выходом изотактический полипропилен с незначительным содержанием АПП. Это позволило также выделять АПП вместе с изотактической фракцией, и не утилизировать его, а реализовывать по рыночной стоимости. Модификация АПП Способы моделирования полимеров в процессах модификации представляет большой интерес с научной и практической точки зрения, которые позволяют создавать материалы с необходимыми свойствами и различными сроками эксплуатации. Химическая модификация полимера – это направленное изменение его физических, механических или химических свойств введением в макромолекулу новых функциональных групп, сшиванием или сополимеризацией. Необходимость как физической, так и химической модификации большинства полимеров обусловлена несколькими основными причинами: необходимостью придания промышленным маркам полимеров, требуемых эксплуатационных и технологических характеристик; неполноценностью их химической и надмолекулярной структуры, обусловленной неоднозначным протеканием процессов синтеза, в результате которого в реальном полимере появляются нарушения регулярности структуры: разветвления, ненасыщенные группы, пространственная неоднородность и другие, оказывающие существенное и чаще всего негативное влияние на весь комплекс его свойств возможностью достижения значительного экономического эффекта, как за счет удешевления полимерных композиций, так и упрощения технологии изготовления изделий из модифицированных полимеров; возможностью восстановления или изменения свойств отработанных изделий, обеспечивающих их повторное использование, и необходимостью защиты окружающей среды. Модификация полимеров – одно из приоритетных направлений развития полимерной химии и технологии, социально значимой для человеческого сообщества задачей. Наиболее распространенными способами модификации АПП являются привитая сополимиризация, окисление, хлорирование, нитрование и другие. Наибольшую ценность представляет модификация АПП привитой сополимеризацией и окислением. Привитые сополимеры на основе полиолефинов представляют интерес вследствие своих новых приобретенных свойств. Сополимеры, с одной стороны, могут иметь свойства, типичные для привитого полимера, и одновременно- специальные свойства, обусловленные основной цепью полиолефина. Привитые сополимеры Разветвленные высокомолекулярные соединения, макромолекулы которых состоят из основной цепи и боковых ответвлений, различающихся по составу и/или строению. Схематично привитые сополимеры можно изобразить так: AAA - (A)n - AAA AAA - (A)n - AAA | | | | (B)k (B)l X X | | (B)k (B)l (А и В - мономерные звенья различного типа, Х – промежуточная группа, k, n и l показывают число мономерных звеньев в последовательностях). Основная и боковые цепи могут быть гомо- (показаны на схеме) и сополимерами. Привитые сополимеры имеют в своем составе последовательности дифильного характера и процесс микрорасслаивания может происходить как в растворах, так и в твердой фазе. Микрорасслаивание может происходить либо при синтезе и выделении сополимеров, либо при уже их переработке. Этому процессу препятствуют химические связи, образующиеся в молекуле сополимера. Наличие данного свойство сильно отличает их от соответствующих термодинамически неустойчивых механических смесей полимеров. Из-за этого свойства появляется возможность использовать привитые сополимеры в тех случаях, когда необходимы совместимые полимерные системы. В составе привитых сополимеров присутствуют так называемые микрооблости, которые обогащены одним из компонентов. Благодаря этой особенности есть существенное отличие в свойствах статических сополимеров и привитых того же состава. Это отличие выражается аддитивностью физико- механических свойств полученного сополимера. Привитым сополимерам, состоящим из мало или несовместимых компонентов присуще наличие двух температур стеклования. Определение температуры течения происходит по максимальной температуре одного из компонентов. Данная особенность дает возможность в некоторых случаях увеличить температурный интервал высокоэластичного состояния. Процесс пластификации привитых сополимеров происходит селективно путем растворения пластификатора в соответствующих микрообластях. Наиболее важные в практическом применении механические свойства привитых сополимеров обуславливаются наличием областей микрорасслаивания. Привитая сополимеризация может использоваться для придания необходимых поверхностных свойств полимерным и неполимерным материалам таких как: термостойкость, адгезия, жесткость и др. Методы получения блок и привитых сополимеров Свойства привитых сополимеров и блоксополимеров отличаются от статистических сополимеров. В отличие от блок- и привитых сополимеров в которых сочетаются свойства компонентов всходящих в состав, в статистических сополимерах не проявляются свойства характерные индивидуальным компонентам. Получение блоксополимеров и привитых сополимеров осуществляется с помощью химических превращений. Они не могут быть получены методами прямой сополимеризации. Получение осуществляется двумя основными способами: Реакции в системе полимер-мономер, Реакции в системе полимер-полимер. Рассмотрим поподробнее каждый из способов получения. Реакции в системе полимер – мономер Для получения блок- и привитых сополимеров необходимо создание в макромолекуле реакционных центров, на которых будет происходить полимеризация. Для этого можно использовать один из двух методов. Чаще всего используется радикальная полимеризация, также можно использовать ионную полимеризацию. Радикальная полимеризация может осуществляться в одну или две стадии. В зависимости от этого могут получатся разные продукты. Эффективность одностадийного метода определяется скоростью передачи цепи на полимер. Скорость передачи зависит от температуры, соотношения полимера и мономера, подвижности отрываемого атома от цепи, а также реакционной способности мономера и полимера. Реакции в системе полимер – полимер Основой этого метода получения блоксополимеров и привитых сополимеров является взаимодействие полимеров или олигомеров путем конденсации функциональных групп или путем рекомбинации макрорадикалов различных полимеров. Окисление Характеристика процессов окисления Процессы окисления имеют огромное практическое значение в органическом и нефтехимическом синтезе благодаря следующим факторам: Продукты окисления представляют большую ценность и являются промежуточными продуктами органического синтеза. Большая разновидность реакций окисления, к которым способны многие органические соединения. Низкая стоимость и доступность окислителей. Процессами окисления в органической химии считаются превращения веществ, происходящие под действием окислительных агентов. Также различают полное и неполное окисление. Полное окисление идет с образованием диоксида углерода и воды. Оно является нежелательным процессом. Реакции неполного окисления можно разделить на три главные группы [12]: Окисление без разрыва углеродной цепи Количество атомов углерода сохраняется как в исходном соединении. Эти реакции в свою очередь делятся на две группы: окисление по насыщенному атому углерода в парафинах, нафтенах и т.д. И окисление по двойной связи с образованием α-оксидов, карбонильных соединений: Деструктивное окисление, протекает с расщеплением С-С, С=С или Сар-Сар связей. Окислительная конденсация. Окисление сопровождается связыванием молекул исходных реагентов. Окислительные агенты В качестве окислительных агентов в промышленности используют молекулярный кислород, азотную кислоту или пероксидные соединения[12]. Молекулярный кислород применяется в виде воздуха, технического кислорода или азотокислородных смесей. Он является важнейшим окислительным агентом. Азотная кислота также применяется как окислительный агент, но при ее использовании может происходит побочная реакции нитрования органических соединений. Нитрующая способность азотной кислоты возрастает с ее концентрацией. Поэтому как правило используют 40-60 %-ю азотную кислоту. HNO3 как окислитель не применяется с парафинами. Чаще всего ее используют для деструктивного окисления циклических соединений. Пероксидные соединения в частности пероксид водорода и перуксуная кислота применяются как окислительные агенты совсем недавно. Из-за высокой стоимости пероксидные соединения применяются для реакций, протекание которых в других условиях не возможны, например, реакции эпоксидирования [13]. Существует два основных способ окисления органических соединений: Радикально-цепное окисление Гетерогенно-каталитическое окисление Рассмотрим каждый из способов по подробнее. Радикально-цепное окисление Данный процесс характерен для окисления по насыщенному атому углерода. По радикально-цепному механизму окисляются: парафины и их производные циклопарафины и их производные боковые цепи алкилароматических углеводородов Основными продуктами могут быть спирты, карбоновые кислоты и их ангидриды, гидропероксиды. Этот процесс осуществляется преимущественно в гомогенных условиях в жидкой фазе. Радикально-цепное окисление можно разделить на две основные группы [14]: Автоокисление (термическое) Под действием катализаторов (соли металлов переменной валентности) Продуктами окисления по радикально-цепному механизму являются: спирты, кетоны, альдегиды, карбоновые кислоты и некоторые другие соединения. В качестве промежуточных активных частиц выступают радикалы со свободной валентностью на атоме углерода (R∙) или на кислородных атомах (ROO∙, RCOOO∙) На первой стадии протекания процесса образуются гидропероксиды [12]. 𝑅 ∙ + 𝑂2 → 𝑅𝑂𝑂 ∙ 𝑅𝑂𝑂 ∙ + 𝑅𝐻 → 𝑅𝑂𝑂𝐻 + 𝑅 ∙ Реакция взаимодействия пероксидного радикала с углеводородом является определяющей строение продуктов окисления и гидропероксидов. Реакционная способность определятся относительной стабильностью радикала R∙(трет->втор-> перв-). Преимущественным местом атаки молекулы при окислении алкилароматических соединений становится α-положение боковой цепи, а для олефинов – аллильное положение. Гидропероксиды при разложении под действием повышенной температуры образуют гидроксильные и карбонильные группы. Образование спиртов идет следующим образом [12]: 𝑅𝑂𝑂𝐻 + 𝑅 ∙ → 𝑅𝑂𝐻 + 𝑅𝑂 ∙ 𝑅𝑂𝐻 + 𝑅𝐻 → 𝑅𝑂𝐻 + 𝑅 ∙ Из вторичных радикал-гидропероксидов происходит образование кетонов: 𝑅2𝐶𝐻𝑂𝑂𝐻 + 𝐻𝑂 ∙ → 𝑅2𝐶̇𝑂𝑂𝐻 → 𝑅2𝐶 = 𝑂 + 𝐻𝑂 ∙ −𝐻2𝑂 При окислении третичных гидропероксидов образуются помимо спирта с тем же числом атомов углерода также спирт и кетон с меньшим числом. Происходит деструкция С-С связи: 𝑅3𝐶𝑂𝑂𝐻 + 𝑅 ∙ → 𝑅𝑂𝐻 + 𝑅3𝐶𝑂 ∙ 𝑅3𝐶𝑂 ∙ → 𝑅2𝐶 = 𝑂 + 𝑅 ∙ Рассмотренные механизмы характерны для некаталитического окисления при средних температурах. Гетерогенно-каталитическое окисление углеводородов Гетерогенно-каталитическое окисление используют в тех процессах, которые невозможно, по ряду причин, осуществить радикально-цепным механизмом. Важнейшими среди них являются [13]: Окисление олефинов по насыщенному атому углерода с сохранением двойной связи. Окислительный аммонолиз олефинов и других углеводородов с получением нитрилов. Окисление ароматических и других углеводородов с образованием внутренних ангидридов ди- или тетракарбоновых кислот. Прямой синтез этиленоксида. В качестве катализаторов широкое применение нашли следующие: Металлы – Cu и Ag Оксиды переходных металлов – CuO + Cu2O, V2O5 Смеси оксидов и соли переходных металлов – ванадаты, станнаты, вольфраматы и молибданаты цинка, кобальта и висмута (ZnO∙ V2O5, CoO∙WO3) Главную роль в данных процессах играет адсорбция реагентов на поверхности контакта. Кислород очень быстро сорбируется на металлах с последующим проникновением в поверхностный слой. Углеводороды в свою очередь слабо собираются на поверхности металла и этот процесс чаще всего обратим. Более прочную связь они образуют с оксидными и солевыми катализаторами.    В гетерогенно-каталитическом окисление существует два механизма протекания процесса. В одном из них происходит адсорбция углеводорода на окисленной поверхности катализатора, на первой стадии углеводород сорбируется по ион-радикалу кислорода, на второй – взаимодействует с кислородом с образованием продуктов окисление. Примером данного механизма может послужить синтез этиленоксида. В гетерогенно-каталитическом окисление существует два механизма протекания процесса. В одном из них происходит адсорбция углеводорода на окисленной поверхности катализатора, на первой стадии углеводород сорбируется по ион-радикалу кислорода, на второй – взаимодействует с кислородом с образованием продуктов окисление. Примером данного механизма может послужить синтез этиленоксида.Ag OO + H2C CH2 Ag O O C H2 CH2 Ag O + H2C CH2 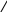 O O Второй распространенный тип взаимодействия называют окислительно- востановительным. Углеводород в начале сорбируется на поверхности металла, а затем вступает в взаимодействие кислородом решетки катализатора. При это происходит восстановление металла до низшего валентного состояния, а после снова происходит взаимодействие металла с кислородом, и металл переход в первоначальное состаяние. Второй распространенный тип взаимодействия называют окислительно- востановительным. Углеводород в начале сорбируется на поверхности металла, а затем вступает в взаимодействие кислородом решетки катализатора. При это происходит восстановление металла до низшего валентного состояния, а после снова происходит взаимодействие металла с кислородом, и металл переход в первоначальное состаяние. 2KOH + H2C C H 2KOH + H2C C HCH3 H2C C C H H    2K + O2 2KOH 2K + O2 2KOHO + 2K + H2O Этот механизм характерен для окисления олефинов и метилбензолов. Механизм основной реакции Окисление атактического полипропилен происходит по радикально- цепному механизму в жидкой фазе. В качестве окислительного агента используется кислород воздуха. На первой стадии образуются гидропероксиды.   C C C C C CH2 H2 H2 + O2 C C C  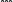  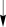 H2 H H2 H2 H H2+ H O2 H 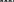  C C C C C CH2 H2 OOH На второй стадии гидропероксиды при разложении под действием повышенной температуры образуют гидроксильные и карбонильные группы. H 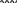 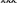 C C C + C C C +H2 H2 OOH H 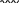 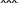 C C C C C CH2 H2 OOH C C  H2 H H2 H C H2 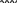 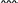 C C C C C C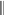 H2 H2 H2 H2O H 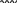   C C C C C CH2 H2 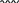 OH OH + HO Кинетика радикально-цепного окисления Некаталитическое окисление на практике используют только для получения гидропероксидов и пероксикилот. В этом случае кинетика процесса определяется следующими элементарными стадиями [12]: 𝑘1 𝑅 ∙ + 𝑂2 → 𝑅𝑂𝑂 ∙ 𝑘2 𝑅𝑂𝑂 ∙ + 𝑅𝐻 → 𝑅𝑂𝑂𝐻 + 𝑅 ∙ 2𝑅𝑂𝑂𝐻 𝑘вр → 𝑅𝑂 ∙ + 𝑅𝑂𝑂 ∙ + 𝐻2𝑂 𝑘𝑡 2𝑅𝑂𝑂 ∙ → молекулярные продукты Методом стационарных концентраций получаем уравнение для скорости реакции [12]:  𝑟 = 𝑘2[𝑅𝑂𝑂 ∙][𝑅𝐻] = 𝑘2√𝑘вр/𝑘𝑡 [𝑅𝐻][𝑅𝑂𝑂𝐻]0.5𝑛 Исходя из уравнения можно сделать вывод, зависимость между скоростью процесса и концентрацией, парциальным давлением кислорода отсутствует. Однако при сильном снижении этих величин скорость первой стадии продолжения цепи может настолько упасть, что она окажется лимитирующей м обрыв цепи будет происходить на алкильных радикалах [13]: 𝑡 𝑘′ 2𝑅 ∙ → молекулярные продукты В результате аналогичным образом получим уравнение:  𝑟 = 𝑘1√𝑘вр/𝑘′ [𝑂2][𝑅𝑂𝑂𝐻]0.5𝑛 𝑡 Из этого можно сделать вывод, при различных условиях обрыва цепи зависимость скорости от парциального давления кислорода изображается кривой с насыщением (рис ), обычно наступающим при давлении ≈100гПа. 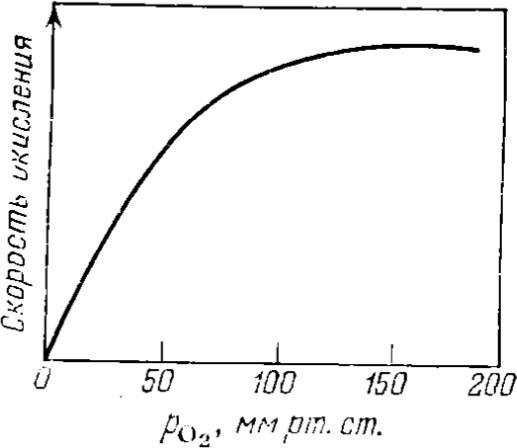 Рисунок 3 – зависимость скорости гомогенного окисления от парциального давления [12] Из полученных зависимостей видно, что для интенсификации начальной стадии окисления выгодно добавлять в исходную смесь готовый гидропероксид. Это получило широкое распространение на практике. Объект и метод исследования Атактический полипропилен Атактический полипропилен – каучукоподобное, мягкое, эластическое вещество, светло-желтого цвета, очень хорошо растворяется в органических растворителях (гептан). [15]. В качестве сырья используется АПП Г/Б производства завода полипропилена ООО «Томскнефтехим», имеющего следующие характеристики (ТУ 2211-056-0579-6653-98) представленные в таблице 2 [2]:
Продукт ОАПП представляет собой аморфный термопластичный материал, проявляющий повышенные адгезионные свойства из-за наличия в структуре макромолекулы полярных карбонильных гидроксильных функциональных групп и двойных углерод-углеродных связей [16] Окисленный атактический полипропилен используется для приготовления [17]: битумно-полимерных вяжущих материалов; строительных мастик для аэродромов; антикоррозионных грунтовок, покрытий и шпатлевок; водостойких и антиобледенительных составов; полимер-полимерных и полимер-минеральных композиций; клеев для липких лент и клеев-расплавов, используемых в строительстве; в нефтехимической промышленности в качестве многофункциональных присадок к смазочным маслам и дизельному топливу; а также в резинотехнической промышленности в качестве ингредиента резиновых смесей. Антикоррозионные составы на основе битумов и ОАПП особенно эффективно защищают поверхность стальных нефте- и газопроводов. Выбор и обоснование технологической схемы производства ОАПП получают различными способами. Рассмотрим краткую характеристику методов и выберем оптимальный. Один из способов – окисление проводят в расплаве АПП. Проводят окисление расплава атактического полипропилена молекулярной массы 20000–40000 а.е.м. кислородом воздуха при температуре 180–250°C в течение 1–6 часов и расходе воздуха 0,6–1,9 л/мин [2]. Установка для получения ОАПП по непрерывной технологической схеме синтеза, содержит три последовательно соединенных реактора барботажного типа при отношении высоты реактора к его диаметру в пределах 2,0–5,0 и устройство для подачи воздуха, снабженное диспергирующей насадкой с прорезями по периметру нижней кромки с отношением диаметра насадки к диаметру реактора 0,25–0,50. Насадка на конце барботера выполняет три функции одновременно: равномерно распределяет и диспергирует воздух в реакционной массе; перемешивает реакционную массу за счет архимедовой подъемной силы, поднимающей газожидкостную смесь с меньшей плотностью вверх реактора, и предохраняет ее от локальных перегревов у стенок реактора; защищает переливы между реакторами от забивки кусками не расплавившегося полимера, которые имеют большую плавучесть в газожидкостной реакционной массе. Также известен способ получения окисленного атактического пропилена, когда процесс окисления проводят в растворе. В качестве растворителя, как правило используется гептан. Данный метод реализуется в реакторе барботажного типа периодического действия. Температура процесса составляет порядка 100°С. Окисление осуществляется кислородом воздуха в течение 5 часов. В качестве преимуществ данного метода можно отметить, что процесс проводится в менее жестких условиях. Это уменьшает выход нежелательных побочных продуктов термоокислительной деструкции. А также более низкую температуру проведения процесса и использование всего одного реактора, что существенно снижает энергозатраты. Описание технологической схемы окисления атактического полипропилена 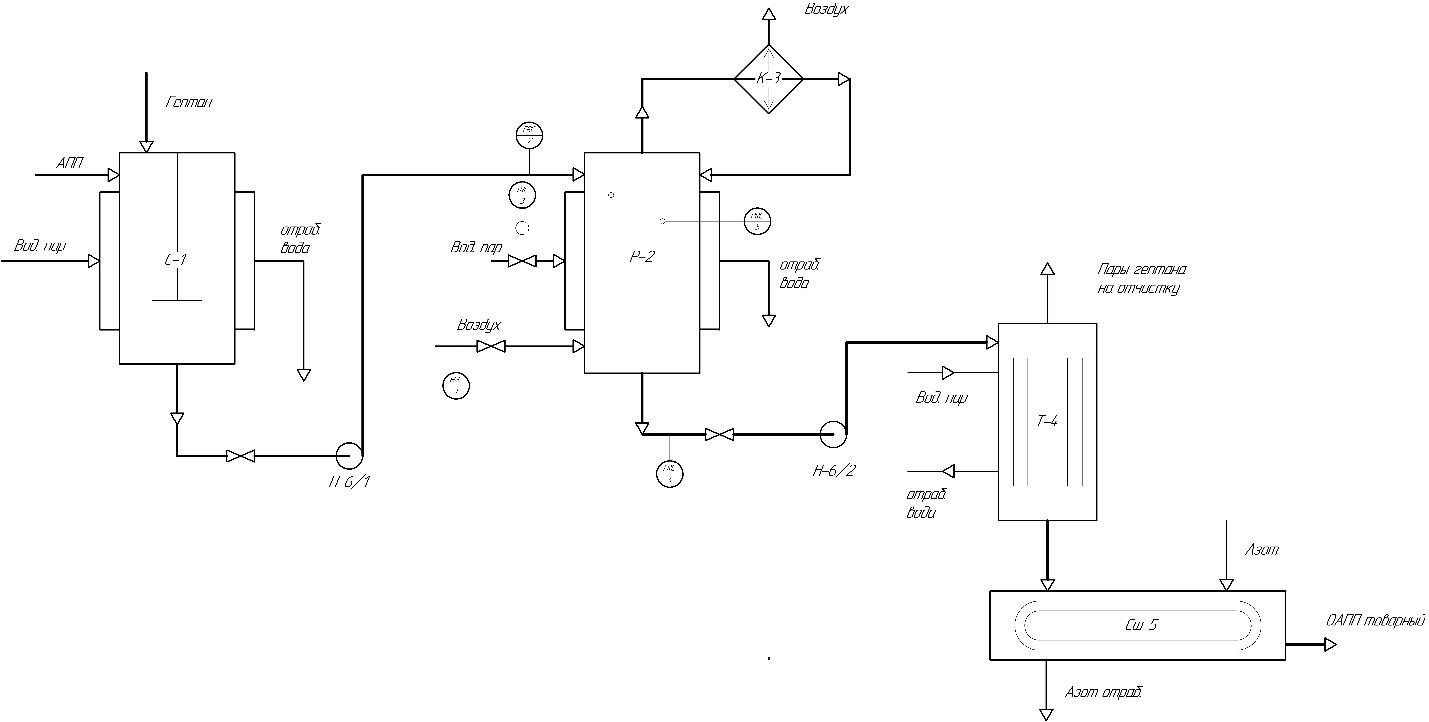 Рисунок 4 – Блок-схема окисления АПП Приготавливают раствор АПП в гептане, для этого в смеситель поз. С-1 подают гептан и АПП, затем при температуре 50°C выдерживают до полного растворения АПП. После полученный раствор подают в барботажный реактор поз. Р-2 периодического действия, работающий под атмосферным давлением. Нагрев проводят в течение 2 часов до температуры проведения реакции. Окисление проводят в течение 5 часов при температуре 90°C. Пары гептана и отработанный воздух удаляются из верхней части аппарата и подаются в конденсатор поз. К-3. После конденсатора гептан возвращается обратно в реактор. Полученный раствор ОАПП в гептане отправляют на выпаривание поз. Т-4 до 20%-го содержания гептана в продукте. Остальная часть гептана удаляется в процессе сушки поз Сш-5. Сушку проводят до содержания гептана в конечном продукте 1-3%. Аналитический контроль Аналитический контроль ОАПП проводится методом определения кислотного числа. Кислотное число (коэффициент кислотности) – количество едкого калия (КОН) в мг, израсходованного на нейтрализацию кислых соединений, содержащихся в 1г анализируемого продукта. Характеризует содержание в веществе свободных кислот [18]. Определяли кислотное число объёмным титрованием раствором едкого калия навески продукта, растворенного в спиртотолуольной смеси. При этом протекает реакция:  O O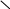 R C + KOH R C + KOHOH O 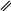  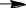 R C + H2O R C + H2OOK Методика определения КЧ: две чистые сухие колбы из термостойкого стекла емкостью по 100 мл со шлифами, взвешенные на аналитически весах, помещают навеску по 0,1г анализируемого вещества. Взвешивание проводят на аналитических весах с точностью до 0,0001 г. В колбы приливают 10 мл толуола, добавляют 3-4 капли индикатора (фенолфталеина) и титровали 0,1н спиртовым раствором гидроксида калия. Конец титрования определяют по изменению окраски раствора от серо-фиолетовой в кислой среде до розовой в щелочной. Параллельно проводят титрование толуола без навески анализируемого вещества (холостой опыт). Далее определяют нормальность 0,1н раствора КОН, для этого титровали раствором КОН 0,1н HCl. Точку эквивалентности определяют визуально по индикатору фенолфталеину. Сн 𝐾𝑂𝐻 = (Сн · 𝑉)𝐻𝐶𝑙,  𝑉𝐾𝑂𝐻 𝑉𝐾𝑂𝐻где СнКОН – нормальность КОН; СнHCl – нормальность HCl; VКОН – объем гидроксида, пошедший на титрование соляной кислоты, мл; VHCl – объем соляной кислоты, мл. Поправка на 0,1н раствор КОН рассчитывали по формуле:  К = СнКОН К = СнКОН0,1 Кислотное число (КЧ) вычисляли по формуле:  (𝑎 − 𝑏) · 0,0056 · К · 1000 (𝑎 − 𝑏) · 0,0056 · К · 1000КЧ = 𝑔 , где a – объем 0,1 н раствора КОН, пошедший на титрование анализируемого вещества, мл; b – объем 0,1 н раствора КОН, пошедшего на титрование холостой пробы, мл; 0,0056 – число грамм КОН в 1 мл 0,1 н раствора КОН; К – поправка на 0,1 н раствор КОН; g – навеска анализируемого вещества, г. Описание средств автоматизации и приборов контроля производства Узел окисления атактического полипропилена регулируется и контролируется регулируется следующими приборами: Расход подачи воздуха в реактор поз. Р-2 в процессе окисления контролируется с помощью прибора FRC-1. Расход подачи раствора АПП в гептане в реактор поз. Р-2 контролируется с помощью прибора FRC-2. Контроль температуры процесса окисления осуществляется прибором TRC-3. Расход раствора ОАПП после проведения окисления контролируется прибором FRC-4. Давление внутри реактора регистрируется прибором PRC-5. Таблица 3 – Технологический контроль узла сероочистки метана
|
