Экол.гальванопроизводств vinogradov_03. Библиотечка гальванотехника
 Скачать 0.98 Mb. Скачать 0.98 Mb.
|
|
БИБЛИОТЕЧКА ГАЛЬВАНОТЕХНИКА С.С. Виноградов ЭКОЛОГИЧЕСКИ БЕЗОПАСНОЕ ГАЛЬВАНИЧЕСКОЕ ПРОИЗВОДСТВО Под редакцией проф. В.Н.Кудрявцева Выпуск 3 Приложение к журналу "ГАЛЬВАНОТЕХНИКА И ОБРАБОТКА ПОВЕРХНОСТИ” Москва «Глобус» 1998                  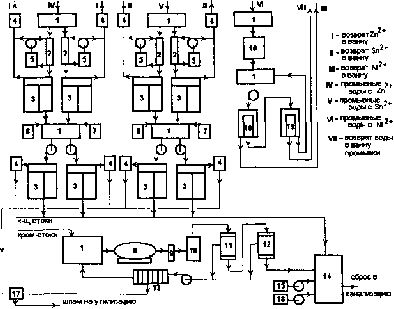 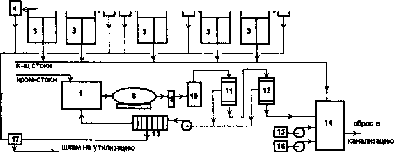  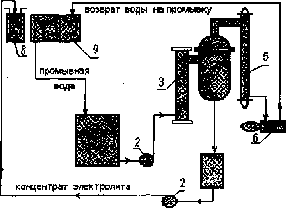  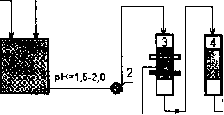    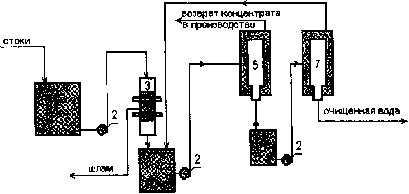      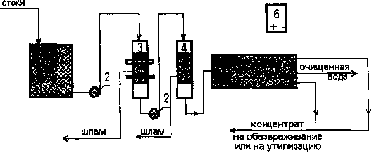 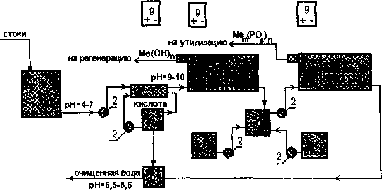  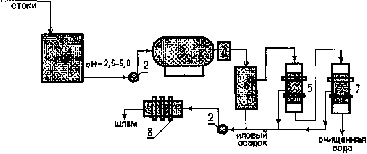                             УДК 621.367: 502.7 С.С. Виноградов Экологически безопасное гальваническое производство. /Под редакцией проф. В.Н. Кудрявцева,- М. : Производственно-издательское предприятие "Глобус", 1998. - 302 с.: 51 ил., 64 табл., 26 библиогр. назв. Книга содержит экологические характеристики компонентов технологических растворов, базовые составы растворов и электролитов для обработки поверхности металлов. Даны характеристики систем промывки, описаны рациональные способы промывок и нормирования водопотребления. Показаны варианты компоновок гальванических линий и гальванического цеха, объемы и загрязненность промывных и сточных вод, а также технологические схемы очистки кисло-щелочных и хромсодержащих сточных вод, технологические схемы очистки отработанных технологических растворов и электролитов, а также приведены сравнительные характеристики методов очистки. На примере конкретного гальванического цеха показана многовариантность как гальванического производства с точки зрения объёма и состава сточных вод, так и способов организации систем очистки стоков, а также приведены принципы адаптации гальванического производства и различных систем очистки сточных вод. Описаны способы регенерации отработанных электролитов и схемы рекуперации отработанных растворов, а также способы утилизации гальванических шламов. Определены основные направления создания экологически безопасного гальванопроизводстве. Книга предназначена для инженерно-технических работников машиностроительных заводов, научно-исследовательских и проектно конструкторских организаций, занимающихся разработкой технологий и оборудования для гальванических цехов, а также для студентов и аспирантов специальности “Технология электрохимических производств”. ISBN 5-89021-016-05 4702010201 И 18(03)-98 © Производственно-издательское предприятие "Глобус" © С.С.Виноградов Содержание. стр. Предисловие 5 Раздел 1. Экологическая опасность технологических растворов 7 гальванического производства и направления ее снижения
Раздел 4. Базовые принципиальные схемы очистки промывных и 162 сточных вод
3
Раздел 6. Регенерация (восстановление работоспособности) 241 отработанных электролитов
Раздел 8. Утилизация гальванических шламов 289 Раздел 9. Создание экологически безопасного гальванического 297 производства Литература 301 4 ПРЕДИСЛОВИЕ Гальванотехника получила широкое распространение в народном хозяйстве. Основной набор электролитов и технологических растворов можно считать сложившимся и в ближайшее время вряд ли следует ожидать радикальных изменений в области создания электролитов, которые вызвали бы резкий скачок в развитии гальванотехники. Экологические проблемы гальванотехники привлекают к себе широкое внимание в основном из-за продолжающегося загрязнения окружающей среды ионами тяжелых металлов (ИТМ). В то же время в обществе происходит понимание того, что дальнейшее развитие техники и технологии по пути создания новых продуктов с новыми качествами часто приходит в противоречие с условиями самой жизни на Земле, с нормальным функционированием природной среды. Поэтому получили развитие природоохранные технологии и в первую очередь для наиболее экологически вредных производств, в том числе гальванического производства. В настоящее время сложилось два направления: развитие гальванотехники и разработка средств и методов очистки сточных вод, причем последнее направление получило свое развитие в сравнительно недавнее время. К сожалению оба направления развиваются самостоятельно и зачастую независимо друг от друга. На практике это привело к тому, что технологи-гальваники в силу своего образования и стоящих перед ними задач не имеют четкого представления о способах уменьшения вредного воздействия гальванопроизводства на окружающую среду, а специалисты- экологи рассматривают гальваническое производство как “черный ящик”, выходными параметрами которого являются сточные воды самого разнообразного состава. Автор ставил перед собой задачу объединения достижений как в области гальванопроизводства, так и в области экологических технологий в единый комплекс вопросов, одновременно полезных как для инженера-гальваника, так и для специалистов по охране окружающей среды. Особое внимание автор уделил рационализации промывных операций, которые являются связующим звеном между гальванопроизводством и очисткой 5 сточных вод. Автор вводит понятие “экологический критерий гальванического производства”, который учитывает состав электролитов, степень токсичности применяемых химикатов, способы промывки, эффективность работы очистных сооружений, степень регенерации и рекуперации компонентов технологических растворов, а также надежность захоронения твердых отходов. В книге уделено внимание экологическим аспектам гальванопроизводства, рационализации водопотребления, способам очистки сточных вод, регенерации и рекуперации отработанных растворов, утилизации гальванических шламов, а также предложены принципы адаптации гальванопроизводства и систем очистки сточных вод. Предлагаемая вниманию читателей книга не претендует на систематическое и полное изложение основ гальванотехники и технологий по очистке сточных вод. Автор выражает надежду, что приведенный материал поможет читателям найти правильный подход к проблемам создания экологически безопасного гальванического производства, и просит все замечания и предложения направлять по адресу редакции журнала “Гальванотехника и обработка поверхности”: 125047, Москва, Миусская площадь, 9, РХТУ им. Д.И.Менделеева, кафедра ТЭП. Главному редактору, профессору В.Н.Кудрявцеву. РАЗДЕЛ 1. ЭКОЛОГИЧЕСКАЯ ОПАСНОСТЬ ТЕХНОЛОГИЧЕСКИХ РАСТВОРОВ ГАЛЬВАНИЧЕСКОГО ПРОИЗВОДСТВА И НАПРАВЛЕНИЯ ЕЕ СНИЖЕНИЯ
Гальваническое производство является одним из наиболее опасных источников загрязнения окружающей среды, главным образом поверхностных и подземных водоемов, ввиду образования большого объёма сточных вод, содержащих вредные примеси тяжелых металлов, неорганических кислот и щелочей, поверхностно-активных веществ и других высокотоксичных соединений, а также большого количества твердых отходов, особенно от реагентного способа обезвреживания сточных вод, содержащих тяжелые металлы в малорастворимой форме. Соединения металлов, выносимые сточными водами гальванического производства, весьма вредно влияют на экосистему водоем - почва - растение - животный мир - человек. Например, соединения кадмия даже в малых концентрациях оказывают резко выраженное токсическое действие на рыб и другие водные организмы. Весьма вредны соединения шестивалентного хрома, который при концентрации в воде более 0,01 мг/л оказывает токсическое действие на микрофлору водоемов. Многие химические вещества, поступающие в окружающую среду, в том числе и в водоемы, а через питьевую воду в организм человека, помимо токсического действия обладают канцерогенным (способны вызвать злокачественные новообразования), мутагенным (могут вызвать изменения наследственности) и тератогенным действием (способны вызвать уродства у рождающихся детей). Канцерогенное действие на теплокровных животных при поступлении в организм с питьевой водой оказывают мышьяк, селен, цинк и палладий, а при поступлении в организм другими путями - хром, бериллий, свинец, ртуть, кобальт, никель, серебро, платина. Тератогенное действие на животных в экспериментальных условиях оказали кадмий, свинец, мышьяк, кобальт, алюминий и литий. В опытах с радужной форелью описано мутагенное действие сульфида цинка, т.е. изменения в генах, которые могут проявляться не только в том поколении, когда возник новый признак, но и в последующих 7 поколениях. Некоторые неорганические соединения, например соединения хрома (IV), оказывают на людей аллергенное действие. Многие неорганические соединения даже в очень малых концентрациях оказывают вредное воздействие на рыб и их кормовые ресурсы. Большинство водных организмов более чувствительно к действию токсичных веществ, чем человек и теплокровные животные. Разные виды организмов неодинаково переносят действие неорганических соединений. Так, JIK50 (летальная концентрация, при которой гибнет 50% особей) кадмия составляет для циклопов 3,8 мг/л, а для дафний - 0,055 мг/л. Икра лососевых рыб более чувствительна, чем взрослые особи, к действию меди и цинка. Кумуляция вредных неорганических соединений тканями рыб создает угрозу отравления людей, употребляющих такую пищу. Ртуть накапливается микроорганизмами, рыбами и их кормовыми ресурсами до высоких концентраций. А, например, кадмия обнаружено в тканях рыб в 200 раз больше, чем содержалось в воде, что подтверждено в опытах на молоди окуня черного большеротого и ушастого, продолжающихся 6 месяцев при концентрациях кадмия в воде 0,0005-0,85 мг/л. Ткани устриц из водоемов кумулируют свинец, ртуть, кадмий, цинк, медь и кобальт. В крупных городах и промышленных центрах вредные вещества поступают в водоемы в виде различных соединений и смесей, оказывающих совместное, или так называемое комбинированное действие на организм человека, теплокровных животных, флору и фауну водоемов, на микрофлору очистных сооружений канализации. Это может быть: 1) синергизм или потенционирование, когда эффект действия больше простого суммирования; 2) антагонизм, когда действие нескольких ядов бывает меньше суммированного и 3) аддитивное или простое суммирование. Нередко наблюдаются и отступления от этой схемы. Кадмий в сочетании с цинком и цианидами в воде усиливает их действие, мышьяк является антагонистом селена. В опытах с радужной форелью токсичность смеси сульфидов цинка и меди в малых концентрациях была примерно такая же, как и каждого компонента в отдельности, а при высоких концентрациях’ наблюдался синергизм. Физико-химические свойства воды - температура, содержание кислорода, жесткость и pH - влияют на токсичность многих 8 неорганических веществ. С повышением температуры воды увеличивается обмен веществ водных организмов и они получают больше яда. При увеличении общей жесткости воды с 20 до 260 мг/л по карбонату кальция средние летальные концентрации (ЛКср) различных соединений кадмия, меди, олова и свинца увеличиваются примерно в 100 раз. Увеличение pH с 6,6 до 8,0 также снижает токсичность многих веществ. Таким образом, в водоемах с малой жесткостью воды ядовитое действие металлов, как правило, будет больше, хотя и бывают исключения из этой закономерности. Поэтому снижение жесткости водопроводной воды может повысить токсичность содержащихся в ней металлов. Некоторые неорганические соединения оказывают губительное действие на микроорганизмы очистных сооружений, прекращают или замедляют процессы биологической очистки сточных вод и сбраживание осадков в метантенках. Токсичные металлы в водоемах не подвергаются самоочищению, а наоборот, губительно действуют на флору и фауну и тормозят процессы самоочищения водоемов. Концентрация их в водоемах может уменьшаться за счет разбавления, осаждения на дне и частично усвоения флорой и фауной. Количество выпадающих в осадок веществ увеличивается при понижении скорости течения жидкости. При использовании воды загрязненных водоёмов для орошения цветные металлы выносятся на поля и концентрируются в верхнем наиболее плодородном гумусосодержащем слое почвы. Концентрация металлов в этом слое приводит к снижению азотфиксирующей способности почвы и урожайности сельско хозяйственных культур, накоплению металлов выше допустимых концентраций в кормах и других продуктах. По прогнозу до конца 2000 года тяжелые металлы займут одно из первых мест среди опасных факторов в общем загрязнении окружающей среды. Ниже приведены данные о вредном воздействии на окружающую среду некоторых металлов и соединений, содержащихся в сточных водах гальванического производства. Вопросы непосредственного воздействия вредных веществ на человека и животных через кожный покров, органы дыхания и пищеварения достаточно подробно изложены в литературе по технике безопасности и производственной санитарии (например: Вредные вещества в промышленности. Справочник. В 3-х томах/Под ред. Н.В.Лазарева. -Л.:Химия, 1976 г.). Алюминий. Содержится в природных и незагрязненных водоисточниках в виде малотоксичных соединений и случаи отравления им людей и животных не описаны. Концентрация его в природных водах колеблется от 0,001 до 10 мг/л Хлорид алюминия в концентрации 0,1 мг/л придает воде слабый горьковато-вяжущий привкус в 2 балла и запах в 2 балла (0 баллов - никакого привкуса/запаха, 1 - очень слабый, 2 - слабый, 3 - заметный, 4 - отчетливый и 5 баллов очень‘сильный привкус/запах) - 0,5 мг/л (на А13+). Нитрат алюминия в концентрации 0,1 мг/л (на А13+) сообщает привкус в 2 балла. Влияние на человека и теплокровных животных. Отличается незначительным токсическим действием, но многие его растворимые в воде неорганические соединения, сбрасываемые в водоемы с промышленными сточными водами, сохраняются в растворенном состоянии длительное время и могут оказывать вредное действие на человека и теплокровных животных через питьевую воду. Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты и др. Растворимые в воде соединения алюминия накапливаются в тканях. Обществом стандартов США соединения алюминия по степени токсичности приравнены к мышьяку, никелю, меди и марганцу. Токсическое действие на человека при приеме внутрь оказывают следующие дозы соединений алюминия (мг/кг массы): а) ацетат алюминия 0,2-0,4; б) гидроокись алюминия 3,7-7,3; в) алюмокалиевые квасцы 2,9. ПДК для питьевой воды 0,5 мг/л. Влияние на водные организмы. Наиболее, вредные для рыб соединения алюминия - нитрат, хлорид и гидроксид. Менее токсичны сульфат и квасцы. Ион алюминия вредно действует на низшие водные организмы, участвующие в самоочищении водоемов и представляющие собой кормовые ресурсы для рыб, а также на микроорганизмы. Влияние на сельскохозяйственные культуры. Алюминий оказывает вредное действие на растения, начиная с концентрации 1 мг/л воды. Поэтому использование алюминийсодержащих сточных вод для орошения сельскохозяйственных культур нецелесообразно, так как алюминий может погубить растения. Железо. В природных водах и источниках питьевого водоснабжения содержание железа колеблется в больших пределах - от 0,01 до 26,0 10 мг/л. Железо в концентрации более 0,05 мг/л придает воде желтоватую окраску, а в концентрации 1 мг/л - металлический привкус. Сульфат и хлорид железа сообщают воде привкус в концентрации 0,1-0,2 мг/л. ПДК для питьевой воды 0,3 мг/л. Влияние на человека и теплокровных животных. Соединения железа для людей и теплокровных животных при введении внутрь малотоксичны. ЛДзо (летальная доза, при которой гибнет 50% особей) для крыс, получавших с питьевой водой растворимые соединения хлорида железа, составила 900 мг/кг массы. Абсолютная смертельная доза хлорида железа при приеме внутрь через сутки составила: для кроликов 890 мг/кг, для крыс 984-1986 мг/кг массы; сульфата железа - для кроликов 2778,8 мг/кг, для крыс - 1389-2778 мг/кг массы. Влияние на водные организмы. При поступлении в водоемы хлоридов, сульфатов и нитратов железа оно выпадает в осадок в виде гидроксида. Но малые концентрации железа остаются в растворе и при низком значении pH оказывают токсическое действие на рыб и мелкие водные организмы. Железо в концентрации в воде 1000 мг/л убивает рыб за несколько часов. Механизм вредного действия железа на рыб сводится к тому, что железо, находящееся в воде в виде гидроксида, осаждаясь на слизистой оболочке жабр рыб, закупоривает их и разъедает. В щелочной среде железо гибельно для рыб даже в концентрации 0,9 мг/л. Для карпа железо гибельно в концентрации 0,9 мг/л при pH 5,5 и ниже; для щуки, линя и форели железо гибельно в концентрации 1-2 мг/л при pH 5,0-6,7; при концентрации 0,52 мг/л оболочка икры байкальского омуля покрывалась хлопьями оксида железа (III) и почти утрачивала механическую прочность, что вызывало нарушение газообмена эмбриона с окружающей средой и гибель икры. Вредная концентрация хлорида железа (III) составляет (на ион железа) для водного ослика 5 мг/л, для молоди дафний 18 мг/л, для взрослых дафний 21 мг/л через 48 часов. Железо в концентрации 1,25 мг/л снижает БПК5 (биологическое потребление кислорода за 5 суток) разведенных сточных вод на 1,51 мг/л по сравнению с контрольными пробами. Хлорид железа (II) в сточных водах в концентрации 5 мг/л (на ион железа) задерживает образование активного ила на очистных сооружениях и сбраживание осадка в метатенках; при этой концентрации гибнет микрофлора биологических фильтров. 11 Кадмий. Содержится в природных водах и даже в атмосферных осадках. Концентрация кадмия в воде составляет в среднем 0,0013 мг/л. Максимальная концентрация кадмия, которая была обнаружена в питьевой воде, составляла 3,94 мг/л. При использовании пластмассовых труб для прокладки водопроводных сетей кадмий обнаруживается в питьевой воде. При концентрации кадмия более 2 мг/л вода становится мутной, а при 25 мг/л ощущается вяжущий привкус. Влияние на человека и теплокровных животных. Кадмий относится к числу особо ядовитых веществ. Смертельная доза для человека составляет 150 мг/кг массы через 1,5 ч после поступления в организм. Смертельная доза для собак - 150-600 мг/кг массы, для мышей 50-100 мг/кг массы, для кроликов 300-500 мг/кг массы. Кадмий способен накапливаться в организме, особенно сильно в печени, почках, поджелудочной и щитовидной железах. В опытах на хомяках доказано тератогенное и мутагенное действие кадмия на организм. Влияние на водные организмы. При концентрации кадмия в воде 0,00017 мг/л снижается репродукция дафний; при концентрации 0,008 мг/л наблюдается гибель форели. При концентрации хлорида кадмия 0,001 мг/л наблюдается гибель карпа через 8,7-18 часов; 0,0026 мг/л - гибель дафнии; 0,01 мг/л - гибель карася через 8-18 часов и форели через 7 суток. При концентрации нитрата кадмия 0,1 мг/л - гибель водорослей и дафний; 0,118мг/л - гуппий; 0,3 мг/л - гибель колюшки через 7 суток. Выше было отмечено кумулятивное действие кадмия на водные организмы. Даже при кратковременном пребывании в аквариуме с кадмием (одна неделя) в печени рыб обнаружено кадмия 4,91-6,71 мг/кг массы и в почках 2,26-4,13 мг/кг массы. Сульфат кадмия в концентрации 0,1 мг/л тормозит БПКз речной воды, а 1 мг/л - сточных вод. При концентрации кадмия в воде 0,1 мг/л БПК5 снижается на 18-24 % и угнетаются процессы нитрификации (превращение аммонийных ионов в нитрит-ионы и потом в нитрат-ионы под действием нитрифицирующих микроорганизмов). Кадмий в концентрации 1-5 мг/л вредно действует на очистные сооружения канализации. Сбраживание осадков сточных вод в метатенках замедляется при концентрации кадмия 1 мг/л. Влияние на сельскохозяйственные культуры. Кадмий в воде при концентрации 28 мг/л при поливе причиняет вред сахарной свекле. Хлорид, нитрат и сульфат кадмия в концентрации 50 мг/л токсичны для растений. ОДК кадмия (ориентировочно допустимые концентрации) с учетом фона 0,5 мг/кг для песчаных и супесчаных почв, 1,0 мг/кг для кислых (суглинистых и глинистых) почв, 2,0 мг/кг для близких к нейтральным и нейтральных (суглинистых и глинистых) почв. Кобальт. В природных водах содержится в концентрациях 0,0001- 0,001 мг/л. Влияние на человека и теплокровных животных. Токсическое действие на молодых телят соединения кобальта оказывают при поступлении внутрь в дозе 0,9 мг/кг массы, гибель собак вызывает доза 30 мг/кг массы. Нитрат кобальта при приеме внутрь в дозе 250 мг/кг массы вызывает гибель кроликов. Соединения кобальта проявляют канцерогенное и мутагенное действие. Влияние на водные организмы. Летальные концентрации кобальта (II) для линя составляют 150 мг/л, для карпа -125 мг/л, для радужной форели - 35 мг/л, для бокоплава - 8 мг/л, для корюшки и карася - 10 мг/л. ЛКзо составляет для дафний - 1,32 мг/л, для циклопов - 15,5 мг/л. Кобальт снижает способность воспроизводства дафний в концентрации 0,01 мг/л, он кумулируется из воды тканями водных организмов и обнаружен в теле речных моллюсков в количестве 0,3 мг/кг и речных рыб 0,09 мг/кг массы. Кобальт в концентрации 5 мг/л тормозит процессы самоочищения водоемов. Хлорид кобальта в концентрации 0,9 мг/л (по металлу) снижает БПКз разведенных сточных вод на 5%, в концентрациях 5-10 мг/л тормозит БПКз сточных вод, их аммонификацию и нитрификацию. Хлорид кобальта в концентрации 64 мг/л снижает БПКз разведенных сточных вод на 50%. Влияние- на сельскохозяйственные культуры. Соединения кобальта токсичны для растений при поливе сточными водами, содержащими хлорида и нитрата кобальта в концентрации каждого 0,3 мг/л, а сульфата при 0,1 мг/л. Кобальт оказывает вредное действие на помидоры в концентрациях 0,1-0,27 мг/л, на лен - в концентрации 1 мг/л, на сахарную свеклу - 5,9 мг/л. Сульфат 13 кобальта в концентрации 2 мг/л (по металлу) задерживает рост растений и приводит к их засыханию. Кобальт кумулируется овощами, что было установлено при поливе сточными водами, содержащими кобальт. Марганец. В реках марганец содержится в концентрациях 0,001-0,16 мг/л, в водопроводной воде средняя концентрация 0,05 мг/л. Марганец в концентрации более 0,05 мг/л окрашивает воду в темный цвет, в концентрации 0,1 мг/л делает воду мутной, металлический привкус воды появляется при концентрации 0,5 мг/л. Хлорид марганца в концентрации 1 мг/л и сульфат марганца в концентрации 4 мг/л (по металлу) придают воде привкус в 1 балл, а диоксид марганца при концентрации 10 мг/л окрашивает воду и снижает её прозрачность. ПДК для питьевой воды 0,1 мг/л. Влияние на человека и теплокровных животных. Марганец предположительно оказывает мутагенное действие на теплокровных животных. Влияние на водные организмы. Для водных организмов марганец малотоксичен. Смертельная концентрация марганца в воде составляет для бокоплава - 70 мг/л, для радужной форели - 100 мг/л, для карпа - 650 мг/л, для дафний - 50 мг/л; токсическая концентрация составляет для бокоплава - 15 мг/л, для радужной форели - 75 мг/л, для карпа - 600 мг/л. Наиболее токсичен хлорид марганца. Хлорид марганца вызывает гибель карпозубой рыбы при концентрации марганца 12 мг/л (по металлу) через 6 суток, дафний - при концентрации 50 мг/л (по металлу). Перманганат калия токсичен для карася в концентрации (по марганцу) 10 мг/л, нитрат марганца в концентрации 50 мг/л проявляет токсичность для корюшки через 160 часов. Марганец снижает БПКз воды по сравнению с контрольной пробой при концентрации 0,001 мг/л - на 2 %, при 0,01 мг/л - на 10 %, при 0,1 мг/л - на 21 %, при 0,5 мг/л - на 24 %, при 1,0 мг/л - на 29 %. Марганец не оказывает влияние на БПКз воды даже в концентрации до 100 мг/л. Влияние на сельскохозяйственные культуры. Марганец оказывает токсическое действие на растения в концентрации 2 мг/л; на бобовые 1-10 мг/л, на рассаду апельсинов и мандаринов 5 мг/л, на помидоры 5-10 мг/л, на соевые бобы и лен 10-25 мг/л. Медь. В природных водах и источниках водоснабжения нашей, страны содержится в небольших концентрациях, как правило, 14 порядка 103 мг/л. Следует отметить большие колебания в концентрациях меди в водоемах и источниках водоснабжения - от 0,001 до 0,98 мг/л. Вблизи меднорудных предприятий - до 100 мг/л. Медь придает воде неприятный привкус при концентрации 1,5 мг/л, окрашивает воду при концентрации 0,5 мг/л и снижает её прозрачность при концентрации 1,0 мг/л. Влияние на человека и теплокровных животных. Смертельная доза для человека составляет 10 г/кг массы, доза 60-100 мг/кг массы вызывает тошноту, рвоту, гастроэнтерит, а доза 10-30 мг/кг массы не оказывает токсического действия при потреблении меди внутрь в течение нескольких недель. ЛД50 для теплокровных животных при приеме внутрь составляет (на металл): хлорида меди - 140 мг/кг, карбоната меди - 159 мг/кг, сульфата меди - 300 мг/кг, нитрата меди - 340 мг/кг массы. Медь в концентрации 1 мг/л токсична для сельскохозяйственных животных. По некоторым сведениям медь проявляет мутагенное действие. ПДК для питьевой воды 1,0 мг/л. Влияние на водные организмы. ЛК50 для рыб 0,002 мг/л, для дафний - 0,005 мг/л, для сине-зеленых водорослей - 0,01 мг/л. БПК5 разведенных сточных вод снижается при концентрации меди 0,001 мг/л на 7 %, при 0,05 мг/л - на 24 %, при 0,1 мг/л - на 37 %, при 0,5 мг/л - на 46 %. БПКз сточных вод снижается при концентрации меди 0,04 мг/л на 10 %, при 0,05 мг/л - на 20 %. При концентрации меди 0,01 мг/л тормозятся процессы самоочищения водоемов. При концентрации 0,4-0,5 мг/л медь губительно действует на микрофлору и тормозит биологические процессы очистки сточных вод, задерживает размножение микроорганизмов, аммонификацию и нитрификацию сточных вод; при концентрации меди 1,0 мг/л заметно тормозятся процессы аэробной очистки сточных вод активным илом, уменьшается количество окисленного азота в сточных водах, задерживается образование активного ила. Влияние на сельскохозяйственные культуры. Поступая со сточными водами в почву при поливе, медь кумулируется почвой и растениями, оказывает на них вредное действие, начиная с концентрации 0,1 мг/л. ОДК с учетом фона 33 мг/кг для песчаных и супесчаных почв, 66 мг/кг для кислых (суглинистых и глинистых) почв, 132 мг/кг для близких к нейтральным и нейтральных (суглинистых и глинистых) почв. 15 НикеЛь. В реках России никель содержится в концентрациях 0,0008- 0,0056 мг/л. В источниках водоснабжения он обнаружен в количестве в среднем 0,0117 мг/л. Сульфат и хлорид никеля сообщают воде металлический привкус в концентрации 50 мг/л, окрашивают воду в концентрации 1000 мг/л, на запах не ощущаются. В концентрации 1 мг/л никель заметно увеличивает мутность воды. Влияние на человека и теплокровных животных. Смертельная доза для теплокровных животных составляет 34 мг/кг массы, для собак - 10-20 мг/кг массы. Никель способен вызывать аллергические реакции (“никелевая чесотка”, экзема), всасываться кожей и оказывать общетоксическое действие. По некоторым данным никель обладает канцерогенным и мутагенным действием. Влияние на водные организмы. Нахождение в воде, загрязненной никелем в концентрациях, указанных ниже, в течение 96 часов приводит к гибели следующих водных организмов: комаров - 8,6 мг/л, гаммарид - 13,0 мг/л, моллюсков - 11,4 мг/л, щетинкового червя - 14,1 мг/л, улиток - 14,3 мг/л. Токсическое действие проявляется на гольяна при концентрации 0,38 мг/л, на бокоплава - при 2,5 мг/л, на радужную форель - при 25,0 мг/л, на карпа - при 45,0 мг/л. Начиная с концентрации 1,0 мг/л, никель снижает эффективность биологической очистки сточных вод, ослабляет интенсивность процессов нитрификации активного ила, значительно снижает аэробное окисление сточных вод на биологических фильтрах; при концентрации 2,0 мг/л никель оказывает токсическое действие на микрофлору метантенков и тормозит сбраживание осадка. Влияние на сельскохозяйственные культуры. Вредное действие на растения при поливе вызывает концентрация никеля 0,5 мг/л. Никель вызывает хлороз овса при концентрации 1 мг/л, а при концентрации 2,5 мг/л - задержку роста. Сульфат никеля в концентрации 2,5 мг/л вызывает гибель растений. ОДК с учетом фона 20 мг/кг для песчаных и супесчаных почв, 40 мг/кг для кислых (суглинистых и глинистых) почв, 80 мг/кг для близких к нейтральным и нейтральных (суглинистых и глинистых) почв. Олово. Олово содержится в реках в концентрациях 103 мг/л, а в источниках водоснабжения - 10 4 - 10 2 мг/л. 16 Влияние на человека и теплокровных животных. Отравления людей соединениями олова при их поступлении в организм человека с питьевой водой не известны. Крысы переносят без вреда олово (в виде тартрата) в суточном рационе питания в количестве 25 мг/кг массы в течение 4-12 месяцев. Доза олова 20 мг/кг массы в виде тартрата или хлорида при поступлении в организм кошек переносится ими без заметного вреда в течение 3 месяцев. Влияние на водные организмы. Олово оказывает токсическое действие на рыб в концентрации 2 мг/л, снижает способность воспроизведения дафний при 0,35 мг/л. Средняя смертельная концентрация сульфата олова (по металлу) при действии в течение 96 часов для гольяна составляет: в мягкой воде - 0,78 мг/л, в жесткой воде - 33,4 мг/л. Олово в концентрации 9 мг/л тормозит сбраживание осадка в метантенках. Свинец. В природных водах свинец содержится в концентрациях 0,001-0,023 мг/л. В бытовых сточных водах содержание свинца составляет в среднем 0,48 мг/л, а в осадке метантенков 2 мг/кг. Свинец придает воде металлический привкус в концентрации 2 мг/л. Концентрация нитрата, ацетата и хлорида свинца - 100 мг/л придает воде привкус в 2 балла. Концентрация свинца 300 мг/л придает воде кислый привкус. Влияние на человека и теплокровных животных. При концентрации свинца в питьевой воде 0,042-1,0 мг/л наблюдались случаи хронического отравления людей. Свинец обладает синергическим действием и увеличивает токсичность других металлов. По некоторым данным свинец проявляет мутагенное действие на организм. Острое отравление теплокровных животных при поступлении в организм внутрь вызывают сравнительно большие дозы свинца. Минимальная смертельная концентрация для морских свинок составляет: в случае карбоната свинца - 1000 мг/л, оксида свинца - 2000 мг/л, хлорида свинца - 1500-2000 мг/л, нитрата свинца - 2000 мг/л. При приеме внутрь соединений свинца с питьевой водой в течение длительного времени токсические концентрации значительно меньше - 0,18 мг/л (по свинцу). В опытах на крысах фосфат свинца оказывал канцерогенное действие. ПДК для питьевой воды 0,03 мг/л. 17 Влияние на водные организмы. Нитрат свинца оказывает гибельное действие на рыб в концентрации 0,1-0,16 мг/л, на бактерии - 0,5 мг/л, на дафнии - 5,0 мг/л; хлорид свинца - на рыб в концентрации 0,33-1,0 мг/л, на простейшие организмы - 0,01-0,5 мг/л, на дафнии - 0,5 мг/л; сульфат свинца - на рыб в концентрации
Концентрация свинца 0,1 мг/л тормозит биохимические процессы самоочищения водоемов, а 0,5 мг/л угнетает нитрификацию сточных вод. В концентрации 0,015 мг/л заметно снижает БПК5 сточных вод, а в концентрации 0,35 мг/л снижает на 10 %. Нитрат свинца в концентрации 0,1 мг/л в небольшой степени тормозит процессы минерализации сточных вод и снижает БПКз на
Свинец в концентрации 0,07 мг/л вредно действует на очистные сооружения канализации, в концентрации 0,1 мг/л вредно действует на активный ил аэротенков и биофильтры, затрудняет биологическую очистку сточных вод. Свинец в концентрации 1 мг/л губительно действует на аэробные бактерии. Безвредная концентрация, не оказывающая тормозящего действия на сбраживание осадка в метантенках, составляет 4,2 мг/л. Влияние на сельскохозяйственные культуры. Свинец способен кумулироваться почвой и растениями. Свинец токсичен для растений в концентрации более 5 мг/л. ОДК с учетом фона 32 мг/кг для песчаных и супесчаных почв, 65 мг/кг для кислых (суглинистых и глинистых) почв, 130 мг/кг для близких к нейтральным и нейтральных (суглинистых и глинистых) почв. Серебро. В природных водах содержится в концентрациях 0,0001- 0,085 мг/л, в питьевой воде - 0,0008 мг/л. Концентрации 0,00001-0,5 мг/л не изменяют органолептических свойств воды. Влияние на человека и теплокровных животных. В повышенных концентрациях серебро в питьевой воде оказывает токсическое и кумулятивное действие на организм, смертельная доза нитрата серебра для человека составляет 10 г. Серебро в концентрации 0,01 мг/л, применяемой для стерилизации воды, не оказывает на людей токсического действия, не раздражает 18 слизистые оболочки желудочно-кишечного тракта, не изменяет вкуса воды. Многие соли серебра при поступлении в организм в суммарном количестве 1 г вызывают аргирию - окрашивание в голубовато-серый цвет кожи, глаз, слизистых оболочек. Безвредная для людей доза серебра (по металлу) 0,0025 мг/кг массы или концентрация 0,05 мг/л. В опытах на крысах доказано канцерогенное действие серебра. Влияние на водные организмы. Серебро в концентрации 0,000001-0,5 мг/л вызывает гибель микроорганизмов; 0,003 мг/л (нитрат) - гибель колюшки, 0,004 мг/л - гибель 50 % особей гуппи, молоди лосося, других рыб; 0,005 мг/л - гибель рыб и дафнии; 0,01 мг/л - гибель бактерий; 0,04 мг/л оказывает токсическое действие на кишечную палочку. Серебро в концентрации 0,03 мг/л снижает БПКз разведенных сточных вод на 25 %, а 1 мг/л - на 81 %. Нитрат серебра в концентрации 10 мг/л снижает содержание кислорода в водоеме на 84 %, а тиосульфат серебра не оказывает действия даже в концентрации 100 мг/л. Хлорид серебра при концентрации 10 мг/л снижает эффект биологической очистки сточных вод канализации на 43 %, а тиосульфат серебра при этой концентрации не оказывает вредного действия. Стронций. В поверхностных водах содержится в концентрациях 0,06-5,0 мг/л. Порог восприятия привкуса для хлоридов стронция - 13 мг/л, для нитрата стронция - 12 мг/л; порог восприятия запаха - концентрации в 20-30 раз большие. Влияние на человека и теплокровных животных. При поступлении в организм в больших дозах стронций оказывает общетоксическое действие, главным образом как нервный и мышечный яд. Гидроксид стронция вызывает ожоги слизистой оболочки и кожи. При попадании в глаза даже в ничтожных концентрациях причиняет глубокие повреждения. Соли стронция при приеме внутрь вызывают понос и параличи. Из соединений стронция наибольшей токсичностью отличается салицилат стронция, наименьшей - бромат, промежуточное место по токсичности занимают иодат, нитрат и лактат. 19 ЛДюо нитрата стронция при приеме внутрь составляет для мышей 3 г/кг, для крыс 5 г/кг массы; ЛД50 для мышей при введении внутрь составляет 2166,6 мг/кг, а для крыс - 3000 мг/кг массы. В продолжительных по времени опытах на белых мышах и кроликах при поступлении в организм с питьевой водой безвредной была концентрация стронция 2,8 мг/л. ПДК для питьевой воды 7,0 мг/л. Влияние на водные организмы. В концентрации 42 мг/л стронций снижает воспроизводство потомства у дафний. ЛК50 стронция составляет для дафний 75 мг/л, для циклопов - 300 мг/л. Нитрат стронция в концентрациях более 1500 мг/л оказывает гибельное действие на рыб. Влияние на сельскохозяйственные культуры. Стронций в воде в концентрации 100 мг/л оказывает токсическое действие на растения. Вредное влияние на процессы самоочищения водоемов стронций оказывает в очень больших концентрациях. Хром. Поверхностные воды содержат хром в концентрациях 10 2 - 10'3 мг/л, но в ряде случаев максимальная его концентрация много выше - достигает 0,112 мг/л, в водопроводной воде - средняя концентрация составляет 0,0023 мг/л, максимальная - 0,079 мг/л. Соединения хрома (VI) в водоемах очень стабильны; в анаэробных условиях хром (VI) переходит в хром (III), соединения которого выпадают в осадок. В щелочной среде осаждение происходит быстрее. Хромат и бихромат калия в концентрации 1 мг/л придают воде горький привкус интенсивностью в 3 балла; запах не ощущается даже в концентрации 50 мг/л. Сульфат хрома при концентрации 4 мг/л (по металлу) придает воде неприятный привкус, при 2 мг/л - окрашивает воду в голубоватый цвет, при 1 мг/л увеличивает мутность воды. Влияние на человека и теплокровных животных. Соединения хрома (VI) оказывают на организм общетоксическое, раздражающее, кумулятивное, аллергенное, канцерогенное и мутагенное действие. При поступлении в организм собаки с питьевой водой в дозе 1,8 мг/кг массы в течение суток бихромат калия вызывает рвоту, понос, потерю аппетита, затрудненное дыхание, замедленное кровообращение; одноразовая доза 2,3 мг/кг массы вызывает гибель животного. Влияние на водные организмы. ЛК50 хрома (VI) для рыб 30-50 мг/л, для лососевых рыб опасна даже концентрация хрома (VI) 0,02 20 мг/л. JIKso хрома (III) для рыб 117 мг/л. JIKso хрома (VI) для дафний составляет 0,022 мг/л, для циклопов - 10 мг/л. Соединения хрома (VI) и хрома (III) губительно действуют на флору и фауну водоемов и тем самым тормозят процессы самоочищения. При концентрации хрома (VI) 0,001 мг/л БПК5 сточных вод снижается на 1,4 %; при 0,01 мг/л БПКз сточных вод снижается на 5,7 %; при 0,05 мг/л тормозится нитрификация сточных вод; при концентрации хрома (VI) 0,1 мг/л БПК5 сточных вод снижается на 13-15,8 %, замедляется аммонификация и угнетается нитрификация сточных вод. Хром (III) оказывает менее вредное действие на процессы самоочищения водоемов и снижает БПКб сточных вод при концентрации 1 мг/л на 10 %, Из отдельных соединений хрома (III) особенно вредное действие на процессы самоочищения водоемов оказывают хлорид и сульфат. Хром (VI) в концентрации 1 мг/л приводит к заметному уменьшению образования осадка в отстойниках, резко усиливает образование пленки на поверхности биофильтров, а при концентрации 2-5 мг/л оказывает токсическое действие на микрофлору сооружений биологической очистки сточных вод. Хром (III) в концентрации 1 мг/л задерживает сбраживание осадка на очистных сооружениях, а 10 мг/л тормозит сбраживание осадка в метантенках. При низкой температуре выпадение в осадок соединений хрома (III) замедляется, поэтому отстойники должны находиться в отапливаемых помещениях, иначе зимой осаждение происходить не будет. Влияние на сельскохозяйственные культуры. Хром в концентрации 5 мг/л вредно действует на растения, при концентрации 10 мг/л - наблюдается заметно выраженный хлороз, а при 15 мг/л задерживается рост. В присутствии никеля вредное действие хрома проявляется при концентрации 2 мг/л. Хром кумулируется в тканях растений. Все эти данные свидетельствуют о невозможности использования хромсодержащих вод для полива сельско хозяйственных культур. Цинк. В природных водах цинк содержится в концентрациях 0,0001- 5,77 мг/л. При концентрации 2 мг/л воде сообщается привкус, при 5 мг/л появляется вяжущий привкус, опалесценция, пескоподобный осадок. 21 При 30 мг/л вода становится непригодной для питья по вкусу и приобретает мутный молочный цвет. Влияние на человека и теплокровных животных. Цинк и его соединения малотоксичны для людей и теплокровных животных при поступлении в организм с пищей и питьевой водой. Концентрация цинка в питьевой воде 11,2-26,6 мг/л переносится людьми без всякого вреда для здоровья. Минимальная летальная доза для теплокровных животных при приеме внутрь составляет для хлорида цинка - 100 мг/кг, сульфата цинка - 750 мг/кг массы. Вместе с тем в литературе приводятся данные о канцерогенном действии цинка при его содержании в питьевой воде в концентрациях 10-20 мг/л. В длительных опытах на мышах в течение 2-3 лет установлена возможность развития раковой опухоли при концентрации цинка в воде 5-20 мг/л. До некоторым данным цинк проявляет мутагенное действие на организм. ПДК для питьевой воды 5,0 мг/л. Влияние на водные организмы. Для рыб цинк во много раз токсичнее, чем для людей и теплокровных животных, и его вредное действие проявляется намного раньше, чем изменяются органолептические свойства воды. Нитрат цинка в концентрации 0,2 мг/л (по металлу) оказывает токсическое действие на гольяна через 270 суток при 1 ГС, а сульфат цинка в концентрации 0,4 мг/л вызывает гибель колюшки через 7 суток. Цинк оказывает вредное действие на низшие водные организмы (кормовые ресурсы рыб), начиная с концентрации 0,07 мг/л, т.е. степень токсичности цинка для них примерно такая же, как и для рыб. Цинк способен к кумуляции тканями рыб и низших водных организмов. БПК5 разбавленных сточных вод снижается на 4 % при концентрации цинка 0,1 мг/л, на 10 % - при 0,3 мг/л, на 12 % - при 0,5 мг/л, на 25 % - при 7,0 мг/л. При концентрации цинка 5,0 мг/л тормозится нитрификация разбавленных сточных вод. Цинк в концентрации 0,5 мг/л вредно влияет на эффективность биологической очистки сточных вод. и на активный ил, в концентрациях 1-3 мг/л тормозит биологическую очистку. В концентрации 2,2 мг/л цинк оказывает^ токсическое действие на микрофлору метантенков и тормозит сбраживание осадка сточных вод, в концентрации 5,1 мг/л значительно снижает аэробное 22 окисление на сооружениях биологической очистки сточных вод канализации при длительном действии. Влияние на сельскохозяйственные культуры. Цинк в концентрациях 1 мг/л воды и даже 0,1 мг/л вредно действует на сельскохозяйственные культуры. Цинк кумулируется почвой, поэтому сточные воды, содержащие цинк, непригодны для орошения сельскохозяйственных культур. ОДК с учетом фона 55 мг/кг для песчаных и супесчаных почв, 110 мг/кг для кислых (суглинистых и глинистых) почв, 220 мг/кг для близких к нейтральным и нейтральных (суглинистых и глинистых) почв. Соединения аммония. В водоемах NHU+ -ион содержится в концентрациях 0,0-0,2 мг/л. В местах, где применяются аммиачные удобрения, его концентрация в поверхностных водах достигает 2,2 мг/л. Соединения аммония в концентрации 100 мг/л (по азоту) не оказывает влияния на окраску воды, прозрачность, запах; привкус в 1 балл обнаруживается при концентрациях аммония 5-10 мг/л, в 2 балла при концентрациях 10-15 мг/л. Гидроксид аммония. Пороговая концентрация по органолептическим свойствам воды 0,5 мг/л. Раздражает желудочно-кишечный тракт и кожные покровы человека и теплокровных животных. Смертельные концентрации для рыб 2,0-10,0 мг/л, для дафний 9-20 мг/л. Сульфат аммония. Пороговая концентрация по органолептическим показателям - 0,5 мг/л. Смертельные концентрации для рыб 66,0-400,0 мг/л, для дафний 292 мг/л. Сульфат аммония в концентрации 20 мг/л оказывает вредное воздействие на процессы самоочищения водоемов. Хлорид аммония. ЛД50 для крыс составляет 30 мг/кг массы. Оказывает местное раздражающее действие на кожу. Доза 1 мг/кг массы или концентрация 20 мг/л воды вызывает у теплокровных животных дегенеративные изменения слизистой оболочки желудочно-кишечного тракта. Смертельные концентрации для рыб 300-500 мг/л, для дафний 20-90 мг/л. 23 Хлорид аммония в концентрации 20 мг/л не влияет на процессы самоочищения водоемов. Нитраты. В поверхностных водах содержатся в концентрациях 0,1-
При содержании нитратов в воде более 0,3 мг/л в водоемах усиливается рост водорослей. ЛД50 для молоди чавычи - 5800 мг/л через 96 ч при 16 ”С и 4800 мг/л через 168 ч; для молоди радужной форели - 6000 мг/л при 14 °С через 96 ч и 4700 мг/л через 168 ч. Сульфаты. В природных водах содержится от нескольких миллиграмм на литр воды до насыщенных растворов (сульфат натрия и магния), в дождевых водах - от 1 до 10 мг/л, в реках Европейской части РФ средняя концентрация - 26,6 мг/л. Порог ощущения привкуса сульфатов: натрия - 150-500 мг/л, калия - 650 мг/л, кальция - 70-370 мг/л, магния - 250-600 мг/л. Сульфаты малотоксичны для человека и теплокровных животных. Смертельная доза для человека - 45 г; смертельная концентрация для крупного рогатого скота - 2000 мг/л. Сульфаты в концентрации 1000-2000 мг/л вызывают расстройства желудочно- кишечного тракта, при этом сульфат магния оказывает вредное действие при меньших концентрациях. Токсическое действие на детей оказывают сульфаты при длительном употреблении воды с содержанием 21 мг/кг массы или в концентрации 600-1000 мг/л. ПДК для питьевой воды 500,0 мг/л. Для водных организмов сульфаты малотоксичны. Средняя смертельная концентрация через 96 ч составляет для дафний 630 мг/л. Смертельная концентрация для рыб составляет: сульфат калия
Оценка возможности использования сульфатов в воде для орошения сельскохозяйственных культур: менее 192 мг/л - очень хорошая; 192-336 мг/л - хорошая; 336-576 мг/л - допустимая; 576-960 мг/л - вредная; более 960 мг/л - непригодная. Сульфаты оказывают разрушающее действие на бетон гидротехнических и других сооружений: при содержании сульфатов 24 в воде до 300 мг/л - действия нет или оно очень слабое; при 300-1000 мг/л - действие умеренное и при концентрации более 1000 мг/л - быстрое. Хлорилы. В природных водах Европейской части РФ хлориды содержатся в среднем в концентрации 6,5 мг/л, в источниках водоснабжения - 1,5-650 мг/л. Хлориды в концентрации 1500 мг/л воды опасны для крупного рогатого скота, овец, свиней, домашних животных и домашней птицы, а в концентрациях более 4000 мг/л вызывают их гибель. ПДК для питьевой воды 350,0 мг/л. Хлориды малотоксичны для водных организмов: токсическое действие на форелей оказывают хлориды в концентрации 400 мг/л, на окуня и щуку - 4000 мг/л, на некоторые другие виды рыб - 2000 мг/л, на икру карпа 4500-6000 мг/л. На растения хлориды оказывают вредное действие в концентрациях 100-350 мг/л, на мандарины - 50 мг/л, на лимоны даже 30 мг/л. Фосфаты. В природных водах содержатся в концентрациях 0,002-
Токсические дозы ортофосфата натрия составляют для человека 450 г, для кроликов - 15 г; пирофосфата натрия - 90 и 2 мг/л и метафосфата натрия 120 и 4 мг/л соответственно. ПДК полифосфатов (РО43 ) для питьевой воды составляет 3,5 мг/л. Интенсивный рост водорослей в водоемах происходит при содержании фосфатов более 0,01 мг/л, при концентрациях более 0,2 мг/л скорость роста водорослей резко увеличивается. При содержании фосфатов 0,2-1,4 мг/л продуктивность рыб возрастает в
Фосфаты необходимы для питания микрофлоры очистных сооружений канализации, участвующей в биологической очистке сточных вод, из расчета 1 часть фосфора на 90-150 частей БПК5 стоков. Синильная кислота и цианиды. Порог восприятия запаха - 0,001 мг/л. Чрезвычайно токсичны для человека и теплокровных животных. Средняя смертельная доза для человека - 50-60 мг, по некоторым данным - 0,7-3,5 мг/кг массы. Смертельная доза для крупного рогатого скота 0,39-0,92 г, для овец - 0,04-0,10 г, для лошадей - 0,39 г, для собак - 0,03-0,04 г. Смертельная концентрация 25 для крупного рогатого скота 103 мг/л. Очень токсичны для водных организмов. Токсическая концентрация синильной кислоты для форели 0,07 мг/л, для ушастого окуня 0,16 мг/л. Цианид калия. Минимальная смертельная . доза для теплокровных животных при приеме внутрь 0,01 мг/кг массы. Токсические концентрации для водных организмов: для карася 0,04- 0,12 мг/л, для форели 0,07 мг/л через 74 ч. Смертельная концентрация для гольца 0,09 мг/л, для карася 0,1-0,3 мг/л. В концентрации 15 мг/л снижает БПК5 разведенных сточных вод на 50 %. Цианид натрия. Смертельная доза при приеме внутрь для человека 0,2 г. Минимальная смертельная доза для теплокровных животных при приеме внутрь 3,3 мг/кг массы. ЛКюо для форели через 124 ч 0,05 мг/л. Концентрация 0,3 мг/л токсична для гольяна, гольян гибнет через 1 ч при концентрации 0,4 мг/л. Снижает нитрификацию сточных вод в концентрации 2 мг/л. Уротропин. Придает воде: запах в 1 балл в концентрации 1000 мг/л; привкус в 1 балл - в концентрации 60 мг/л, 2 балла - 130 мг/л. Пороговая концентрация по влиянию на санитарный режим водоемов - 0,3 мг/л, по влиянию на теплокровных животных - 2 мг/л (доза 0,1 мг/кг массы). ПДК для водоёмов установлена 0,5 мг/л по санитарно-токсикологическому показателю вредности. Этилендиамин. Придает воде: запах в 1 балл в концентрации 0,21 мг/л, 2 балла - 0,85 мг/л; привкус в 1 балл - в концентрации 0,846 мг/л, 2 балла - 2,5 мг/л. Пороговая концентрация по влиянию на санитарный режим водоемов - более 0,21 мг/л. Для пескарей летальная концентрация 30-60 мг/л; рыбы переносили 30 мг/л, но погибли при 60 мг/л; для водорослей Сценедесмус токсична концентрация 20 мг/л, для дафний летальная концентрация 8 мг/л, а на кишечную палочку губительное действие оказывает лишь 200 мг/л. ПДК для водоёмов рыбохозяйственного назначения установлена 0,001 мг/л. 26 1.2. Оценка экологической опасности гальванического производства Экологическая опасность гальванического производства определяется главным образом вредным воздействием сточных вод, содержащих компоненты технологических растворов, на поверхностные водоемы. Наиболее уязвимы водоемы рыбохозяйственного назначения. Для оценки степени воздействия сточных вод на окружающую среду введем понятие “экологический критерий (ЭК)”, который определим как отношение конечной концентрации компонента раствора в сбрасываемой (очищенной) воде (Скон) к его ПДК в воде рыбохозяйственных водоемов: Эк = -£г«н_. (1 ,) ПДК Концентрация компонентов в сбрасываемой в водоемы воде СК0И зависит от эффективности работы очистных сооружений, которая определяется степенью очистки (а) сточных вод от того или иного компонента раствора и зависит от концентрации компонентов в сточной воде, подаваемой на очистку,: сх—(Сет - Скон)/Сст , где (1.2) Сет - концентрация компонента в сточной воде, подаваемой на очистку, г/л; Скон - концентрация компонента в очищенной воде, г/л. Концентрация компонента технологического раствора в сточной воде, подаваемой на очистку (Сет), в свою очередь зависит от расхода воды (Q, л/ч) на промывные операции по всему цеху и скорости уноса технологического раствора (q, л/ч) деталями из технологической ванны и определяется кратностью разбавления ту- q/Q “ Сст/Сошах ИЛИ Сет — Сошах * q/Q , где (1.3) Сотах - максимальная концентрация компонента в технологическом растворе, г/л. Преобразовав уравнение (1.2) и подставив в него выражение (1.3), получаем: Скон — Сет ’ (1 “Сх) — Сошах' (1"СС) 1 Cj/Q (1.4) Подставив полученное выражение в уравнение (1.1), получаем: 27 ЭК = ^0шS_x±xtl_a\ (1.5) ПДК Q К ’ Таким образом, экологический критерий прямо пропорционально зависит от концентрации компонента в технологическом растворе, кратности разбавления промывными водами выносимого из ванны раствора и обратно пропорционально зависит от степени очистки сточных вод. Чем больше экологический критерий, тем большую экологическую опасность представляет тот или иной технологический раствор. Следует отметить, что кратность превышения максимальной концентрации компонента в технологическом растворе (Сотах) над его ПДК в воде рыбохозяйственных водоемов (Comax/ПДК) определяет степень экологической опасности (ЭО) компонента раствора: ЭО = Сошах/ПДК (1.6) ЭО характеризует потенциальную опасность компонентов технологических растворов. В табл. 1.1 представлены значения ПДК для воды водоемов рыбохозяйственного назначения и степень экологической опасности токсичных компонентов технологических растворов, которая определялась как отношение всего диапазона (для каждого типа растворов) значений максимальных концентраций компонента в к его ПДК. Из табл. 1.1 видно, что кроме этилендиамина и катапина, наибольшей экологической опасностью обладают ионы тяжелых цветных металлов: Comax/ПДК от (20-^85)- 10б для меди до 0,2- 10б для молибдена. Среди кислотных остатков и лигандов наибольшей экологической опасностью обладают йодидные, фторидные и цианидные компоненты (4,3-*-2)-106, наименьшей - сульфаты, хлориды и нитраты (9-И)103. Аммонийные 2-10s и пирофосфатные (1,1н-4,3)104 соединения занимают промежуточное положение. Экологическую опасность растворов и электролитов определяют суммированием значений степени экологической опасности каждого компонента в растворе. В качестве примера в табл. 1.2 приведена сравнительная оценка экологической опасности наиболее известных электролитов цинкования. Экологический критерий растворов и электролитов, как и всего гальванического производства (цеха, участка), определяют суммированием значений 28 экологического критерия каждого (i-ro) компонента технологических растворов, применяемых в цехе,: эк = £ ПДК Q
(1.7) Полученная зависимость позволяет проводить сравнение технологий нанесения покрытий и очистки сточных вод и выбирать такие растворы, электролиты, способы промывки, а также средства и методы очистки, которые позволяют сократить вредное воздействие гальванопроизводства на окружающую среду. Так, например, при сравнении цинкования из цианистого и кислого электролитов при одинаковых концентрациях ионов цинка в обоих электролитах и системе промывки (q/Q для обеих технологий одинаковы) экологические критерии обеих технологий будут отличаться значениями ЭОх(1-а) для цианид- и сульфат-ионов: ЭКцианид : ЭКсульфат = ЭО цианид X (1 тСс) : ЭОсульфат х (1-а) « 1 : 700, (1.8) то есть из-за практически полной очистки стоков от цианидов (до ПДК) и незначительной степени очистки сточных вод от сульфатов (до 30%) замена цианистого электролита цинкования на кислый с точки зрения воздействия на природную среду не имеет смысла (экологический критерий в сотни раз больше для кислого электролита, чем для цианистого). Этот пример наглядно показывает, что проблема замены цианистых электролитов определяется не столько степенью воздействия на окружающую природу, сколько санитарно-гигиеническими условиями труда при приготовлении и эксплуатации этих электролитов, а также необходимостью организации отдельных систем обезвреживания циансодержащих сточных вод и другими технико-экономическими моментами. Если же заменять цианистые электролиты на аммиакатные, это может вызвать дополнительные трудности при очистке сточных вод, содержащих медь. Замена же цианистых электролитов серебрения на йодистые и роданистые с точки зрения экологической опасности также не имеет смысла (табл. 1.1). 29
|
