Биохимия ЭКЗАМЕН билеты+ответы. Билет 1 Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Билет 31.
Пути обезвреживания аммиака в организме Токсичность аммиака связана с его действием на ЦНС: аммиак проходит сквозь мембраны и проникает в клетки мозга, аммиак взаимодействует с α-кетоглутаратом, что приводит к снижению скорости окисления глюкозы, угнетение обмена АМК из-за снижения концентрации α-кетоглутарата, аммиак усиливает синтез глутамина в нервной ткани, повышается осмотическое давление, развивается отёк мозга, снижение концентрации глу приводит к нарушению обмена нейромедиаторов (ГАМК), это нарушает проведение нервного импульса и вызывает судороги, аммиак в крови и цитозоле образует ион NH4+, накопление которого нарушает трансмембранный перенос ионов натрия и калия, что влияет на проведение нервных импульсов. Источники аммиака в организме: дезаминирование АМК, амидов АМК, биогенных аминов, пуриновых оснований, распад пиримидиновых оснований, образуется в кишечнике с участием бактерий из пищевого белка. Пути обезвреживания аммиака: синтез мочевины, образование амидов АМК, восстановительное аминирование, образование аммонийных солей. Образование амидов АМК 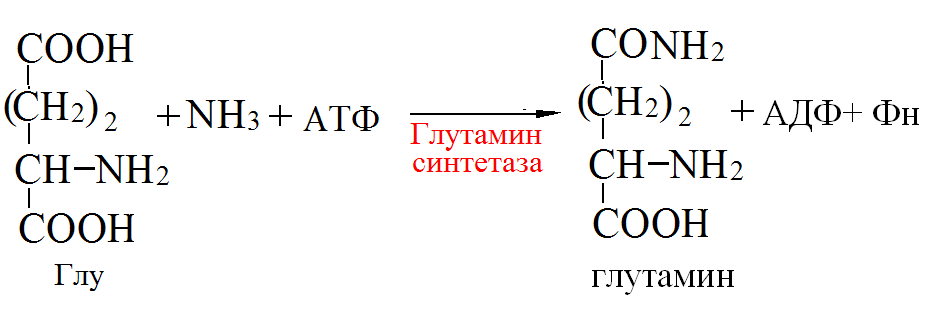 у детей раннего возраста это основной путь обезвреживания аммиака. Глутамин и аспарагин образуются в местах образования аммиака: печень, мозг, мышцы. Глутамин нетоксичен, свободно проходит через клеточную мембрану, форма, в которой транспортируется аммиак, временное хранилище аммиака, используется для синтеза белка, аминосахаров, пуриновых и пиримидиновых нуклеотидов, фолиевой кислоты, аминокислот (глу, три, гис, аспарагин), донор аммиака. Образование аммонийных солей глутамин используется почками в качестве источника аммиака, необходимого для нейтрализации кислых продуктов. Удаление аммиака происходит в виде аммонийных солей с мочой (до 1 г в сутки). Экскреция аммиака с мочой увеличивается при ацидозе. При ацидозе повышается активность глутаминазы и усиливается глюконеогенез. Глутамат после дезаминирования может превращаться в глюкозу путём глюконеогенеза. Восстановительное аминирование 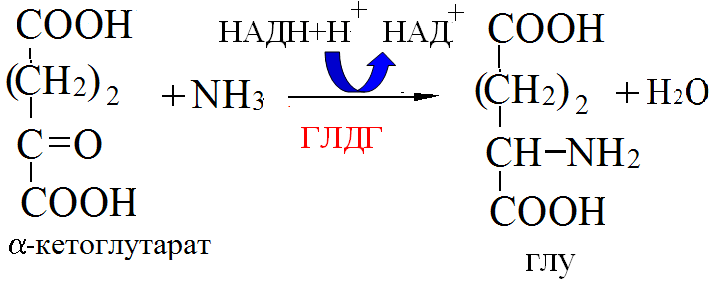 Биосинтез мочевины: из кишечника аммиак с воротной веной идёт в печень, главный путь экскреции азота у человека в составе мочевины, протекает в печени, в синтезе мочевины 5 реакций, 2 из которых протекают в митохондриях. Орнитиновый цикл - основной путь обезвреживания аммиака и главная форма выделения азота из организма взрослых и детей старшего возраста. Бицикл Кребса - связь с ЦТК через митохондрии, СО2, АТФ, общие фрагменты (фумарат), Мочевина. В синтезе мочевины участвует 6 АМК: орнитин, цитруллин, аргинин, аспарагиновая кислота, аргининосукцинат, N-ацетилглутамат – активатор первой реакции. Орнитин регенерирует в каждом обороте цикла мочевины. В мочевине одна аминогруппа поступает в цикл в митохондриях при окислительном дезаминировании глутамата, вторую аминогруппу поставляет аспартат из цитозоля. Цикл мочевины участвует в регуляции рН крови. В орнитиновом цикле расходуется 4 макроэргические связи трёх молекул АТФ на каждый оборот цикла. Процесс сам себя обеспечивает энергией - при регенерации аспартата из фумарата образуется молекула НАДН2, которая даёт 3 АТФ, при окислительном дезаминировании глутамата образуется 3АТФ. Экскреция мочевины. В норме выделяется 25 г мочевины в сутки, мочевина – основной конечный продукт азотистого обмена. Для транспорта азота из тканей в печень используется 3 соединения: глутамин, аланин, аммиак. Аланин как переносчик азота Функции орнитинового цикла: превращение азота аминокислот в мочевину, которая предотвращает накопление аммиака, синтез аргинина. Содержание аммиака в крови определяется ионообменным методом, составляет 25 – 40 мкмоль/л. Гипераммониемия – повышенное содержание аммиака в крови. Рвота, сонливость, раздражительность, нарушение координации, судороги, потеря сознания, отёк мозга. Метаболические нарушения цикла мочевины. Лимитирующие скорость стадии в синтезе мочевины: 1, 2, 3, 5. Гипераммониемия типа I наследственная, при недостатке карбамоилфосфатсинтетазы1. Гипераммониемия типа II наследственная, при недостатке орнитинкарбамоилтрансферазы. УГЛЕВОДНЫЙ ОБМЕН Функции углеводов: Энергетическая функция. 60-70% энергии организм получает за счёт углеводов. Суточная потребность в углеводах 400 – 500 г. Мозг, кровь, почки, надпочечники живут за счёт углеводов. При окислении 1 г углеводов выделяется 4,1 ккал энергии. Резерв энергии – гликоген в мышцах и печени. Структурная функция. Углеводы входят в состав мембран, сухожилий. Защитная функция. Углеводы содержатся в слизи и антителах. Углеводы входят в состав биологически активных веществ: нуклеиновых кислот, коферментов, гормонов, гликолипидов, гликопротеидов. Глюкурониды участвуют в детоксикации. Специфические функции углеводов - входят в состав групповых факторов крови, гепарин, антигены в мембранах, при развитии клеточного иммунитета. Углеводы – связующее звено между солнцем, растениями, животными, человеком. В растениях содержится глюкоза, при распаде которой в организме человека освобождается энергия. Углеводы поступают в организм человека с хлебом, растительной пищей. Основные углеводы пищи: глюкоза, лактоза, сахароза, крахмал, гликоген, клетчатка. Переваривание углеводов. Ферменты, расщепляющие углеводы, относятся к гидролазам, так как осуществляют гидролиз гликозидных связей. Переваривание начинается в ротовой полости. а-Амилаза слюны расщепляет а-1,4-гликозидные связи, не гидролизует связи в дисахаридах. Оптимум рН амилазы – 6,8. Крахмал расщепляется до декстринов и небольшого количества мальтозы. Кислый желудочный сок прекращает действие амилазы, лишь в глубине желудка идёт переваривание углеводов до мальтозы. Переваривание углеводов в кишечнике. В двенадцатиперстной кишке а-амилаза панкреатическая(рН =7,5-8,0) завершает переваривание крахмала и гликогена до мальтозы. В кишечном соке мальтаза, сахараза, лактаза осуществляют гидролиз дисахаридов на поверхности клеток и внутри энтероцитов у взрослых. Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу. Этот комплекс присоединяется к мембране микроворсинок кишечника. Расщепляет а-1,4- и а-1,6- гликозидные связи. Гликоамилазный комплекс (действует как мальтаза) гидролизует а-1,4- гликозидные связи в олигосахаридах. Лактаза кишечного сока гидролизует в-1,4 -гликозидные связи между галактозой и глюкозой в лактозе. Механизм трансмембранного переноса глюкозы. Глюкоза и фруктоза всасываются из кишечника в клетки слизистой оболочки путём облегчённой диффузии с помощью специфических белков – переносчиков. Глюкоза и галактоза переносятся в энтероциты путём активного транспорта, зависимого от градиента концентрации ионов натрия. Из клеток кишечника в кровь глюкоза поступает в кровь с помощью облегчённой диффузии. Из кровотока потребление глюкозы клетками осуществляется путём облегчённой диффузии при участии специальных белков – транспортеров. Исключение составляют клетки мышц и жировой ткани, где облегчённая диффузия регулируется инсулином. Без инсулина мембрана этих клеток непроницаема для глюкозы, так как в ней нет белков-переносчиков для глюкозы. В клетки печени глюкоза проходит при участии белка глют-2, независимо от инсулина. Роль бифидобактерий в переваривании углеводов. Бифидобактерии анаэробные молочнокислые бактерии, населяющие кишечник человека, составляют 95-98% всей микрофлоры кишечника, обнаруживаются уже на 3-5 день после рождения. Бифидобактерии ферментируют углеводы с образованием молочной и уксусной кислот, тем самым способствуя всасыванию углеводов, способствуют синтезу витаминов К и В1, непатогенны для человека. Антагонисты энтеропатогенных и гнилостных бактерий. Бифидумбактерин препарат из живых лиофилизированных бифидобактерий, применяется при дисбактериозе, для своей деятельности нуждается в бифидус факторе, которым богато грудное молоко. Состав бифидус фактора: глюкоза, галактоза, фруктоза, N-ацетилглюкозамин. Мальабсорбция дисахаридов - нарушения всасывания, вызванные расстройствами транспортных механизмов и недостаточностью пищеварительных ферментов. Различают: синдром первичной мальабсорбции (наследственный), синдром вторичной мальабсорбции. Этиология: снижение активности ферментов расщепления углеводов и транспортных переносчиков через кишечную стенку, недостаточное поступление в кишечник ферментов с пищеварительными соками, инактивирование ферментов, морфологические изменения тонкой кишки и нарушение перистальтики. Непереносимость лактозы Первичная непереносимость лактозы. Недостаточность лактазы наследуется по аутосомно-рецессивному типу. Лечение: маленьким детям в молоко добавляют лактазу. Приобретённая непереносимость лактозы наблюдается при энтероколитах, язвенных колитах. Симптомы: метеоризм, диарея при употреблении молока. У взрослых чаще бывает приобретённая непереносимость глюкозы. При непереносимости лактозы наблюдается лактозурия. Фосфорилирование (активация) - первая стадия любых дальнейших превращений моносахаридов Гексокиназная реакция – ключевая реакция углеводного обмена. Гексокиназа обладает высоким сродством к глюкозе, то есть скорость реакции максимальна при низкой концентрации субстрата (Км < 0,1 ммоль/л), ингибируется глюкозо-6-фосфатом. Глюкокиназа имеет Км – 10 ммоль/л, не ингибируется глюкозо-6-фосфатом, есть только в печени. Активность глюкокиназы в 10 раз больше активности гексокиназы. Во время пищеварения в печень поступают большие количества глюкозы, возрастает активность глюкокиназы, что предотвращает чрезмерное повышение уровня глюкозы в периферической крови. Пути превращения глюкозо-6-фосфата в организме Гликоген. В организме человека содержится до 450 г гликогена. Депо гликогена: скелетные мышцы (2/3 общего гликогена), печень (1/3 общего гликогена). Синтез гликогена. Гексокиназная реакция. Под влиянием фермента фосфоглюкомутазы глюкозо-6-фосфат переходит в глюкозо-1-фосфат. 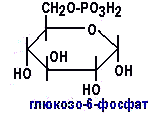 Нарастание цепи гликогена. 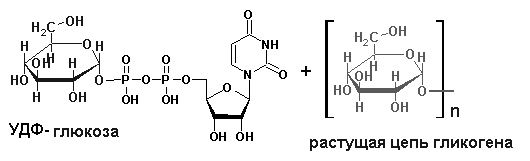 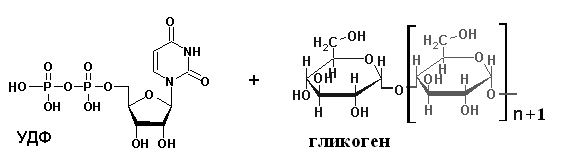 Распад гликогена (гликогенолиз) 3. Ответ. Поражение тканей печени. За счет изофермента ЛДГ 4 и 5 Билет 32.
Энзимология – наука о ферментах. Фермент – биологический катализатор белковой природы. Энзимология появилась на стыке химической, биологической и медицинской наук. Значение ферментов - любые химические превращения веществ в организме происходят при участии ферментов, практическое применение ферментов во всех областях деятельности, где речь идёт о живых существах: хлебопечение, виноделие, сыроварение, чайное, кожевенное, меховое производство. В настоящее время известно 10 000 ферментов, 500 получено в кристаллическом состоянии. Доказательства белковой природы ферментов все выделенные ферменты – белки, методы получение ферментов и белков одинаковы, факторы, вызывающие денатурацию белка, вызывают инактивацию ферментов, при гидролизе ферменты дают аминокислоты, ферменты обладают высокой специфичностью. Ферменты могут быть простыми белками - пепсин, трипсин, уреаза, лизоцим. Ферменты могут быть сложными белками - ЛДГ, трансаминазы. Сложные ферменты помимо белковой части содержат небелковую часть – кофермент. Субстрат – вещество, на которое действует фермент и которое им активируется. Активный центр фермента – несколько аминокислотных остатков, которые в ходе ферментативного катализа взаимодействуют с субстратом. У сложных ферментов в активный центр входят и простетические группы (коферменты). Для формирования активного центра имеют значение третичная и четвертичная структуры фермента, так как в активный центр входят аминокислоты, расположенные далеко друг от друга. Наиболее часто в активный центр входят 3-5 аминокислот. Часто встречаются в активном центре гис, лиз, арг, асп, глу, сер, тир, цис. Для проявления активности фермента необходимо наличие функциональных групп. Инактивация ферментов. Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так как происходит разрыв дисульфидных связей, которые способствуют формированию третичной структуры. Отличия ферментов от неорганических катализаторов - высокая молекулярная активность, лабильность - ферменты действуют при относительно мягких условиях (t, рН, давление), специфичность действия, регуляция ферментов нейрогуморальным путём с участием других ферментов. Структура активного центра фермента комплементарна структуре его субстрата. Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзимати-ческой активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов. Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте каждый из двух симметрично построенных протомеров содержит один активный центр, связывающий субстрат S, и один аллостерический центр, связывающий эффектор М2, т.е. 2 центра в одной молекуле фермента. Получены доказательства, что для субстрата аллостерические ферменты, помимо активного центра, содержат и так называемые эффекторные центры; при связывании с эффекторным центром субстрат не подвергается каталитическому превращению, однако он влияет на каталитическую эффективность активного центра. Подобные взаимодействия между центрами, связывающими лиганды одного типа, принято называть гомотропными взаимодействиями, а взаимодействия между центрами, связывающими лиганды разных типов, – гетеротропными взаимодействиями.
Окислительная фаза апотомического распада глюкозы. Как и в гликолизе первой стадией является фосфорилирование глюкозы с образованием глюкозо-6-фосфата. Далее глюкозо-6-фосфат дегидрируется с участием глюкозо-6-фосфатдегидрогеназы, коферментом которой служит НАДФ. Образующийся 6-фосфоглюконолактон спонтанно или с участием лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты. Заключительным процессом окислительной ветви пентозофосфатного цикла является окисление 6-фосфоглюконовой кислоты соответствующей дегидрогеназой. Одновременно с процессом дегидрирования происходит декарбоксилирование 6-фосфоглюконовой кислоты. С потерей одного углеродного атома глюкоза превращается в пентозу: 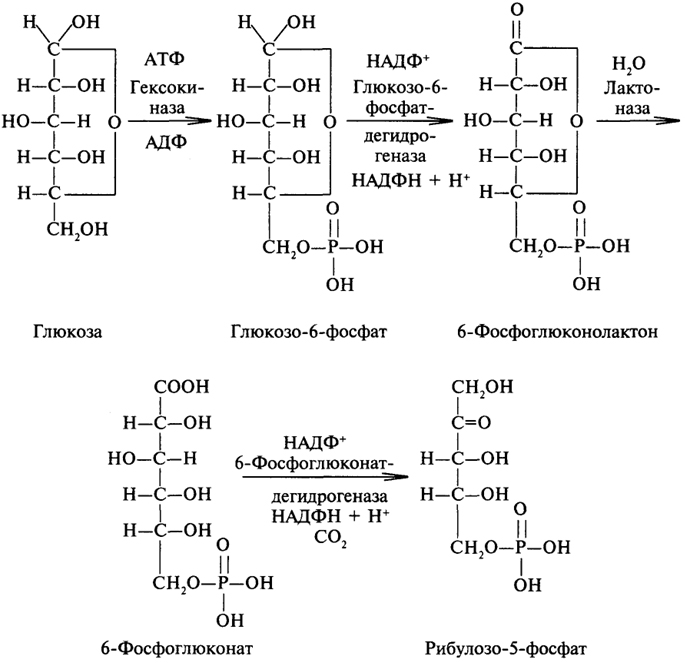 Анаэробная фаза апотомического распада глюкозы.Рибулозо-5-фосфат, образовавшийся в окислительной фазе, может обратимо изомеризоваться в другие пентозофосфаты: ксилулозо-5-фосфат и рибозо-5-фосфат. Катализируют эти реакции два разных фермента, относящиеся к классу изомераз: пентозофосфат изомераза и пентозофосфат эпимераза. Образование из рибулозо-5-фосфата двух других пентозофосфатов необходимо для осуществления последующих реакций пентозофосфатного цикла, причем требуется две молекулы ксилулозо-5-фосфата и одна молекула рибозо-5-фосфата. 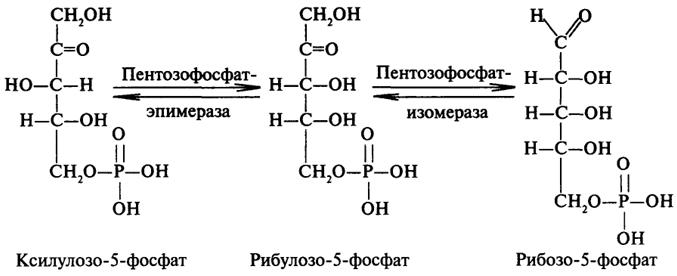 Далее идут реакции с участием ферментов трансфераз, переносящих молекулярные остатки - трансальдолазы и транскетолазы.
Глутаминовая кислота ГАМК Цикл превращений в мозге включает такие сопряженные ферментативные реакции, как декарбоксилирование глутамата с образованием ГАМК под действием глутаматдекарбоксилазы, так и переаминирование ГАМК ГАМК-трансаминазой в глутамат с образованием янтарного полуальдегида. HOOC-CH2-CH2-CH2-NH2 →HOOC-CH2-CH2-CH(O) ГАМК Янтарный полуальдегид. Гамма-аминомасляная кислота является основным ингибиторным трансмиттером (передатчиком) в ЦНС. Она осуществляет нейрональную трансмиссию в 1/3 всех синапсов головного и спинного мозга. ГАМК играет важную роль в регуляции двигательных функций. При этом особенностью нейротрансмиттерной организации супраспинальных двигательных центров (в первую очередь базальных ганглиев и коры мозжечка) является большое количество ГАМК-ергических нейронов, оказывающих тормозное влияние на активность спинальных интер- и мотонейронов через ингибиторные ГАМК-ергические системы, которые, переключаясь в зрительном бугре, церебральной коре и/или двигательных ядрах мезодиэнцефальной области и мозгового ствола, идут в составе руброспинального, вестибулоспинального и ретикулоспинального трактов. В спинном мозге ГАМК выполняет функции ингибиторного трансмиттера как на пресинаптических рецепторах, локализованных на терминалях афферентных проекций, так и на постсинаптических рецепторах мотонейронов и интернейронов. |
