Биохимия ЭКЗАМЕН билеты+ответы. Билет 1 Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
В процессе аэробного распада глюкозы выделяют три этапа:
I этап аэробного распада –гликолиз без последней реакции. Все реакции протекают в цитоплазме. Кислород может присутствовать, а может и отсутствовать (анаэробная фаза). Две реакции идут с затратой энергии (гексокиназная, фосфофруктокиназная). Субстратное фосфорилирование обеспечивает на одну молекулу глюкозы 4 молекулы АТФ. 2 НАДН+Н+ (на 1 молекулу глюкозы) образуются в глицеральдегидфосфатдегидрогеназной реакции, проникают в митохондрии , где дают 3*2=6 АТФ. Большинство реакций обратимы, три реакции необратимые (гексокиназная, фосфофруктокиназная, пируваткиназная). Баланс: приход 6+4= 10АТФ расход 2АТФ. 10-2 = 8АТФ. II этап - окислительное декарбоксилирование ПВК. Реакция катализируется мультиферментным пируватдегидрогеназным комплексом, в котором участвуют 5 коферментов (ФАД, ТПФ, липоевая кислота, НАД , КоАSH) и 3 фермента. Условия протекания реакции - ПВК диффундирует в матрикс митохондрий, реакция протекает в матриксе митохондрий, реакция необратима, требуется кислород, образуются 2 НАДН+Н, которые дают 6АТФ. При избытке углеводов у ребёнка возникает недостаточность тиамина, в крови накапливается ПВК (продукт неполного окисления углеводов). III этап - Цикл Кребса. идёт в митохондриях, требует присутствия кислорода, из 1 молекулы ацетил-КоА – 12АТФ из 2 молекул ацетил-КоА = 2*12 АТФ=24 АТФ. При аэробном распаде глюкозы:
Итого: 38 АТФ на 1 моль глюкозы. 3.Ответ. Появление в моче уробилина свидетельствует о гемолитической или печеночной желтухе. Дополнительные биохимические исследования – содержание прямого и непрямого билирубина, стеркобилина, печеночная проба. Билет 37.
При биосинтезе белков и нуклеиновых кислот матрицей служат нуклеиновые кислоты. Матрица в ходе матричного синтеза не расходуется и может использоваться многократно. Существует три основных типа матричных биосинтезов. Биосинтез ДНК (репликация ДНК) с использованием в качестве матрицы уже существующих молекул ДНК. Биосинтез РНК на матрице ДНК (транскрипция). Биосинтез белков с использованием в качестве матрицы и-РНК (трансляция). Трансляция – синтез белка на матрице РНК. ДНК – код АТГ, и-РНК – кодон УАУ, т –РНК – антикодон АУГ. Этапы трансляции - инициация, элонгация, терминация. Инициация. Инициирующий кодон – АУГ. Рост цепей идёт с N-конца. Синтез начинается с N-формилметионина. Необходимые компоненты: рибосомы, инициирующий кодон, инициаторная аминоацил-тРНК, факторы инициации (IF1, IF2, IF3), ГТФ, ионы магния. Процесс формилирования предотвращает участие аминогруппы АМК в образовании пептидной связи и обеспечивает синтез белка в направлении от аминогруппы к карбоксильной. IF3 первым связывается с малой субъединицей рибосомы. IF3 обеспечивает узнавание участка на м-РНК, куда присоединяется формилметионин-тРНК. IF1 способствует связыванию формилметионин-тРНК с малой субъединицей рибосомы и присоединению к ней м-РНК. IF2 способствует объединению большой и малой субчастиц. Образование инициаторного комплекса осуществляется путём присоединения белковых факторов, формилметионин-тРНК, ГТФ к малой субчастице рибосомы, к которой комплементарно антикодону присоединяется м-РНК, при участии кодона АУГ. После присоединения 50S субчастицы рибосома становится функционально активной. Элонгация трансляции. Необходимо: т-РНК, АМК, ГТФ, ионы магния, рибосомы, факторы элонгации, м-РНК. Формилметионин-тРНК поступает сначала на А-центр, а потом на Р-центр. Участок А получает другую АМК. Для этого необходим ГТФ. Рибосома делает «шаг» по м-РНК на один кодон. Формилметионин переходит на А-участок с Р-участка. На А-участке происходит синтез пептидной связи под влиянием пептидилтрансферазы. Рибосома перемещается на один кодон. Дипептид вновь переносится на Р-участок под влиянием пептидилтранслоказы. На А-участок поступает третья АМК. При перебросе в участок А дипептида образуется трипептид. Главное событие транслокации – перемещение пептидил-тРНК из А в Р-участок рибосомы. Антикодон тянет за собой кодон матрицы, приводя к перемещению матрицы на один триплет относительно рибосомы. Для синтеза одной пептидной связи нужно 4АТФ: 2 АТФ - на активацию АМК и 2 ГТФ - на включение АМК т-РНК в А-центр и транслокацию. Терминация. Необходимы: рибосомы, факторы терминации (3), м-РНК, терминирующие кодоны УАГ, УАА, УГА. От рибосомы отделяется белок, т-РНК, м-РНК. м-РНК распадается до рибонуклеотидов. Синтез митохондриальных белков. 2% клеточной ДНК находится в митохондриях. Белки, синтезируемые в митохондриях, нерастворимы и участвуют в организации структуры митохондрий. Посттрансляционная модификация - формирование третичной и четвертичной структур – фолдинг (участвуют шапероны), ограниченный протеолиз. присоединение коферментов, простетической группы, гликозилирование, метилирование, гидроксилирование, фосфорилирование, образование дисульфидных связей. Ингибиторы белкового синтеза. 50% антибиотиков являются ингибиторами белкового синтеза, 20% - антибиотиков ингибиторы синтеза нуклеиновых кислот. Репликацию нарушают антибиотики, химические яды, вирусы.
Гормоны коры надпочечников. Кора надпочечников – жизненно важный орган. В коре синтезируется свыше 50 кортикостероидов, 7 – 10 из них - гормоны: глюкокортикоиды, минералокортикоиды, половые гормоны. Синтез гормонов. Кортикостероиды синтезируются из холестерина. Холестерин превращается в прегненолон, который является предшественником всех стероидных гормонов. Регуляция синтеза кортикостероидов – кортиколиберин гипоталамуса →АКТГ гипофиза →кортикостероиды→транспортируются в клетку. Рецепторы кортикостероидов в цитоплазме клетки. Гормоны соединяются с белком и транспортируются в ядро. В ядре кортикостероиды связываются с хроматином и действуют на геном, изменяя транскрипцию генов. Гормон→ген→белок. Глюкокортикоиды - кортикостерон, кортизон, гидрокортизон, 11-дезоксикортизол, 11-дегидрокортикостерон. Глюкокортикоиды состоят из 21 углеродного атома и имеют боковую цепь у 17 атома углерода. 75-80 % глюкокортикоидов связаны с транскортином. 10-15 % - с альбумином. Синтез глюкокортикоидов 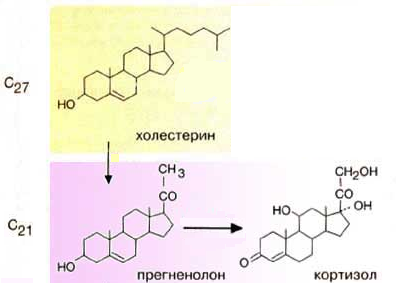 Органы-мишени для глюкокортикоидов - соединительная ткань, мышцы, жировая ткань, лимфоидная ткань, печень, почки. Влияние глюкокортикоидов на белковый обмен. Глюкокортикоиды являются катаболиками в мышечной, лимфоидной, соединительной, жировой тканях. Снижают проницаемость клеток этих тканей для аминокислот и глюкозы, способствуют гипераминоацидурии, повышают выделение общего азота с мочой. В печени глюкокортикоиды – анаболики. Влияние глюкокортикоидов на углеводный обмен: усиливают глюконеогенез из АМК, ингибируют ГК, снижают синтез гликогена в мышцах, активируют гликогенолиз. На жировой обмен: стимулируют липолиз, активируя липазы, повышают содержание жирных кислот в крови. Из-за того, что жирные кислоты не успевают сгорать, развивается кетонемия и стероидный диабет. Глюкокортикоиды: влияют на терморегуляционный центр, снижают синтез АТФ и адениловых нуклеотидов, оказывают противоаллергическое действие (угнетение образования иммуноглобулинов), оказывают противовоспалительное действие: уменьшают проницаемость капилляров, ослабляют фагоцитарную активность лимфоцитов. Глюкокортикоиды действуют: на кровь: снижают число лимфоцитов, снижают число эозинофилов, повышают число нейтрофилов. На соединительную ткань: снижают образование гликозаминогликанов, тормозят рост фибробластов, уменьшают число тучных клеток. Применение. В клинике глюкокортикоиды применяют как десенсибилизаторы, противовоспалительные, иммунодепрессанты. Используют при коллагенозах, бронхиальной астме. Минералокортикоиды - дезоксикортикостерон, альдостерон: 1) Действует на канальцевый аппарат почек: снижает реабсорбцию калия (нарушение сократительной способности мышц), повышает реабсорбцию натрия и хлора из первичной мочи повышается осмотическое давление крови, лимфы, тканевой жидкости повышается обратное всасывание воды в кровь. 2) Усиливает воспаление. Биологическая роль альдостерона. Катаболизм гормонов: 17-кетостероиды – конечные метаболиты гормонов - выводятся с мочой. У мужчин 10-25 мг в сутки. У женщин 5-15 мг в сутки. Выделение увеличивается при: опухоли коры надпочечников и семенников, аддисоновой болезни, микседеме. Гиперкортицизм. Возникает при: опухоли коры надпочечников, поражении гипоталамо- гипофизарной системы (избыток либерина). Проявляется повышенной секрецией всех кортикостероидов, либо одной группы гормонов. Болезнь Иценко - Кушинга возникает при избытке кортизола. При этом заболевании: «буйволовый» тип телосложения, повреждается миокард, снижается иммунитет, стероидный диабет, гипергликемия, гипертония. Синдром Конна возникает при избыточном выделении альдостерона. При этом заболевании: задержка натрия, хлора и воды в организме, теряется калий, отёки, гипертония, слабость, повышается возбудимость миокарда. Гиперплазия коры надпочечников. Гормонально активные опухоли коры надпочечников: кортикостерома, андростерома, кортикоэстрома, альдостерома, смешаннные опухоли. При опухоли, продуцирующей мужские половые гормоны в моче много 17-кетостероидов, появляются усы и борода у женщин. Гипокортицизм, Бронзовая болезнь (болезнь Аддисона). Причины: аутоиммунные поражения клеток коры надпочечников, туберкулёз, сифилис. Клинические проявления: слабость, гипотония, гипогликемия, снижение концентрации натрия и хлора, повышение концентрации калия, пигментация кожи (кортикостерон связан с МСГ), снижается сопротивляемость к стрессам, инфекциям, снижается возбудимость миокарда. Женские половые гормоны. 1) Эстрогены (эстрадиол, эстрон, эстриол). Эстрогены синтезируются в яичниках, жёлтом теле, надпочечниках, семенниках, плаценте. 2) Прогестины (прогестерон). Секреция этих гормонов носит циклический характер: В первой фазе цикла выделяются эстрогены, а во второй – прогестерон (в жёлтом теле). Биологическая роль эстрогенов. Обеспечение репродуктивной функции организма: стимулируют рост яйцеводов и матки, усиливают размножение клеток эндометрия, усиливают сократительную функцию матки, стимулируют разрастание желёз эндометрия, в миометрии стимулируют синтез белка, увеличивают активность ферментов, анаболики, действуют на ЦНС. Биологическая роль прогестерона. Органы - мишени прогестерона: молочные железы, матка. Прогестерон: стимулирует процессы, обеспечивающие наступление беременности и её сохранение до родов, готовит эндометрий матки к имплантации оплодотворённой яйцеклетки, стимулирует разрастание эндометрия, усиливает деятельность маточных желёз, стимулирует развитие железистой ткани молочных желёз, расслабляет маточную мускулатуру, влияет на ЦНС. Биологическая роль женских половых гормонов. Релаксин – гормон плаценты, яичников, эндометрия. Стимулирует размягчение лонного сращения, открытие шейки матки. Плацентарные гормоны. Хорионический гонадотропин – гликопротеин. Стимулирует рост, развитие и секреторную активность жёлтого тела. Эстрогены, прогестерон, релаксин, окситоцин, СТГ, ТТГ, АКТГ, глюкокортикоиды, андрогены (тестостерон, андростерон, дегидроэпиандростерон). Синтезируются в семенниках, клетках яичников, клетках Лейдига, надпочечниках. Синтез регулирует ГТГ гипофиза. Андрогены. Биологическая роль тестостерона - формирование половых признаков (голос, гортань, скелет, мускулатура, волосы и др.), активирует сперматогенез, стимулирует развитие добавочных половых желёз (простаты), влияет на скорость закрытия эпифизарных зон роста, анаболический эффект – усиливает синтез белка в печени, почках, мышцах, влияет на ЦНС, влияет на фиксацию кальция и фосфора в костях, активация ЦТК и окислительных процессов. Уровень тестостерона в крови после рождения повышается, достигает максимума к 1-3 месяцу, затем до 1 года снижается, повышается в пубертатном периоде. Тестостерон применяют при лечении рака молочных желёз. Эстрогены – при раке простаты. Признаки формирования пола обнаруживаются у эмбриона на 7-9 неделе развития. Избыток андрогенов в этот период (гиперплазия коры надпочечников, введение матери с лечебной целью) стимулирует формирование органов у девочки по мужскому типу. 3.Ответ. Эта реакция фосфорилирования, является регуляторной. Регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы. Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ. При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза. 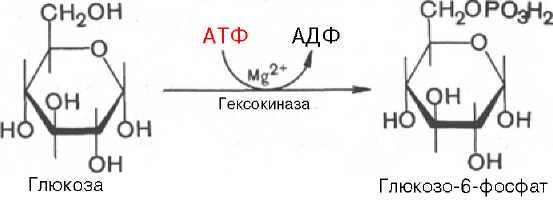 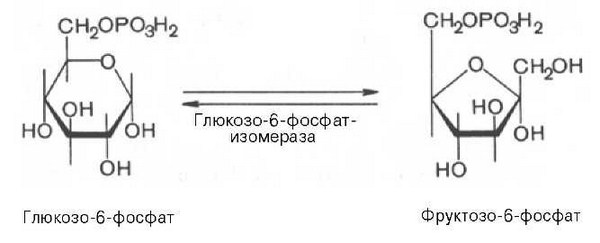 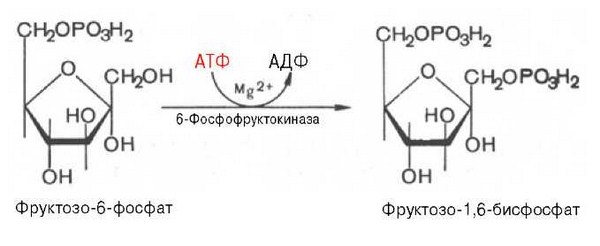 Билет 38.
Каждый фермент действует строго на одно вещество или очень небольшое число близкородственных веществ. Если бы ферменты не обладали специфичностью, их действие приводило бы к распаду клеточного материала. Структура активного центра фермента комплементарна структуре его субстрата. Специфичность действия ферментов. Абсолютная специфичность - Фермент катализирует превращение только одного субстрата. Уреаза, аргиназа. Стереоспецифичность - фермент катализирует превращение одного из стереоизомеров, оксидазы L и D аминокислот. Относительная специфичность - Фермент действует на субстраты разных групп химических соединений. Специфичность по типу реакции. Цитохром Р450. Групповая специфичность - Фермент действует на отдельные связи определённой группы субстратов. Пепсин расщепляет связи, образованные аминогруппой тирозина или фенилаланина. Трипсин гидролизует пептидные связи, в образовании которых принимают участие СООН-группы лиз и арг. Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК. Эластаза гидролизует пептидные связи, в образовании которых участвуют СООН-группы гли, ала. Инактивация ферментов. Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так как происходит разрыв дисульфидных связей, которые способствуют формированию третичной структуры. Аллостерическая регуляция. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостерическим (некаталитическим) центром молекулы фермента, вызывая ингибирование всей цепи синтетической реакции. Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом: Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта Р, накопление которого выше допустимого уровня оказывает мощное ингибирующее действие на первую стадию процесса и соответственно на фермент E1. Типы ингибирования. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата. Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую.
Этапы синтеза тироксина
3. Конденсация йодтирозинов Тиреоглобулин – большой йодированный белок. 70% йодида в этом белке находится в составе неактивных предшественников МИТ и ДИТ. 30% - в виде Т3 и Т4. Тиреоглобулин – форма хранения Т3 и Т4 в коллоиде, обеспечивает поступление этих гормонов в кровь. Синтез тиреоглобулина: контролируется по цепочке: тиролиберин ТТГ синтез тиреоглобулина ограничивается:
4. Тироксин выделяется в кровь после гидролиза тиреоглобулина протеазами лизосом фолликулярных клеток щитовидной железы. Тироксинсвязывающий белок преальбумин и альбумин транспортируют Т4. Концентрация тироксина контролируется ТТГ. При недостатке йода могут образоваться моно- и дииодтиронины. Распад Т3 и Т4 происходит в клетках печени. Механизм действия тироксина. Тироксин легко проходит через клеточную мембрану. Внутри клетки имеет рецепторы в: ядре, митохондриях, цитоплазме. Действие тироксина. Тироксин активирует аденилатциклазу в чувствительных к нему тканях: печень, почки, сердце, жировая ткань, скелетные мышцы. Тироксин действует на все ткани и обмены. Он необходим для нормального роста, развития, дифференцировки тканей. Тироксин вначале стимулирует энергопотребляющую систему (активный мембранный перенос ионов натрия). За этим следует поглощение кислорода тканями, усиление синтеза белка, необходимое для образования митохондрий, а затем наполнение их ферментами. Тироксин – анаболик в малых дозах в детстве. В больших дозах во взрослом организме тироксин – катаболик: стимулирует распад белков, липидов, активирует глюконеогенез. Действие тироксина - увеличивает скорость основного обмена, усиливает поглощение кислорода тканями, обеспечивает теплопродукцию, стимулирует синтез белков, ускоряет синтез многих ферментов, повышает активность ферментов, стимулирует сердечную деятельность, стимулирует проведение нервных импульсов, увеличивает всасывание глюкозы, стимулирует трансляцию и транскрипцию, тормозит синтез жира из глюкозы, стимулирует липолиз. Функция щитовидной железы в норме и патологии. Щитовидная железа развивается на 3 неделе внутриутробного развития. На 12 неделе железа способна синтезировать гормон. У новорожденных отмечена гиперфункция щитовидной железы. К 5 – 10 годам железа функционирует как у взрослых. При недостатке тироксина возникает: кретинизм в детстве, микседема у взрослых. Кретинизм - врождённое нарушение синтеза тироксина. Клинические проявления: остановка роста, изменения кожи, волос, мышц, нарушения психики. Микседема – слизистый отёк. Чаще встречается у женщин. Клинические проявления: нарушение водно-солевого, основного, жирового обменов, патологическое ожирение, выпадение волос и зубов, психические расстройства, вялость, отёчность, снижение интенсивности окислительно-восстановительных процессов. Эндемический зоб обусловлен недостатком йода в питьевой воде, почве и растениях определённых районов земного шара. При заболевании компенсаторно разрастается соединительная ткань. Наблюдается ухудшение интеллектуального, полового, физического развития детей. В регионах тяжёлой зобной эндемии распространён врождённый гипотиреоз, дети с эндемическим неврологическим кретинизмом, глухонемота, резкое снижение интеллекта, спастическая диплегия. В регионах средней степени эндемии – тугоухость, нарушения речи, лёгкие моторные нарушения. Заболевания (состояния), ассоциированные с зобной эндемией - Снижение интеллектуального потенциала населения. Бесплодие, невынашивание беременности, высокая перинатальная и младенческая смертность ® демографические проблемы. Ухудшение состояния здоровья населения: - высокий уровень заболеваемости - высокий уровень хронических заболеваний - акселерация атеросклероза - рост кардиоваскулярных заболеваний - йоддефицитный эндемический зоб - смешанного генеза. Ранняя диагностика врождённого гипотиреоза осуществляется путём определения ТТГ в капиллярной крови новорожденных на 4-5 день жизни. О наличии в регионе йодной недостаточности свидетельствует большая частота показателей ТТГ выше 5 м Ед/л. Степень экологической напряжённости влияет на тиреоидную функцию новорожденных. Явное снижение функции щитовидной железы при гипотиреозе и скрытое при йоддефицитном зобе оказывает неблагоприятное воздействие на состояние репродуктивной системы женщины, снижая адаптационные резервы и обуславливая развитие иммунодефицитных состояний. Тиреотоксикоз обусловлен повышенным содержанием в крови гормонов щитовидной железы. Тироксин разобщает тканевое дыхание и окислительное фосфорилирование, снижается концентрация АТФ, идёт распад белков, жиров, углеводов. Клинические проявления: худоба, тахикардия, экзофтальм, остеопороз, раздражительность, психические расстройства, нарушение сна, потливость, повышение температуры тела, астения, снижение психической активности.
Пути обезвреживания аммиака – синтез мочевины (печень) 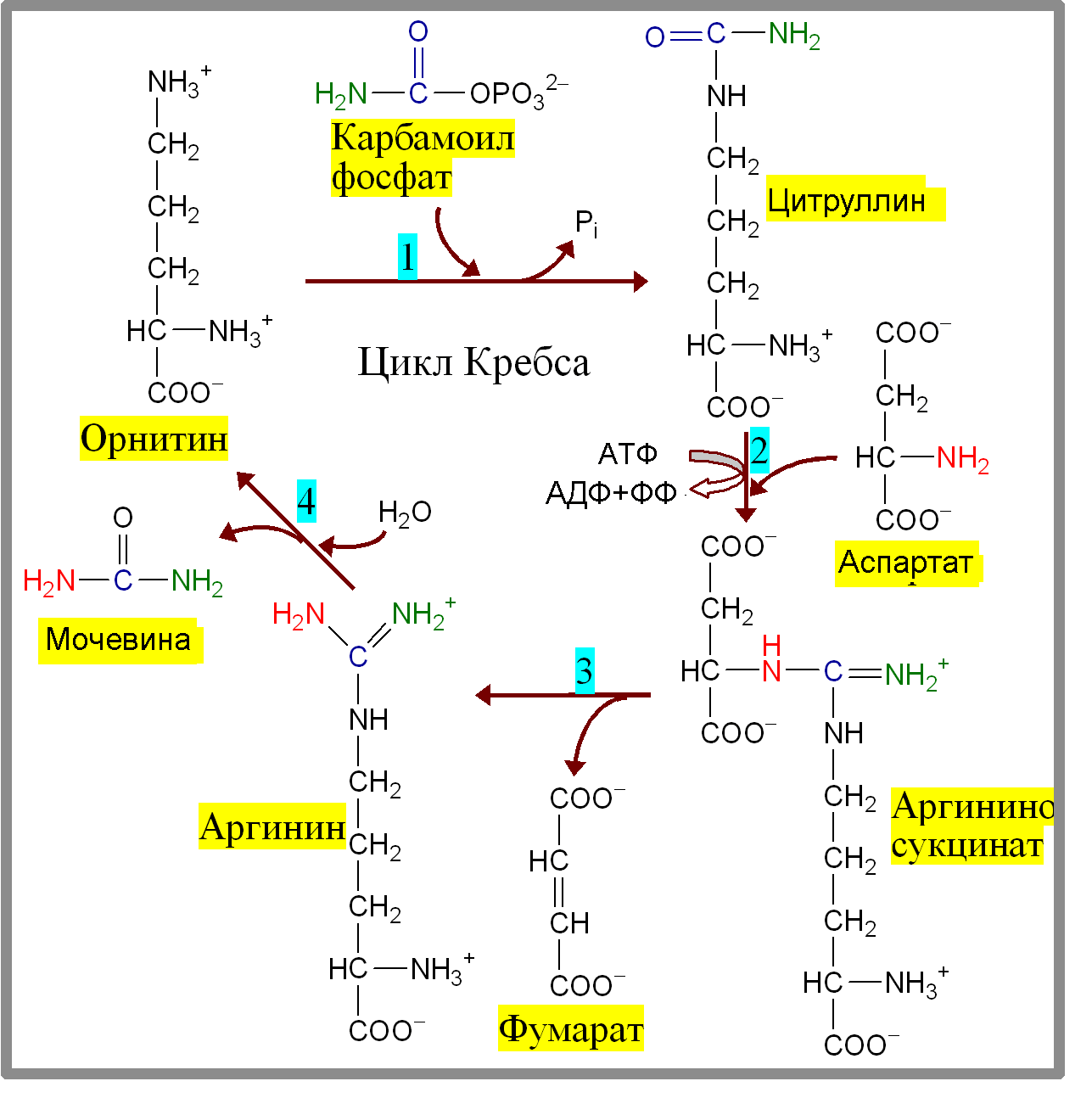 , , образование амидов АМК (кл. мозга) 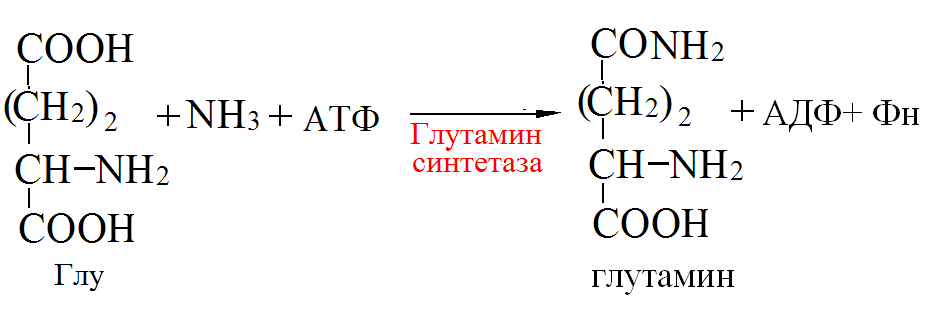 , , восстановительное аминирование (в регенерирующей печени) 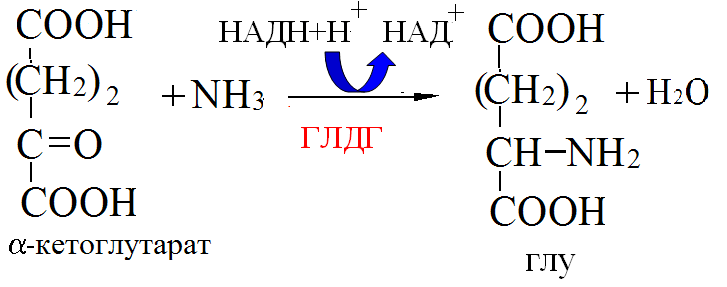 , ,образование аммонийных солей (почки) 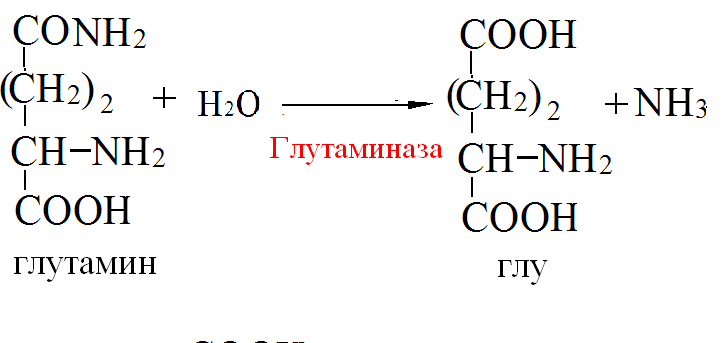 → → |
