Биохимия ЭКЗАМЕН билеты+ответы. Билет 1 Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Билет 1. 1)Мультиферментные комплексы и изоферменты. КДЗ определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты. Мультиферментный комплекс - это комплекс, в котором принимают участие несколько ферментов, при этом продукт предшествующей реакции является субстратом следующей реакции. Пример: - дыхательная цепь; - гликолиз; - пируватдегидрогеназы; - синтетаза жирных кислот. Изоферменты - множественные молекулярные формы данной особи, катализирующие одну и туже реакцию, но отличающиеся друг от друга по физическим и химическим свойствам и разделяющиеся с помощью физико-химических методов. Примером фермента, имеющего изоферменты, является гексокиназа, имеющая четыре изотипа, обозначаемых римскими цифрами от I до IV. При этом гексокиназа IV, экспрессируется почти исключительно в печени и обладает особыми физиологическими свойствами. Ещё одним примером фермента, имеющего изоферменты, является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Третий пример фермента, креатинфосфокиназа — изотип этого фермента, экспрессируемый в сердце, отличается от креатинфосфокиназы скелетных мышц Энзимодиагностика - определение активности фермента. Изоферменты ЛДГ органоспецифичны ЛДГ5 - характерен для ткани, в которой анаэробные процессы. ЛДГ1 - для ткани, в которой аэробные процессы. В инфаркте миокарда кровь из сердца выходит с ЛДГ1, при заболеваниях печени - ЛДГ4 , ЛДГ5, при патологиях лёгких ЛДГ3. АСТ - имеет двойную локализацию (митохондрии и цитоплазма) АЛТ - локализуется только в цитоплазме. Активность АЛТ увеличивается при заболеваниях печени. Активность АСТ увеличивается при инфаркте миокарда. Коэфициент Де Ритиса <1 при патологиях печени – АСТ/АЛТ = 1,75 Активность щелочной фосфатазы увеличивается при рахите, механической желтухе и патологии костной ткани. Активность кислой фосфатазы увеличивается при раке простаты. Активность амилазы увеличивается при патологии слюнных желез и остром панкреатите. Также при остом панкреатите Увеличена активность: амилаза крови и мочи, липаза, фосфолипаза, трипсин, химотрипсин. А при гепатите Увеличена активность: АЛТ, АСТ, ЛДГ4,5, сорбитолдегидрогеназа. Коэффициент де Ритиса <1 Лечение ферментами Заместительная терапия Пепсин - при недостаточной активности пепсина в желудке, при нарушении переваривания белков, синтеза и секреции пепсина Патогенетическая терапия Трипсин, химотрипсин - при лечении гнойных ран (в хирургии и стоматологии), способен расщеплять пептидные связи в белках ДНКаза - используется в лечении вирусных кератитов, гнойных бронхитов Фибринолизин, стрептокиназа - способны растворять нити фибрина (ликвидация тромбов) Липаза, гиалуронидаза -используются для лечения спаечной болезни, рубцов Лизилоксидаза, аспарагиназа - лечение опухолей 2) Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жк с нечетным количеством углеродных атомов и ненасыщенных жк. Окисление жирных кислот (β-окисление) Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды. Этот путь называется β-окисление. Включает 4 этапа - первая стадия дегидрирования, стадия гидратации, вторая стадия дегидрирования, тиолазная реакция. 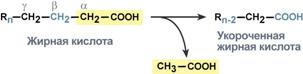 Элементарная схема β-окисления Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Расчет энергетического баланса β-окисления линолиевой кислоты. так как число атомов углерода равно 18, то количество молекул ацетил-S-КоА равно 9. Значит при его окислении в ЦТК образуется 9×12=108 молекул АТФ. исходя из формулы (n/2 - 1) число циклов β-окисления равно 8. При расчете получаем 8×5=40 молекул АТФ. в кислоте имеются 2 двойные связи. Следовательно, в двух циклах β-окисления не образуется 2 молекулы ФАДН2, что равноценно потере 4 молекул АТФ. на активацию жирной кислоты тратятся 2 макроэргические связи. таким образом, энергетический выход 108 + 40 - 4 - 2 =142 молекулы АТФ. Окисление жирных кислот с нечетным числом углеродных атомов Жирные кислоты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой образуется пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и образованию сукцинил-SКоА. В этих реакциях участвуют биотин и витамин В12. 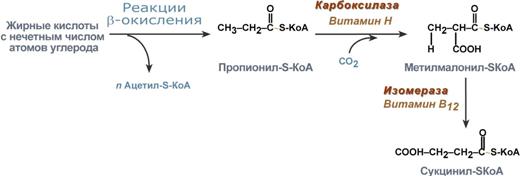 Последние реакции окисления жирных кислот с нечетным числом атомов углерода Окисление ненасыщенных жирных кислот При окислении ненасыщенных жирных кислот возникает потребность клетки в дополнительных ферментах изомеразах. Эти изомеразы перемещают двойные связи в жирнокислотных остатках из γ- в β-положение и переводят природные двойные связи из цис- в транс-положение. Таким образом, уже имеющаяся двойная связь готовится к β-окислению и пропускается первая реакция цикла, в которой участвует ФАД. 3) О каком заболевании следует думать, если моча новорожденного ребенка дает положительную реакцию на наличие фенилпирувата? Какой молекуляр ный блок лежит в основе данной патологии? Олигофрения фенилПВК Билет 2. 1)Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных рекций. 1. Оксидоредуктазы - катализируют окислительно-восстановительные реакции 2. Трансферазы - катализируют реакции межмолекулярного переноса 3. Гидролазы - осуществляет гидролитический разрыв связей с присоединением воды в месте разрыва. Гидролазы - простые белки 4. Лиазы - негидролитический разрыв связей (С-С; C-H; C-S) 5. Изомеразы - катализирует реакции оптической и геометрической изомеризации. 6. Лигазы (синтетазы) - осуществляют синтез сложных органических веществ за счет образования новых связей с использованием АТФ Шифр ферментов: в кадом шифре указывается 4 цифры 1 - класс ферментов 2 - подкласс (указывает какая группировка является донором) 3 - подподкласс (указывает какая группировка является акцептором) 4 - порядковый номер фермента в подподклассе Пример  Характеристика фермента
Лиазы – ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт. 2) Регуляция липидного обмена. Гормоны влияющие на обмен липидов. Патология липидного обмена : гиперлипидемия, атеросклероз, липоидозы, жировое перерождение печени, ожирение. Инсулин - Способствует синтезу липидов -Стимулирует распад глюкозы с образованием ацетил-КоА -Активирует пентозный цикл, в котором синтезируется НАДФН2 -Активирует ацетил-КоА-карбоксилазу и синтетазу жирных кислот, усиливая синтез жирных кислот -Стимулирует синтез триацилглицеринов -Тормозит освобождение жирных кислот в результате активации гликолиза в жировой ткани -Активирует фосфодиэстеразу цАМФ, что способствует снижению липолиза -Ингибирует активность тканевой липазы Простагландины -Снижают мобилизацию жирных кислот из жировой ткани за счет угнетения аденилатциклазы -Снижают влияние катехоламинов на аденилатциклазу Пролактин -Способствует синтезу липидов в жировой ткани в период грудного вскармливания СТГ -Увеличивает мобилизацию жира из жирового депо -Увеличивает скорость β–окисления жирных кислот -Увеличивает синтез аденилатциклазы и липазы Адреналин -Увеличивает мобилизацию липидов за счет активации аденилатциклазы Глюкагон -Активирует синтез ацетоновых тел Тироксин -Увеличивает окисление жирных кислот и липолиз жира Половые гормоны -Тормозят липогенез АКТГ -Способствуют синтезу аденилатциклазы Глюкокортикоиды -Увеличивают мобилизацию жирных кислот, активируя аденилатциклазу -Способствует перераспределению жира по «буйволовому типу» ожирения Дислипидемии (гиперлипидемии) – изменение состава и количества различных липидов в крови I тип Гиперхиломикронемия (экзогенная гиперлипидемия) – увеличение уровня хиломикронов в крови даже натощак (кровь как «борщ со сметаной») Причина – генетическая недостаточность липопротеидлипазы В плазме много триглицеринов и хиломикронов IIa тип Увеличение уровня холестерина в составе ЛПНП В крови – гиперхолестеринемия и гипер-β-липопротеинемия, уровень триглицеринов не изменен Причины – врожденный дефект рецепторов тканей для ЛПНП IIб тип В крови увеличивается содержание ЛПНП (холестерина) и ЛПОНП (триглицеринов) III тип Эта форма гиперлипидемии проявляется увеличением хиломикрон и ЛППП, поэтому называется ещё дис-бета-липопротеинения. Наиболее частая причина — гомозиготность по одной из изоформ апоЕ — E2/E2, которая характеризуется нарушением связывания с ЛПНП-рецептором. Встречаемость в общей популяции — 0,02 %. IV тип Этот подтип гиперлипидемии характерен повышенной концентрацией триглицеридов, поэтому также называется гипертриглицеридемией. Частота встречаемости в общей популяции — 1 %. V тип Этот тип гиперлипидемии во многом похож на I тип, но проявляется не только высокими хиломикронами, но и ЛПОНП. Атеросклероз:
Способствуют развитию атеросклероза: наследственная предрасположенность, гипертония, сахарный диабет, ожирение, стрессы Ожирение:
Липоидозы:
3) У больного наследственный дефект синтеза фермента глюко зо-6-фосфатазы. Будет ли при этом происходить мобилизация гликогена и выход глюкозы в кровь в промежутках между приемами пищи? Каким в итоге будет содержа ние гликогена в печени и глюкозы в крови? Нет не будет Билет 3. 1)Классификация гормонов по локализации рецеторов. Вторичные посредники действия гормонов. В зависимости от локализации рецепторов в клетках–мишенях гормоны можно разделить на три группы . Первую группу составляют гормоны липидной природы. Будучи жирорастворимыми, они легко проникают через клеточную мембрану и взаимодействуют с рецепторами, локализованными внутри клетки,–как правило, в цитоплазме. Вторая группа–белковые и пептидные гормоны. Они состоят из аминокислот и по сравнению с гормонами липидной природы имеют более высокую молекулярную массу и менее липофильны, из–за чего с трудом проходят через плазматическую мембрану. Рецепторы этих гормонов находятся на поверхности клеточной мембраны, так что белковые и пептидные гормоны в клетку не проникают. Третью химическую группу гормонов составляют низкомолекулярные тиреоидные гормоны, образованные двумя аминокислотными остатками, связанными между собой эфирной связью. Эти гормоны легко проникают во все клетки тела и взаимодействуют с рецепторами, локализованными в ядре. Одна и та же клетка может иметь рецепторы всех трех типов, т.е. локализованные в ядре, цитозоле и на поверхности плазматической мембраны. Кроме того, в одной и той же клетке могут присутствовать разные рецепторы одного типа; например, на поверхности клеточной мембраны могут находиться рецепторы разных пептидных и/или белковых гормонов. Вторичные посредники: 1)циклические нуклеотиды (цАМФ и цГМФ); 2)ионы Ca и 3)метаболиты фосфатидилинозитола. Присоединение гормона к рецептору позволяет последнему взаимодействовать с G-белком. Если G-белок активирует систему аденилатциклаза-цАМФ, его называют Gs-белком. Стимуляция аденилатциклазы, связанной с мембраной фермента посредствам Gs-белка, катализирует превращение небольшого количества присутствующего в цитоплазме аденозинтрифосфата в цАМФ внутри клетки. Следующий этап опосредован активацией цАМФ-зависимой протеинкиназой, которая фосфорилирует специфические белки в клетке, запуская биохимические реакции, что гарантированно обеспечивает ответ клетки на действие гормона. Как только цАМФ образуется в клетке, это обеспечивает последовательную активацию ряда ферментов, т.е. каскадную реакцию. Таким образом, первый активированный фермент активирует второй, который активирует третий. Задача такого механизма заключается в том, что небольшое количество молекул, активированных аденилатциклазой, может активировать значительно большее количество молекул на следующем этапе каскадной реакции, что является способом усиления ответа. В итоге благодаря этому механизму ничтожно малое количество гормона, действующее на поверхность мембраны клетки, запускает мощный каскад активирующих реакций. Если гормон взаимодействует с рецептором, сопряженным с тормозящим G-белком (Gi-белок), это снижает образование цАМФ и, как следствие, снижает активность клетки. 2) Гемоглобин, его структура, синтез, виды. Гемоглобинозы. Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей. 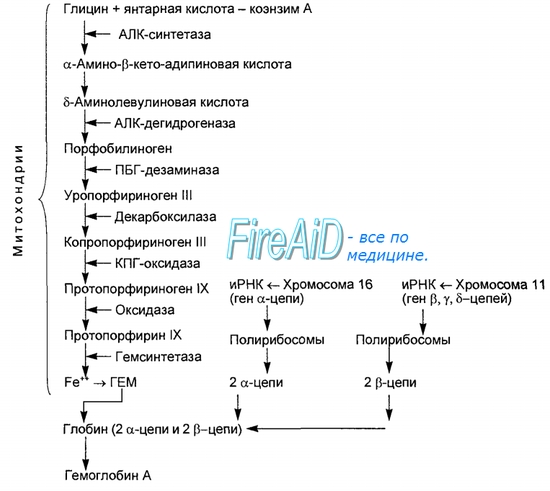 Гемоглобин состоит из белка глобина и железосодержащего гема . Большая часть гемоглобина у взрослых состоит из двух альфа- и двух бета-цепей глобина (по 141 и 146 аминокислот соответственно). В каждую цепь глобина встроена молекула гема; содержащийся в ней атом железа связывает кислород . Переносить кислород может только двухвалентное железо. Каждая молекула гемоглобина содержит две цепи альфа-глобина и две бета-глобина , которые кодируются генами альфа-глобиновых кластеров и генами бета-глобиновых кластеров, находящихся у млекопитающих на различных хромосомах. Эти гены располагаются кластерами: гены, кодирующие альфа-цепи и сходные с ними дзэта-цепи, - на 16-й хромосоме , а гены, кодирующие бета-цепи и сходные с ними гамма-, дельта- и эпсилон-цепи, - на 11-й хромосоме . В норме гемоглобины содержат две цепи из первой группы (альфа или дзэта) и две - из второй (бета, дельта, эпсилон или гамма). -Гемоглобинопатии (гемоглобинозы) — группа наследственных гемолитических анемий, обусловленных нарушениями первичной структуры гемоглобина (качественные гемоглобинопатии) или синтеза глобиновых цепей (количественные гемоглобинопатии). Описано около 500 аномальных гемоглобинов, вызывающих гемоглобинозы. Из качественных гемоглобинозы в клинической практике наиболее часто встречается серповидно-клеточная анемия(В HbS глу в шестом положении с N-конца заменена на валин в β-цепях гемоглобина, эритроциты приобретают форму серпа, возникает стаз крови, гемолиз), из количественных — большая талассемия(генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина), или анемия Кули(гемолитическая анемия, страдает синтез гема и метаболизм железа,снижено количество НbА1,повышено НbА2 и HbF). Профилактика включает ряд мер (медико-генетическое консультирование, пренатальную диагностику), позволяющих значительно снизить число рождающихся больных. 3)У пациента наблюдается быстрая утомляемость, неспособность к выпол нению физической работы. При исследовании клеток мышц, взятых путем биопсии, обнаружили большие включения триглицеридов, концентрация карнитина в 5 раз меньше. Почему при данном заболевании резко снижает ся способность выполнять длительную физическую нагрузку? Напишите фор мульно процесс, участником которого является карнитин. Гипогликемия, нарушено В-окисление Транспорт жирных кислот в митохондрии из цитоплазмы осуществляет карнитин. Билет 4. 1)Белки плазмы крови, место их синтеза, биологическая роль. Изменение белкового спектра сыворотки при различных заболеваниях. Белки острой фазы. Синтез белков: В печени синтезируются альбумины, фибриноген, 80% глобулинов (все α-глобулины и частично β-глобулины). В-лимфоциты синтезируют иммуноглобулины. Макрофаги синтезируют α2-макроглобулины, белки системы комплемента. Эритропоэтин синтезируется клетками почек. Белками плазмы крови являются альбумины, глобулины и фибриноген. Функции белков крови: 1. Регуляция агрегатного состояния крови: свёртывание, фибринолиз, калликреин-кининовая система, система комплемента. 2. Транспортная функция. 3. Защитная функция (антитела). 4. Регуляторная функция. 5. Ферменты. 6. Резерв аминокислот. 7. Поддержание рН крови. 8. Регуляция распределения внеклеточной жидкости. 9. Буферная функция. 10. Поддержание онкотического давления. Альбумины: Связывание воды. Поддерживают онкотическое давление плазмы. Снижение до 3% приводит к отёкам. Транспорт магния, кальция, билирубина, жирных кислот, лизолецитина, прогестерона, лекарств (антибиотики, сердечные гликозиды). Депо белка в организме. Запас пластического материала. Снижаются при заболеваниях печени, нарушениях функции ЖКТ. нефротическом синдроме, Глобулины - грубодисперсные белки, не растворимы в воде,синтезируются в печени и лимфоидной ткани, делятся на 1)_α1-глобулины, врождённом дефиците α1 – АТ наблюдаются: эмфизема лёгких, цирроз печени,желтуха, холестаз. Активность α1 – АТ возрастает при воспалениях, механических повреждениях тканей, панкреатите. Α1-атрипсины, активность возрастает при острых и хронических воспалениях, опухоли, активность уменьшается при циррозе печени 2) α2-глобулины, α2 –макроглобулин повышается при: циррозе печени, нефротическом синдроме, микседеме,сахарном диабете, α2 –макроглобулин не меняется при остром воспалении. α2 –макроглобулин снижается при: парапротеинозах, ревматическом полиартрите, остром панкреатите. Уровень церулоплазмина повышается при: беременности, остром воспалении, холестазе, ревматоидном артрите, неоплазме. Уровень церулоплазмина снижается при: циррозе печени, хроническом гепатите, болезни Вильсона-Коновалова 3)β-глобулины, трансферрин уровень снижается при воспалении, нефротоксическом синдроме, заболеваниях печени или опухолях. СРБ при концентрации 10-20 мг/л бактериальной инфекции нет, 20-100 локальная инфекция, более 100 септицемия γ-глобулины Белки острой фазы: Понятие «белки острой фазы» объединяет до 30 белков плазмы крови, участвующих в совокупности реакций воспалительного ответа организма на повреждение. Белки острой фазы – маркеры повреждения и воспаления. Их концентрация повышается при 1.воспалении, 2.беременности, 3.онкологических заболеваниях. Концентрация существенно изменяется и зависит от стадии, течения заболевания, массивности повреждения. Концентрация увеличивается в течение первых 24-48 часов. К белкам острой фазы относятся: α1 – гликопротеин,α1 – АТ, церулоплазмин, гаптоглобин, СРП, гемопексин, фибриноген. 2) Глюкоза крови. Пути ее поступления и использования. Гексокиназная реакция – клучевая реакция углеводного обмена. Пусти превращения глюкозо-6-фосфата. В крови человека постоянно находится ряд углеводов, регулирующих жизнедеятельность организма, из которых важнейшим является глюкоза. Именно глюкоза составляет основу субстрата, необходимого для энергообеспечения и жизнедеятельности клетки. Наряду с другими питательными веществами глюкоза поступает в кровь при всасывании в кишечнике после расщепления углеводов, содержащихся в продуктах питания, а также может образовываться из гликогена, находящегося в "депо" организма. Гексокиназная реакция. Первая реакция гликолиза - превращение глюкозы в глюкозо-6-фосфат - требует АТФ и катализируется тканеспецифическими изоферментами, которые называются гексокиназами. Гексокиназа ингибируется продуктом реакции — глюкозо-6-фосфатом, который аллостерически связывается с ферментом, изменяя его активность. По причине того, что основная масса Г-6-Ф в клетке производится путём расщепления гликогена, гексокиназная реакция, по сути, для протекания гликолиза не является необходимой, и фосфорилирования глюкозы в регуляции гликолиза исключительной важности не имеет. Гексокиназная реакция является важным этапом регуляции концентрации глюкозы в крови и в клетке. 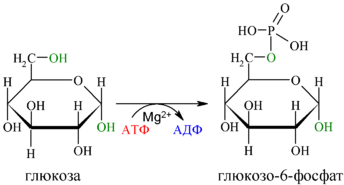 Пути превращения гл-6-фосфата: 1)Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) - окислительной и неокислительной. В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH. В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах. 2) Гликолиз. Глюкозо-6-фосфат превращается в фруктозо-6-фосфат (фермент – глюкозо-6-6фосфат изомераза) . 3) Гиперпаратиреоидизм - заболевание, в основе которого лежит гиперп родукция паратгормона. У больных отмечается мышечная слабость, остео пороз, деформация костей, образование почечных камней. Как меняется концентрация кальция в крови у таких больных? За счет стимуляции каких процессов это происходит? Известно, что экскреция фосфатов находится под контролем околощитовидных желез. Паратиреоидный гормон (паратгормон) играет двоякую роль в кальциевом обмене. С одной стороны, он усиливает выделение фосфора и уменьшает его реабсорбцию в канальцах, с другой - усиливает выделение солей кальция из костной ткани. Экскреция фосфатов увеличивается пропорционально повышению уровня паратгормона в крови. Потеря фосфатов приводит к мобилизации из костей соединений фосфора. Поскольку последние являются одновременно солями кальция, происходит освобождение кальция и повышение его концентрации в крови и моче. Появляется фосфатурия. Билет 5. 1)Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс-потенциалы ферментных систем. Ингибиторы переноса электронов. Дыхательная цепь – основной поставщик энергии для синтеза макроэргических связей молекул АТФ в процессе окислительного фосфорилирования. 1 комплекс. НАДН-КоQ-оксидоредуктаза Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа. Функция: Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 2 комплекс. ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию). Функция Восстановление ФАД в окислительно-восстановительных реакциях. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q. 3 комплекс. КоQ-цитохром с-оксидоредуктаза Данный комплекс включает цитохромы b и c1. Кроме цитохромов в нем имеются 2 железо-серных белка. Всего насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кDа. Функция Принимает электроны от коэнзима Q и передает их на цитохром с. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 4 комплекс. Цитохром с-кислород-оксидоредуктаза В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди. Функция Принимает электроны от цитохрома с и передает их на кислород с образованием воды. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 5 комплекс Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы: -одна группа формирует субъединицу Fо (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. -другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ. Редокс потенциал: Указывает направление переноса электрона. При сравнении редокс-потенциала системы с нормальным водородным электродом, потенциал которого равен нулю, получают величины, отражающие окислительно-восстановительные способности вещества. Ингибиторы дыхания: Инсектицид ротенон блокирует НАДН-ДГ. Барбитураты блокируют переход от ФП к убихинону. Антимицин А блокирует стадию: цитохром В цитохром С. Цианиды, угарный газ – ингибиторы цитохромоксидазы. Синильная кислота реагирует с Fe, угарный газ с Fe. 2) Адреналин и норадреналин, их синтез и влияние на обмен веществ. Синтез Осуществляется в клетках мозгового слоя надпочечников (80% всего адреналина), синтез норадреналина (80%) происходит также в нервных синапсах. 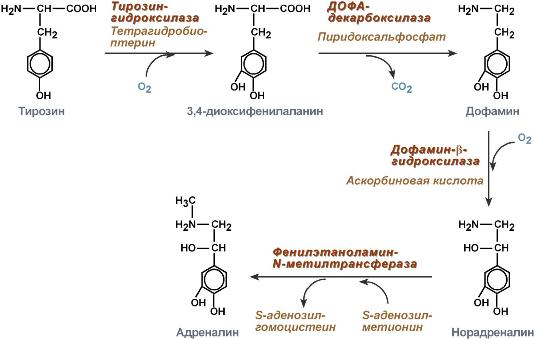 Регуляция синтеза и секреции Активируют: стимуляция чревного нерва, стресс. Уменьшают: гормоны щитовидной железы. Механизм действия Механизм действия гормонов разный в зависимости от рецептора. Конечный эффект гормонов зависит от преобладания типа рецепторов на клетке и концентрации гормона в крови. Например, в жировой ткани при низких концентрациях адреналина более активны α2-адренорецепторы, при повышенных концентрациях (стресс) – стимулируются β1-, β2-, β3-адренорецепторы. -Аденилатциклазный механизм при задействовании α2-адренорецепторов аденилатциклаза ингибируется, при задействовании β1- и β2-адренорецепторов аденилатциклаза активируется. -Кальций-фосфолипидный механизм при возбуждении α1-адренорецепторов. Мишени и эффекты ---При возбуждении α1-адренорецепторов (печень, сердечно-сосудистая и мочеполовая системы): активация гликогенолиза, сокращение гладких мышц кровеносных сосудов и мочеполовой системы. ---При возбуждении α2-адренорецепторов (жировая ткань, поджелудочная железа, почки): подавление липолиза (уменьшение стимуляции ТАГ-липазы), подавление секреции инсулина и секреции ренина. ---При возбуждении β1-адренорецепторов (есть во всех тканях): активация липолиза, увеличение силы и частоты сокращений миокарда. ---При возбуждении β2-адренорецепторов (есть во всех тканях): стимуляция гликогенолиза в печени и мышцах, и глюконеогенеза в печени, расслабление гладких мышц бронхов, кровеносных сосудов, мочеполовой системы и желудочно-кишечного тракта. В целом катехоламины отвечают за биохимические реакции адаптации к острым стрессам, связанным с мышечной активностью – "борьба или бегство": усиление липолиза и продукция жирных кислот в жировой ткани для мышечной активности, гипергликемия за счет глюконеогенеза и гликогенолиза в печени для повышения устойчивости ЦНС, стимуляция гликогенолиза в мышцах, активация протеолиза в лимфоидной ткани для обеспечения глюконеогенеза субстратом (аминокислотами), снижение анаболических процессов через уменьшение секреции инсулина. Адаптация также прослеживается в физиологических реакциях: мозг – усиление кровотока и стимуляция обмена глюкозы, мышцы – усиление сократимости, сердечно-сосудистая система – увеличение силы и частоты сокращений миокарда, легкие – расширение бронхов, улучшение вентиляции и потребления кислорода, кожа – снижение кровотока. Патология Гиперфункция - Опухоль мозгового вещества надпочечников феохромоцитома. Ее диагностируют только после проявления гипертензии и лечат удалением опухоли. 3) Оценить состояние больного по следующим данным анализа крови и мо чи: общий билирубин - 80 мкмоль/л (повышение как прямого, так и неп рямого билирубина), общий белок снижен, белковые фракции: альбумины - снижены, альфа- и гамма-глобулины - повышены, активность АЛТ - повыше на, коэффициент де Ритиса меньше 1,0. Паренхиматозная желтуха. Билет 6. 1)Особенности обмена в эритроцитах. Эритроцитарные энзимопатии. Синтез гема. Порфирин. Эритроцитарные энзмопатии характеризуются: Недостаточностью Г-6-ФДГ в эритроцитах
Биосинтез гемма первая стадия: Вторая стадия: Далее через ряд реакций из 4х молекул порфобилиногена синтезируется гемм Порфирии: Первичные порфирии - врождённые расстройства синтеза гема, обусловленные недостаточностью фермента, участвующего в его образовании. Болезнь Гюнтера – врождённая порфирия: блок синтеза гема. С мочой выделяются уро- и копропорфирины. Клинические проявления: красная моча, розовые зубы, фотодерматоз, гемолитическая анемия, спленомегалия. Острая порфирия – блок превращения порфобилиногена в полипирролы. С мочой выделяются порфобилиноген и аминолевулинат. Клинические проявления: острые приступы с абдоминальными и неврологическими симптомами. Вторичные порфиринурии возникают при циррозе печени, болезнях крови, аллергиях. 2) Процессы переваривания белков в кишечнике. Протеолитические ферменты панкреатического и кишечного соков. Гниение аминокислот в икшечнике и обезвреживание продуктов. Переваривание белка начинается в с желудочного сока где пепсин гидролизует пептидные связи с участием NH2 группы ароматичской АМК, а соляная кислота вызывает денатурацию и набухание белка. Ферменты панкреатического сока: трипсин, химотрипсин, эластаза, карбоксипептидаза. Трипсин гидролизует пептидные связи, в образовании которых принимают участие СООН-группы Лиз и Арг. Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК. Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина. Ферменты кишечного сока: аминопептидазы, дипептидазы, энтерокиназа. Эластаза Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина. Аминопептидазы Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин. Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов. 5% белка не переваривается, а идёт в толстый кишечник, где микрофлорой расщепляется до АМК. Гниение белков – распад АМК, в толстой кишке под действием ферментов бактерий. Диамины обезвреживаются в организме под действием фермента диаминооксидаза, кофермент – ФП. Моноамины обезвреживаются ферментом МАО (моноаминооксидаза), кофермент – ФАД. При гниении образуются токсичные для организма продукты: аммиак, сероводород, фенол, крезол, индол, скатол, различные диамины, моноамины, бензойная кислота. Процессы гниения усиливаются при дефиците протеолитических ферментов поджелудочной железы. Возникает аутоинтоксикация. Обезвреживание путем парного синтеза в печени: 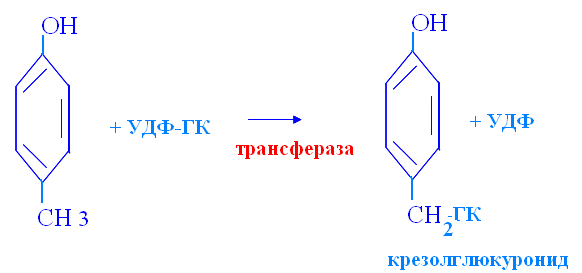 Индол получает ОН группу 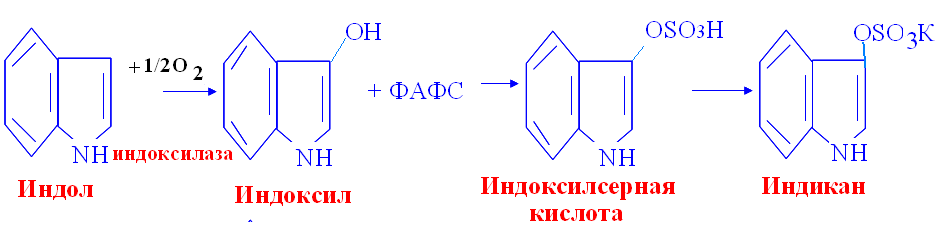 Бензойная кислота обзвреживается глицерином: 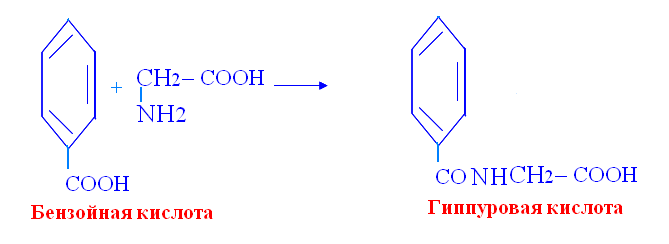 3) Оцените состояние больного по следующим данным анализа крови и мочи: глюкоза крови – 10,0 ммоль/л, рН крови – 7,30, в моче обнаружены глюкоза, кетоновые тела. СД и как следствие метаболический ацидоз Билет 7 1)Эндокринная система оргранизма. Классификация гормонов по химической структуре, их роль в регуляции обменных процессов. Причины эндокринных заболеваний. Механизм действия гормонов. Амины Дофамин - ЦНС Норадреналин - ЦНС, мозговой слой надпочечников Адреналин - Мозговой слой надпочечников Мелатонин - Эпифиз Иодтиронины Тироксин (Т4) - Щитовидная железа Трииодтиронин (Т3) - Периферические ткани (щитовидная железа) Небольшие пептиды Вазопрессин (антидиуретический гормон, АДГ) - Задняя доля гипофиза Окситоцин - Задняя доля гипофиза Меланоцитстимулирующий гормон (МСГ) - Промежуточная доля гипофиза Соматостатин (СРИФ) - Гипоталамус, ЦНС, панкреатические островки Соматокринин (СТГ-РГ, СТГ-РФ) - Островковые опухоли, гипоталамус, ЦНС Ангиотензины (А II, А III) - Кровь (из предшественника), ЦНС Белки Инсулин - бета-клетки, панкреатические островки Глюкагон - альфа-клетки, панкреатические островки Гормон роста, или соматотропин (ГР, СТГ) - Передняя доля гипофиза Пролактин (ПРЛ) - Передняя доля гипофиза Паратгормон (ПТГ) - Паращитовидные железы Энкефалин - Гипофиз, ЦНС Кальцитонин - К-клетки, щитовидная железа АКТГ - Передняя доля гипофиза Секретин - Желудочно-кишечный тракт, ЦНС Холецистокинин (ХЦК) - Желудочно-кишечный тракт, ЦНС Гастрин - Желудочно-кишечный тракт, ЦНС Гликопротеины Фолликулостимулирующий гормон (ФСГ) - Передняя доля гипофиза Лютеинизирующий гормон (ЛГ) - Передняя доля гипофиза Тиреотропный гормон (ТТГ) - Передняя доля гипофиза Стероиды Эстрогены - Яичники, плацента Прогестерон - Желтое тело, плацента Тестостерон - Семенники Глюкокортикоиды - Кора надпочечников Альдостерон - Кора надпочечников |
