Патфиз ч.3. Патфиз ч. Частнаяпатология
 Скачать 13.12 Mb. Скачать 13.12 Mb.
|
Сердечнососудистая система (ССС) — компонент системы крово и лимфообращения. В неё, помимо сердца и сосудов (т.е. ССС), входят также кровь и лимфа. Система крово и лимфообращения — одна из интегрирующих систем организма. В ней выделяют центральное и периферическое звенья. Центральное кровообращение осуществляется на уровне сердца, а также крупных сосудов и обеспечивает поддержание системного давления крови, направление движения крови из артериального русла в венозное и далее — к сердцу, демпфирование значительных (систолических и диастолических) колебаний АД при выбросе крови из желудочков сердца. Периферическое кровообращение (органнотканевое, местное, регионарное) осуществляется в сосудах отдельных органов и тканей и обеспечивает ток крови в них в соответствии с их постоянно меняющейся функциональной активностью и уровнем пластических процессов. Периферическое кровообращение включает также и кровообращение в сосудах микроциркуляторного русла. Оно реализуется в артериолах, прекапиллярах, капиллярах, посткапиллярах, венулах и артериоловенулярных шунтах органов и тканей. В целом это звено системы кровообращения осуществляет доставку крови к тканям, транскапиллярный обмен метаболитами, O2 и CO2, а также транспорт крови от тканей. В норме ССС оптимально обеспечивает текущие потребности органов и тканей в кровоснабжении, а уровень системного кровообращения определяется деятельностью сердца, тонусом сосудов и состоянием крови (величиной её общей и циркулирующей массы, а также реологическими свойствами). Нарушения функции сердца, сосудистого тонуса или изменения в системе крови могут привести к недостаточности кровообращения. НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ Недостаточность кровообращения — состояние, при котором система кровообращения не обеспечивает потребности тканей и органов в оптимальном кровоснабжении. ПРИЧИНЫ Основные причины недостаточности кровообращения: • расстройства сердечной деятельности, • нарушения тонуса стенок кровеносных сосудов, • изменения ОЦК и/или реологических свойств крови. ВИДЫ Виды недостаточности кровообращения классифицируют по критериям: •компенсированности расстройств, •остроте их развития и течения, • выраженности признаков. КОМПЕНСИРОВАННОСТЬ РАССТРОЙСТВ По компенсированности расстройства системы кровообращения подразделяют на компенсированные (признаки расстройств кровообращения выявляются при нагрузке) и некомпенсированные (признаки нарушения кровообращения обнаруживаются в покое). ОСТРОТА РАЗВИТИЯ И ТЕЧЕНИЯ По остроте развития и течения выделяют острую (развивается в течение часов и суток) и хроническую (развивается на протяжении нескольких месяцев или лет) недостаточность кровообращения. • Острая недостаточность кровообращения. Наиболее частые причины: инфаркт миокарда, острая сердечная недостаточность, некоторые аритмии (пароксизмальная тахикардия, выраженная брадикардия, мерцательная аритмия и др.), шок, острая кровопотеря. • Хроническая недостаточность кровообращения. Причины: перикардиты, длительно текущие миокардиты, миокардиодистрофии, кардиосклероз, пороки сердца, гипер и гипотензивные состояния, анемии, гиперволемии различного генеза. ВЫРАЖЕННОСТЬ ПРИЗНАКОВ По выраженности признаков выделено три стадии недостаточности кровообращения. • Стадия I — начальная — недостаточность кровообращения первой степени. Признаки: уменьшение скорости сокращения миокарда и cнижение фракции выброса, одышка, сердцебиение, утомляемость. Указанные признаки выявляются при физической нагрузке и отсутствуют в покое. • Стадия II — недостаточность кровообращения второй степени (умеренно или значительно выраженная недостаточность кровообращения). Указанные для начальной стадии признаки недостаточности кровообращения обнаруживаются не только при физической нагрузке, но и в покое. • Стадия III — конечная — недостаточность кровообращения третьей степени. Характеризуется значительными нарушениями сердечной деятельности и гемодинамики в покое, а также развитием существенных дистрофических и структурных изменений в органах и тканях. ФАКТОРЫ РИСКА Сердечнососудистые заболевания занимают первое место среди причин инвалидизации и гибели человека (убийца № 1). Высокий уровень заболеваемости, инвалидизации и летальности от болезней ССС в значительной мере определяется широкой распространённостью различных форм патологии сердца и прежде всего — ИБС. В промышленно развитых странах 15–20% взрослого населения страдает ИБС. Последняя, в свою очередь, является причиной внезапной смерти у 2/3 пациентов, умерших от сердечнососудистых заболеваний. Около половины страдающих этими болезнями становятся инвалидами в трудоспособном возрасте. Постоянно увеличивается заболеваемость и смертность от них среди молодого населения (до 35 лет), а также в сельских местностях. Основные факторы, определяющие высокую заболеваемость сердечнососудистой патологией: повторные и затяжные стрессорные эпизоды, хроническая гиподинамия, интоксикация алкоголем, курение, избыток чая, кофе и других «бытовых допингов», некачественное, несбалансированное питание и переедание, ожирение. Всего известно не менее 50 факторов риска, существенно влияющих на возникновение кардиоваскулярной патологии. ТИПОВЫЕ ФОРМЫ ПАТОЛОГИИ ССС Патологические процессы ССС объединяют в две группы типовых форм патологии. • Нарушения центрального кровообращения. Они обусловлены патологией сердечной деятельности и магистральны кровообращения х сосудов. • Расстройства периферического, включая нарушения микроциркуляции. Большинство расстройств сердечной деятельности относятся к трем группам типовых форм патологии: коронарной недостаточности, аритмиям и сердечной недостаточности. КОРОНАРНАЯ НЕДОСТАТОЧНОСТЬ Коронарная недостаточность — типовая форма патологии сердца, характеризующаяся превышением потребности миокарда в кислороде и субстратах метаболизма над их притоком по коронарным артериям, а также нарушением оттока от миокарда продуктов обмена веществ, БАВ, ионов и других агентов. Ведущий патогенетический фактор коронарной недостаточности — ишемия миокарда. Клинически коронарная недостаточность проявляется как ишемическая болезнь сердца (ИБС). При поражении венечных артерий может развиться стенокардия, инфаркт миокарда или внезапная сердечная смерть. ВИДЫ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ Все разновидности коронарной недостаточности подразделяют на обратимые и необратимые (рис. 22–1). 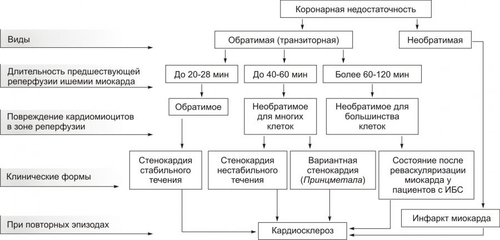 Рис. 22–1. Виды, клинические формы и исходы коронарной недостаточности. ОБРАТИМЫЕ НАРУШЕНИЯ КОРОНАРНОГО КРОВОТОКА Обратимые (транзиторные) нарушения коронарного кровотока клинически проявляются различными формами стенокардии и состояниями после реперфузии (реваскуляризации) миокарда. • Стенокардия Стенокардия — типовая форма коронарной недостаточности, характеризующаяся в типичных случаях сильной сжимающей болью в области грудины слева вследствие ишемии миокарда. Боль часто иррадиирует в область левой лопатки и левого плеча. Различают несколько разновидностей стенокардии. † Стенокардия стабильного (типичного) течения. Наиболее часто встречающаяся разновидность стенокардии. Обычно является следствием снижения коронарного кровотока до критического уровня. Эпизоды стенокардии развиваются в результате увеличения работы сердца. † Стенокардия нестабильного течения (нарастающая, нестабильная). Характеризуется нарастающими по частоте, длительности и тяжести эпизодами стенокардии, нередко даже в покое. Эти эпизоды являются обычно результатом разрушения атеросклеротической бляшки и развития тромба на месте дефекта, эмболии коронарной артерии, спазма ветви венечной артерии сердца. Нередко эти эпизоды пролонгированы во времени и завершаются инфарктом миокарда. В связи с этим такие эпизоды называют прединфарктными состояниями. † Вариантная стенокардия (стенокардия Принцметала). Является результатом длительного спазма коронарных артерий. Существенно, что повторные (даже кратковременные — до 3–8 мин) эпизоды стенокардии могут привести к формированию небольших участков некроза миокарда с последующим развитием мелкоочагового кардиосклероза. Клиническая классификация стенокардии приведена в статье «Болезнь. Ишемическая болезнь сердца». • Состояния после реперфузии (реваскуляризации) миокарда, развивающиеся у пациентов с ИБС в результате хирургического возобновления или значительного увеличения коронарного кровотока (например, после аортокоронарного шунтирования и чрескожной внутрисосудистой ангиопластики) и медикаментозного восстановления тока крови в коронарных артериях (например, вследствие тромболизиса, дезагрегации форменных элементов крови с помощью тромбо и фибринолитиков или дезагрегантов). НЕОБРАТИМЫЕ НАРУШЕНИЯ КОРОНАРНОГО КРОВОТОКА Необратимое прекращение или длительное значительное уменьшение притока крови по коронарной артерии в какомлибо регионе сердца завершается, как правило, инфарктом миокарда. Инфаркт миокарда — типовая форма коронарной недостаточности — очаговый некроз сердечной мышцы в результате остро возникшего и выраженного дисбаланса между потребностью миокарда в кислороде и его доставкой. • Наиболее частая причина инфаркта миокарда — тромбоз венечной артерии, развившийся на фоне атеросклеротических изменений (до 90% всех случаев). • Клиническим диагностическим критерием инфаркта миокарда является сильный болевой синдром («кинжальная боль» за грудиной) продолжительностью более 15 мин, не купирующийся нитроглицерином. • ЭКГ † При развитии инфаркта миокарда возникают изменения сегмента ST и зубца Т — депрессия или подъём сегмента ST и инверсия зубца Т. Подъём сегмента ST — характерный признак инфаркта миокарда, свидетельствующий о повреждении миокарда. † Через 8–12 ч от начала боли на ЭКГ возникает важный признак инфаркта миокарда — патологический зубец Q (характеризующий наличие некроза миокарда). • При инфаркте миокарда возможны следующие опасные для жизни осложнения. † Острая сердечная недостаточность, кардиогенный шок, отёк лёгких, постинфарктный синдром. † Разрыв свободной стенки левого желудочка или межжелудочковой перегородки, аневризма левого желудочка. † Недостаточность митрального клапана. † Нарушения ритма и проводимости (синусовая брадикардия, АВ-блокада, желудочковые нарушения ритма сердца, наджелудочковые нарушения ритма сердца (в том числе фибрилляция предсердий). † Тромбоэмболия. Клинически тромбоэмболия артерий может проявляться гемипарезами (эмболия артерий мозга), стойкой артериальной гипертензией и гематурией (почечные артерии), болями в животе (брыжеечные артерии), болями в ногах (бедренные артерии) и тромбоэмболией лёгочной артерии. Если инфаркт не приводит к смерти пациента, то погибший участок сердца замещается соединительной ткань — развивается крупноочаговый кардиосклероз. ПРИЧИНЫ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ Многочисленные состояния и факторы, способные вызвать коронарную недостаточность, объединяют в три основные, как правило, взаимосвязанные и взаимозависимые группы (рис. 22–2). 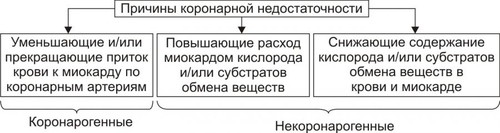 Рис. 22–2. Группы причин коронарной недостаточности. АБСОЛЮТНОЕ СНИЖЕНИЕ ПРИТОКА КРОВИ К МИОКАРДУ Факторы, приводящие к абсолютному снижению притока крови к миокарду по коронарным артериям (в клинике они встречаются наиболее часто), представлены на рис. 22–3. 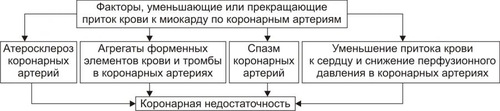 Рис. 22–3. Факторы, уменьшающие или прекращающие приток крови к миокарду по коронарным артериям. • Атеросклеротическое поражение коронарных артерий. У 92% пациентов со стенокардией на коронароангиограммах выявляются значительные локальные сужения просвета как минимум одной из венечных артерий сердца. • Агрегация форменных элементов крови (главным образом — эритроцитов и тромбоцитов) и образование тромбов в венечных артериях сердца. Этим процессам в значительной мере способствуют: † атеросклеротические изменения в стенках сосудов; † турбулентный характер кровотока в венечных сосудах; † повышение содержания и активности факторов свёртывающей системы крови, высвобождающихся из повреждённых клеток крови и сосудистой стенки. Указанные факторы дополнительно стимулируют агрегацию и адгезию тромбоцитов, эритроцитов и лейкоцитов, высвобождение из них БАВ, потенцирующих, в свою очередь, клеточную агрегацию и тромбообразование как в просвете, так и на внутренней поверхности коронарных артерий. • Спазм коронарных артерий. Развитие коронарной недостаточности в результате сосудистого спазма доказано ангиографическими исследованиями. † Решающее значение в развитии коронароспазма имеют катехоламины. Значительное увеличение их содержания в крови или повышение адренореактивных свойств сосудов миокарда, как правило, сопровождается всеми клиническими, электрокардиографическими и биохимическими изменениями, свойственными стенокардии. Аргументы в пользу симпатергического (катехоламинового) механизма спазма артериол при коронарной недостаточности: развитие эпизодов коронарной недостаточности при стрессовых ситуациях, частые приступы стенокардии при феохромоцитоме, развитие коронарной недостаточности при внутриартериальном введении адреналина, повышение содержания катехоламинов в крови до и на высоте эпизода коронарной недостаточности. Доказано также существенное значение в развитии коронароспазма тромбоксана А2, ПгF2 † В реальной жизни коронарная недостаточность является результатом действия комплекса взаимосвязанных факторов: ‡ сокращения ГМК коронарных артерий и уменьшения их просвета под влиянием катехоламинов, тромбоксана А2, ПгF2 ‡ уменьшения внутреннего диаметра просвета коронарных артерий в результате утолщения её стенки (за счёт атеросклеротических изменений, гипертрофии мышечной оболочки, фиброзных изменений, отёка и др.); ‡ сужения и закрытия просвета сосуда агрегатами форменных элементов крови. Эти представления суммированы в концепции о динамическом стенозе коронарных артерий (рис. 22–4). 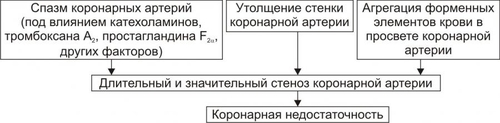 Рис. 22–4. Основные звенья механизма динамического стеноза венечных артерий сердца. • Уменьшение притока крови к сердцу и снижение в связи с этим перфузионного давления в коронарных артериях. К этому приводят значительная бради- или тахикардия, трепетание и мерцание предсердий и/или желудочков сердца, недостаточность аортальных клапанов, острая артериальная гипотензия, сдавление коронарных артерий сердца (опухолью, рубцом, инородным телом). УВЕЛИЧЕНИЕ ПОТРЕБЛЕНИЯ МИОКАРДОМ КИСЛОРОДА Факторы, вызывающие значительное увеличение потребления миокардом кислорода и субстратов обмена веществ, представлены на рис. 22–5. 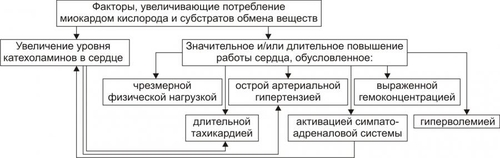 Рис. 22–5. Факторы, увеличивающие потребление миокардом кислорода и субстратов обмена веществ. • Существенное повышение в сердце уровня катехоламинов (например, при стрессе или феохромоцитоме). Избыток катехоламинов в миокарде обусловливает развитие их кардиотоксического эффекта. Механизмы кардиотоксического эффекта катехоламинов представлены на рис. 22–6. 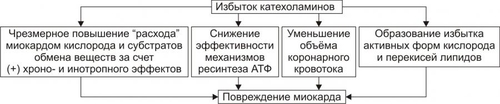 Рис. 22–6. Механизмы кардиотоксического действия избытка катехоламинов в миокарде. † Чрезмерное повышение расхода O2 и субстратов метаболизма миокардом. Последнее связано с положительным хроно и инотропным эффектами катехоламинов и значительным возрастанием в связи с этим функции сердца. † Снижение эффективности ресинтеза АТФ и, в связи с этим, расхода кислорода и субстратов окисления. Последнее вызвано повреждением мембранного аппарата кардиомиоцитов (прежде всего — плазматической мембраны, митохондрий), инактивацией ферментов тканевого дыхания, гликолиза, пентозофосфатного шунта (при этом мембраны и ферменты альтерируются свободными радикалами, продуктами нарушенного метаболизма и перекисного окисления липидов. Образование их стимулируют катехоламины, а также — активированные гидролазы лизосом) и разобщением окислительного фосфорилирования избытком ВЖК и ионов под влиянием катехоламинов. † Уменьшение (в сравнении с потребным) величины коронарного кровообращения. Это является результатом укорочения (в условиях катехоламиновой тахикардии) диастолы, в течение которой приток крови к миокарду максимален, повышения напряжения миокарда и сдавления в связи с этим коронарных сосудов, усиления агрегации клеток крови в просвете микрососудов. В целом развитие коронарной недостаточности при чрезмерной активации симпатикоадреналовой системы характеризуется как увеличением расхода гиперфункционирующим миокардом O2 и метаболитов, так и ограничением их притока к миокарду по коронарным артериям. • Значительное возрастание работы сердца. Наиболее часто является следствием чрезмерной физической нагрузки, длительной тахикардии, острой артериальной гипертензии, выраженной гемоконцентрации, значительной гиперволемии. Важно, что чрезмерное увеличение работы сердца, а также причины, вызвавшие её, как правило, одновременно приводят и к активации симпатикоадреналовой системы. Последнее сопровождается высвобождением избытка катехоламинов и реализацией их кардиотоксического действия. СНИЖЕНИЕ СОДЕРЖАНИЯ В КРОВИ И КЛЕТКАХ МИОКАРДА КИСЛОРОДА Состояния, приводящие к значительному снижению содержания в крови и клетках миокарда кислорода и/или субстратов обмена веществ, представлены на рис. 22–7. 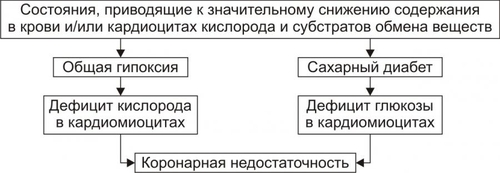 Рис. 22–7. Состояния, приводящие к снижению содержания в крови и/или кардиомиоцитах кислорода и субстратов метаболизма. МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ СЕРДЦА ПРИ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ Недостаток кислорода и субстратов обмена веществ в миокарде, а также нарушение оттока продуктов нарушенного метаболизма, ионов, БАВ в условиях коронарной недостаточности приводят к включению ряда типовых механизмов повреждения миокарда (рис. 22–8). 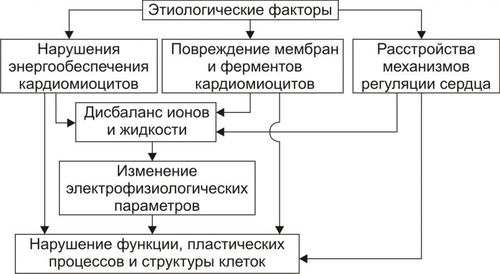 Рис. 22–8. Механизмы повреждения сердца при коронарной недостаточности. Механизмы альтерации клеток подробно рассмотрены в разделе «Общие механизмы повреждения» главы 4 «Патология клетки». Указанные механизмы (расстройство энергетического обеспечения кардиомиоцитов, повреждение их мембран и ферментов, дисбаланс ионов и жидкости, изменение механизмов регуляции сердечной деятельности) реализуются как в зоне ишемии, так и за её пределами, хотя в последней — в существенно меньшей мере. РАССТРОЙСТВО ЭНЕРГООБЕСПЕЧЕНИЯ КАРДИОМИОЦИТОВ Механизмы расстройств энергообеспечения кардиомиоцитов при коронарной недостаточности представлены на рис. 22–9. 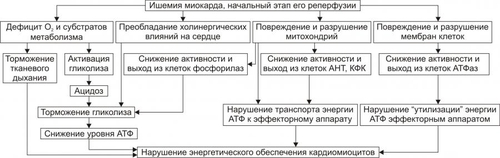 Рис. 22–9. Механизмы нарушения энергетического обеспечения миокарда при коронарной недостаточности (период ишемии и начальный этап реперфузии). АНТ — адениннуклеотидтрансфераза. • В аэробных условиях основными субстратами для синтеза АТФ служат жирные кислоты (65–70%), глюкоза (15–20%) и МК (10–15%). Роль аминокислот, кетоновых тел и пирувата в энергообеспечении миокарда сравнительно невелика. • В условиях нарастающей ишемии в миокарде развивается истощение связанного с миоглобином резерва кислорода и снижение интенсивности окислительного фосфорилирования. † В результате указанных изменений в кардиомиоцитах уменьшается содержание АТФ и креатинфосфата (рис. 22–10). 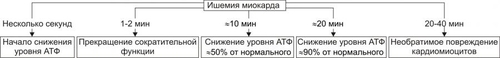 Рис. 22–10. Изменения в клетках миокарда в зависимости от продолжительности ишемии. † Нарушение аэробного синтеза АТФ приводит к активации гликолиза и накоплению в миокарде лактата. Одновременно быстро уменьшаются запасы гликогена. † Активация гликолитического метаболизма углеводов обусловливают развитие ацидоза. † Развитие внутри- и внеклеточного ацидоза существенно изменяет проницаемость мембран для метаболитов и ионов, подавляет активность ферментов энергообеспечения, синтеза клеточных структур, транспорта субстратов метаболизма и катионов. В отдалённых от зоны ишемии участках сердца процессы энергетического обеспечения миокарда страдают в значительно меньшей мере. • Последствия расстройств процессов энергообеспечения кардиомиоцитов: снижение сократительной функции миокарда, нарушения кровообращения в органах и тканях, развитие сердечных аритмий. Нарушения ритма сердца, в свою очередь, нередко становятся причиной внезапной смерти пациентов с коронарной недостаточностью. 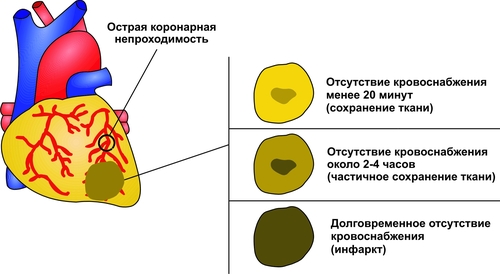 Последствия ишемии миокарда. Чем позже происходит реперфузия, чем более выражено повреждение сердечной мышцы. [по 4]. ПОВРЕЖДЕНИЕ МЕМБРАН И ФЕРМЕНТОВ КАРДИОМИОЦИТОВ Основные свойства миокарда (автоматизм, возбудимость, проводимость, сократимость), а также их регуляция в значительной мере зависят от состояния мембран и ферментов кардиомиоцитов. В условиях ишемии их повреждение является следствием действия ряда общих факторов. Основные механизмы повреждения клеточных мембран и ферментов подробно рассмотрены в разделе «Общие механизмы повреждения» главы 4 «Патология клетки» (подраздел «Повреждение мембран и ферментов») и приведены на рис. 22–11. 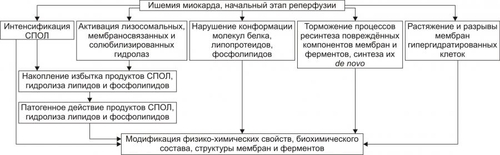 Рис. 22–11. Механизмы повреждения мембран и ферментов клеток миокарда при коронарной недостаточности (период ишемии и начальный этап реперфузии). Дисбаланс ионов и жидкости Ионный дисбаланс (рис. 22–12, см. также раздел «Дисбаланс ионов и воды в клетке» в главе 4 «Повреждение клетки») развивается вслед за расстройствами энергообеспечения кардиомиоцитов и повреждением их мембран и ферментов или одновременно с ними. 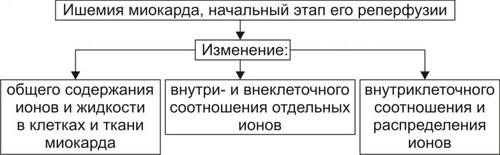 Рис. 22–12. Дисбаланс ионов и жидкости в миокарде при коронарной недостаточности (период ишемии и начальный этап реперфузии). Дисбаланс ионов и воды, развивающийся при ишемии миокарда, относится как к общему содержанию ионов и жидкости в клетках и ткани миокарда в целом, так и к внутри- и внеклеточному соотношению отдельных ионов (прежде всего Na+, K+, Cl–, Ca2+), а также к внутриклеточному соотношению и распределению (компартментализации) отдельных ионов. • Общее содержание ионов в клетках ишемизированного миокарда существенно возрастает. • Внутри и внеклеточное соотношение и распределение отдельных ионов, а также жидкости в кардиомиоцитах значительно изменяется (рис. 4–9, рис. 22–13). 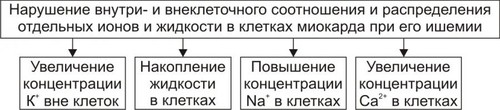 Рис. 22–13. Нарушение внутри и внеклеточного соотношения и распределения отдельных ионов и жидкости в клетках миокарда при его ишемии. Особенно важны нижеперечисленные изменения. † Увеличение [K+] вне кардиомиоцитов вследствие снижения активности Na+,K+АТФазы, дефицита АТФ, повышения проницаемости плазматической мембраны. Потеря K+ кардиомиоцитами сопровождается повышением его содержания в интерстициальной жидкости и крови. В связи с этим гиперкалиемия является одним из характерных признаков коронарной недостаточности, особенно при инфаркте миокарда. † Повышение содержания ионов Na+ в кардиомиоцитах, увеличение [Ca2+] в клетках миокарда, расстройство регуляции объёма клеток миокарда. Указанные факторы приводят к накопление избытка жидкости в клетках миокарда и существенному увеличению их объёма. • Последствия дисбаланса ионов и жидкости в миокарде при коронарной недостаточности представлены на рис. 22–14. 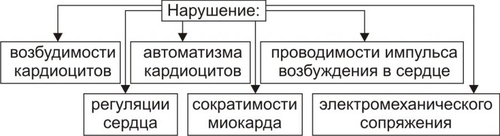 Рис. 22–14. Последствия дисбаланса ионов и жидкости в миокарде при коронарной недостаточности (период ишемии и начальный этап реперфузии). Дисбаланс ионов и жидкости вызывает нарушение ряда фундаментальных процессов (прежде всего электрогенеза и сократительных характеристик), протекающих в клетках миокарда (см. рис. 4–11). При ишемии миокарда страдают все процессы мембранного электрогенеза: возбудимость клеток миокарда, автоматизм ритмогенеза и проведение импульсов возбуждения. В связи с существенными отклонениями трансмембранного электрогенеза развиваются аритмии сердца. РАССТРОЙСТВА МЕХАНИЗМОВ РЕГУЛЯЦИИ СЕРДЕЧНОЙ ДЕЯТЕЛЬНОСТИ Изменение функции сердца в целом, а также характер и степень повреждения его клеток при коронарной недостаточности является результатом не только прямой их альтерации патогенными факторами ишемии. В значительной мере эти изменения обусловлены и расстройствами механизмов регуляции сердечной деятельности. Эти расстройства развиваются на одном (реже) или нескольких (чаще) уровнях регуляции: взаимодействия БАВ (гормонов, нейромедиаторов) с рецепторами, образования клеточных (вторых) посредников регуляторных влияний, метаболических клеточных реакций, регулируемых внутриклеточными посредниками. Подробнее эти вопросы рассмотрены в разделе «Расстройства регуляции внутриклеточных процессов» (глава 4 «Патология клетки»). • Коронарная недостаточность характеризуется стадийными изменениями активности симпатического и парасимпатического механизмов регуляции. † На начальном этапе ишемии миокарда, как правило, наблюдается значительная активация симпатикоадреналовой системы. Это сопровождается увеличением содержания в миокарде норадреналина и особенно адреналина. Вследствие этого развивается тахикардия, увеличивается величина сердечного выброса, как правило, снижающегося сразу после начала эпизода коронарной недостаточности. Параллельно с этим могут усиливаться и парасимпатические влияния (о чем свидетельствует увеличение в миокарде содержания ацетилхолина), но степень их усиления меньше, чем симпатических. † На более поздних сроках коронарной недостаточности (через несколько десятков минут, иногда — часов) нередко регистрируется уменьшение содержания в миокарде содержания норадреналина и сохранение повышенного уровня ацетилхолина. Одновременно отмечаются брадикардия, снижение величины сердечного выброса, скорости сокращения и расслабления миокарда. • В условиях коронарной недостаточности (особенно при длительной ишемии и на начальном этапе реперфузии миокарда) развивается феномен гормононейромедиаторной диссоциации катехоламинов (соотношение нейромедиатора норадреналина и гормона адреналина). Этот феномен характеризуется: † значительным увеличением в ишемизированном миокарде концентрации адреналина и реализацией его кардиотоксических эффектов. В частности, механизм прооксидантного действия избытка адреналина в сердце приведён на рис. 22–15. † одновременным уменьшением содержания норадреналина. Феномен гормоно-нейромедиаторной диссоциации катехоламинов сопровождается потенцированием ишемического и реперфузионного повреждения миокарда (см. ниже в разделе «Эффекты постокклюзионной реперфузии миокарда»). 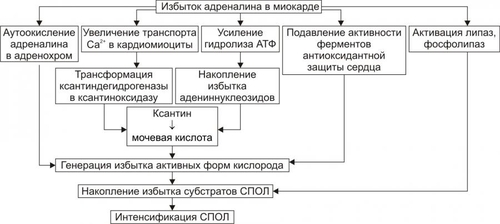 Рис. 22–15. Механизмы прооксидантного эффекта избытка адреналина в миокарде. • Коронарная недостаточность сопровождается и другими изменениями нейрогуморальной регуляции функции сердца, но они весьма индивидуализированы (в зависимости от длительности эпизода коронарной недостаточности, числа их в анамнезе, возраста пациента, выраженности сердечной недостаточности и т.д.) и рассматриваются в клинических руководствах. ЭФФЕКТЫ ПОСТОККЛЮЗИОННОЙ РЕПЕРФУЗИИ МИОКАРДА Наиболее распространённая форма коронарной недостаточности — стенокардия — характеризуется спонтанной или вызванной медикаментозно сменой более или менее длительного периода ишемии миокарда периодом возобновления коронарного кровотока — реперфузией. Частота состояний, обусловленных постокклюзионной (постстенотической) реперфузией миокарда в последние десятилетия значительно увеличилась в связи с внедрением в клиническую практику различных ангиопластических (см. статью «Ангиопластика» в приложении «Справочник терминов») и/или медикаментозных (фибринолизис, дезагрегация клеток крови, вазодилатация и др.) методов устранения стеноза или окклюзии магистральных ветвей коронарных артерий. РЕПЕРФУЗИЯ Возобновление тока крови (реперфузия) является самым эффективным способом прекращения действия патогенных факторов ишемии миокарда и устранения последствий их влияния на сердце.
• Вместе с тем начальный этап постокклюзионной реперфузии коронарных сосудов и миокарда нередко сопровождается существенными расстройствами функции сердца: развитием аритмий, включая фибрилляцию желудочков, что чревато смерть пациента; преходящей дестабилизацией показателей центрального и органнотканевого кровообращения, дисбалансом биохимических и электрофизиологических параметров сердца. Таким образом, на раннем этапе реперфузии возможно пролонгирование и даже потенцирование повреждения реперфузируемого участка сердца. В связи с этим сформулировано положение о том, что коронарная недостаточность является совокупностью двух синдромов: ишемического и реперфузионного, а не только одного — ишемического, как считалось ранее. РЕПЕРФУЗИОННОЕ ПОВРЕЖДЕНИЕ МИОКАРДА Постокклюзионная реперфузия коронарных артерий оказывает, наряду с основным — репаративным, восстановительным эффектом, также и патогенное действие на миокард. Последнее является совокупным следствием пролонгирования его ишемического повреждения, а также дополнительной альтерации миокарда факторами реперфузии и реоксигенации. • Основные механизмы дополнительного — реперфузионного — повреждения клеток миокарда. † Усугубление нарушения энергетического обеспечения клеток реперфузируемого миокарда на этапах ресинтеза, транспорта, утилизации энергии АТФ (см. рис. 22–9). ‡ Подавление ресинтеза АТФ. Основные причины: гипергидратация, набухание и разрушение митохондрий в реперфузируемом миокарде (является результатом осмотического отёка органелл, перерастяжения и разрыва их мембран в связи с избыточным накоплением в них Ca2+ и жидкости), разобщающий эффект избытка Ca2+, выход АДФ, АМФ и других пуриновых соединений из митохондрий кардиомиоцитов в межклеточную жидкость. ‡ Нарушение механизма транспорта энергии АТФ в клетках миокарда и снижение эффективности механизмов утилизации энергии АТФ. † Нарастание степени повреждения мембран и ферментов клеток и миокарда (см. рис. 22–11). Причины: реперфузионная (кислородзависимая) интенсификации липопероксидного процесса, кальциевая активация протеаз, липаз, фосфолипаз и других гидролаз, а также осмотическое набухание и разрыв мембран клеток миокарда и их органелл. † Нарастание дисбаланса ионов и жидкости в кардиомиоцитах (см. рис. 22–12). Причины: реперфузионные расстройства процессов энергообеспечения и повреждение мембран и ферментов. Это обусловливает накопление избытка Na+ и Ca2+ в клетках миокарда и как следствие — жидкости в них. † Снижение эффективности регуляторных (нервных, гуморальных) воздействий на клетки миокарда (в норме способствующих интеграции и нормализации внутриклеточных процессов). † Нарастание выраженности гормононейромедиаторной диссоциации. • Рациональная терапия постишемических реперфузионных состояний позволяет: † предотвратить развитие инфаркта миокарда или значительно уменьшить объём поражённого участка миокарда, † стимулировать процессы репарации в сердечной мышце, † нормализовать сократительную функцию сердца, † восстановить оптимальные параметры кровообращения в организме. ИЗМЕНЕНИЕ ОСНОВНЫХ ПОКАЗАТЕЛЕЙ ФУНКЦИИ СЕРДЦА ПРИ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ Коронарная недостаточность сопровождается характерными изменениями ЭКГ и показателей сократительной функции сердца. • Изменения ЭКГ. † В покое примерно у половины пациентов, которые не переносили ранее инфаркта миокарда, какихлибо характерных отклонений не выявляется. † В момент болевого приступа, как правило, регистрируются снижение (депрессия) сегмента ST (он становится горизонтальным либо дугообразным), инверсия зубца T (часто, но не всегда), преходящий подъём сегмента ST при вариантной стенокардии. При отсутствии противопоказаний изменения на ЭКГ исследуют на фоне нагрузок. • Изменения показателей сократительной функции сердца. † Ударный и сердечный выброс. Они, как правило, снижаются. ‡ Величина снижения обычно коррелирует со степенью и продолжительностью ишемии миокарда, размером и топографией повреждённой зоны сердца. ‡ Причина: Снижение величины ударного выброса связано в основном с «выключением» ишемизированного региона миокарда из сократительного процесса. Одним из механизмов компенсации снижения ударного выброса сердца является тахикардия. Она обусловлена главным образом активацией симпатикоадреналовой системы (в ответ на падение величины сердечного выброса), а также — повышением давления крови в полых венах и предсердиях. † Конечное диастолическое давление в полостях сердца обычно возрастает. Основные причины: снижение сократительной функции повреждённого миокарда и уменьшение степени диастолического расслабления миокарда. Это вызвано субконтрактурным состоянием его в связи с избытком Ca2+ в цитозоле и миофибриллах кардиомиоцитов. На начальном этапе коронарной недостаточности содержание Ca2+ в саркоплазме увеличивается в основном в связи с его выходом из митохондрий и саркоплазматической сети; на более поздних — в связи с его поступлением из внеклеточной жидкости через повреждённую плазмолемму. † Скорость систолического сокращения и диастолического расслабления миокарда существенно снижается. Основные причины. дефицит энергии АТФ, повреждение мембран миофибрилл, саркоплазматической сети и саркоплазмы, снижение активности Ca2+зависимых АТФаз. АРИТМИИ СЕРДЦА Аритмия — типовая форма патологии сердца — характеризуется нарушением частоты и периодичности генерации возбуждения и/или последовательности возбуждения предсердий и желудочков. • Дополнительный материал по патофизиологии аритмий изложен в приложении «Справочник терминов» (статьи «Аритмия сердца», «Блокада сердца», «Брадикардия», «Гиперкалиемия», «Кардиоверсия», «Тахикардия», «Трепетание», «Фибрилляция», «Экстрасистола», «Экстрасистолии», «Электрокардиография», «Электрокардиостимуляция», а также статьи и подстатьи по упомянутым в этом разделе нозологическим единицам). ВИДЫ АРИТМИЙ, ИХ ЭТИОЛОГИЯ И ПАТОГЕНЕЗ Аритмии являются следствием нарушения свойств автоматизма, проводимости и возбудимости или их комбинированных нарушений. Расстройства сократимости лежат в основе развития сердечной (миокардиальной) недостаточности, и не являются непосредственной причиной нарушений ритма сердца. АРИТМИИ В РЕЗУЛЬТАТЕ НАРУШЕНИЯ АВТОМАТИЗМА Автоматизм — способность ткани сердца спонтанно генерировать ПД. Автоматизм определяется своеобразием формирования МП в клетках–водителях ритма. Оно заключается в спонтанном медленном уменьшении величины диастолической поляризации. Эта разность потенциалов, возникающая вследствие снижения выхода из клетки ионов калия и медленного поступления в неё ионов натрия во время диастолы, в конце концов резко увеличивает проницаемость мембраны для Na+, что вызывает формирование электрического импульса (ПД). Изменение нормального автоматизма обусловлено нарушением функций синусно-предсердного узла, водителей ритма второго и третьего порядков. Возникновение патологического автоматизма (эктопическая активность) может наблюдаться в ткани предсердий, желудочков, пучке Хиса, волокнах Пуркинье при частичной деполяризации кардиомиоцитов. Триггерная активность (ранняя и поздняя постдеполяризация) обусловливает возникновение эктопических импульсов: ранняя постдеполяризация появляется во время 3ей фазы ПД, поздняя — после её окончания. • При ранней постдеполяризации эктопические импульсы формируются в фазу ранней реполяризации на фоне медленного ритма. Механизм постдеполяризации запускается в результате увеличения продолжительности ПД — например, при удлинении интервала QT, низком внутриклеточном содержании ионов калия. Примером возникновения аритмии вследствие ранней постдеполяризации является желудочковая тахикардия типа «пируэт» (torsade de pointes, произносится как «торсад дё пуант») в условиях доминирования парасимпатических влияний на сердце (при неврозах или гипотиреозе). • При поздней постдеполяризации эктопические импульсы возникают на фоне ускоренного ритма. Основной причиной их появления считают перегрузку кардиомиоцитов ионами кальция в результате избыточных адренергических влияний на них при гипертрофии миокарда и сердечной недостаточности, интоксикации сердечными гликозидами, реперфузии (восстановление нарушенного кровотока в сосудах сердца с помощью тромболитиков). Примерами возникновения аритмий в результате поздней постдеполяризации являются желудочковые экстрасистолы и тахикардии при гликозидной интоксикации, желудочковые экстрасистолы при сердечной недостаточности, катехоламинзависимые предсердные и желудочковые тахикардии. ВИДЫ НОМОТОПНЫХ И ГЕТЕРОТОПНЫХ АРИТМИЙ В зависимости от места (топографии) генерации аномального импульса возбуждения, выделяют номотопные и гетеротопные аритмии (рис. 22–16, см. также статью «Система проводящая сердца» в приложении «Справочник терминов»). 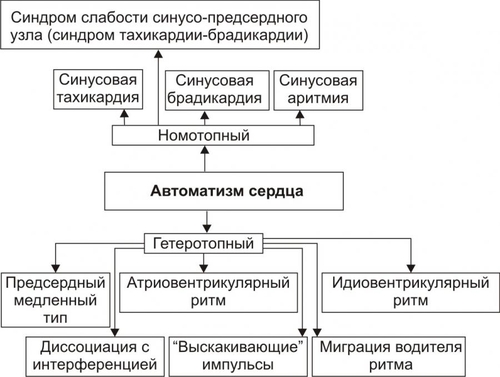 Рис. 22–16. Виды аритмий в результате нарушения автоматизма сердца. • Номотопные аритмии. Возникают в синусно-предсердном узле. К ним относятся синусовые тахикардия, брадикардия, аритмия и синдром слабости синуснопредсердного узла. • Гетеротопные аритмии. Это эктопические ритмы. Они возникают вне синуснопредсердного узла и обусловлены преобладанием автоматизма нижележащих центров ритмогенеза. Проявления этих аритмий: миграция наджелудочкового водителя ритма, предсердный медленный ритм, атриовентрикулярный (АВ) ритм (узловой ритм), идиовентрикулярный редкий (желудочковый) ритм (гетеротопный ритм сердца, при котором водитель ритма — пейсмейкер — расположен в миокарде желудочков), идиовентрикулярный ускоренный ритм сердца — ЧСС 60–120 в 1 мин (возникает при патологической циркуляции возбуждения по миокарду желудочков), АВ диссоциация — полное прекращение проведения возбуждения от предсердий к желудочкам; при этом предсердия и желудочки сокращаются независимо друг от друга (полный поперечный блок), «выскакивающие» импульсы. ПАТОГЕНЕЗ И ПРОЯВЛЕНИЯ НОМОТОПНЫХ АРИТМИЙ • Синусовая тахикардия — увеличение в покое частоты генерации в синусно-предсердном узле импульсов возбуждения (как правило, более 100 в минуту) с одинаковыми интервалами между ними. † Электрофизиологический механизм: ускорение спонтанной диастолической деполяризации плазмолеммы клеток синусно-предсердного узла. † Причины. ‡ Активация влияния на сердце симпатикоадреналовой системы. При этом увеличивается выброс нейромедиатора норадреналина из терминалей симпатической нервной системы и гормона адреналина из мозгового вещества надпочечников. Такая ситуация наиболее часто наблюдается при эмоциональном стрессе, физических нагрузках, неврозах, острой артериальной гипотензии (сопровождающейся активацией афферентной импульсации с барорецепторов), сердечной недостаточности (вследствие повышения притока крови к правому предсердию и включению рефлекса Бейнбриджа), гипертермии, лихорадке. ‡ Снижение влияния на сердце парасимпатической нервной системы. Это может быть следствием повреждения центральных нервных образований (подкорковых ядер, ретикулярной формации, ядер продолговатого мозга), проводящих путей, парасимпатических ганглиев и нервных стволов, холинорецепторов миокарда, что обусловливает снижение холинореактивных свойств сердца. ‡ Прямое действие повреждающих факторов различной природы (физических, химических, биологических) на клетки синусно-предсердного узла. Последнее часто наблюдается при миокардитах, инфаркте миокарда, перикардитах, механической травме, кардиосклерозе. • Синусовая брадикардия — уменьшение в покое частоты генерации синусно-предсердным узлом импульсов возбуждения ниже нормы (как правило, 40–60 в минуту) с одинаковыми интервалами между ними. † Ведущий электрофизиологический механизм: замедление процесса спонтанной диастолической деполяризации мембран клеток синусно-предсердного узла. † Причины. ‡ Активация эффектов парасимпатической нервной системы на сердце. Наблюдается при раздражении ядер блуждающего нерва (в частности, вследствие повышения внутричерепного давления при менингитах, энцефалитах и т.п.) или его окончаний, повышении внутрижелудочкового давления и тонуса миокарда, надавливании на глазные яблоки (рефлекс АшнераДаньини), а также в зоне проекции бифуркации сонной артерии (рефлекс Херинга) и в области солнечного сплетения. ‡ Снижение симпатикоадреналовых эффектов на сердце. Синусовая брадикардия может развиваться при срыве ВНД (неврозе), повреждении мозговых структур (например, гипоталамуса), проводящих путей, внутрисердечных ганглиев и окончаний симпатических нервных волокон в миокарде, снижении адренореактивных свойств сердца. ‡ Непосредственное воздействие повреждающих факторов на клетки синусно-предсердного узла. Такими факторами могут быть механическая травма, кровоизлияние или инфаркт в зоне синусно-предсердного узла, токсины и ЛС (хинин, препараты наперстянки, опиаты, холиномиметики), метаболиты (непрямой билирубин, жёлчные кислоты). Указанные выше факторы могут обусловить не только развитие синусовой брадикардии, но и (при их значительной силе или длительности действия) существенное снижение частоты импульсов (менее 50 в минуту) или прекращение генерации импульсов синуснопредсердным узлом. Такие состояния называют соответственно «синдром слабости синуснопредсердного узла» и «остановка синусно-предсердного узла» (синоатриальная блокада стадии III). • Синусовая аритмия — нарушение сердечного ритма, характеризующееся неравномерными интервалами между отдельными ПД, исходящими из синусно-предсердного узла. Аритмия проявляется сменой периодов нормального ритма периодами тахи и брадикардии или медленным восстановлением синусового ритма после эпизода тахикардии (последнее является проявлением синдрома слабости синуснопредсердного узла). Синусовая аритмия наблюдается при различных формах невроза, энцефалитов, стенокардии, отравлений и т.п. † Электрофизиологический механизм: колебания скорости (увеличение, снижение) медленной спонтанной диастолической деполяризации пейсмейкерных клеток. † Наиболее частые причины: флуктуация (усиление/ослабление) парасимпатических влияний на сердце, нарушение соотношения симпатикоадреналовых и парасимпатических воздействий на миокард, колебание содержания в крови газов (О2 и CO2), метаболитов (лактата, пирувата, жёлчных кислот), ЛС (наперстянки, опиатов, холино и симпатолитиков, холино и симпатомиметиков), изменение холино и адренореактивных свойств сердца, действие физических факторов непосредственно на клетки синусно-предсердного узла (травма, кровоизлияние, новообразование и т.п.). • Синдром слабости синуснопредсердного узла (синдром брадикардии–тахикардии) — неспособность синуснопредсердного узла обеспечивать ритм сердца, адекватный уровню жизнедеятельности организма. † Электрофизиологические механизмы: нарушение (нередко временное прекращение) автоматизма синуснопредсердного узла, особенно фаз реполяризации и спонтанной диастолической деполяризации и возникновение на этом фоне гетеротопных (эктопических) очагов ритмической активности. † Причины. ‡ Расстройство сбалансированности симпатикоадреналовых и парасимпатических влияний на сердце с преобладанием последних. Развиваются у пациентов с невротическими состояниями (психастенией, истерией, неврозом навязчивых состояний), неправильной дозировкой ЛС (например, ‡ Нарушение адрено и холинореактивных свойств клеток синуснопредсердного узла. Чаще происходит снижение их адрено и/или повышение холинореактивности. ‡ Прямые повреждающие воздействия на сердце в области синуснопредсердного узла (ишемия, кровоизлияния, опухоли, травмы, воспалительные процессы). † Главные ЭКГ–проявления: периодическая или постоянная синусовая брадикардия, сменяющаяся синусовой тахикардией, трепетанием или мерцанием предсердий, медленное восстановление синусового ритма после прекращения синусовой тахикардии, эпизоды остановки синуснопредсердного узла. † Показатели гемодинамики. ‡ Синусовая тахикардия и аналогичный период синусовой аритмии могут сопровождаться увеличением сердечного выброса (за счёт повышения ЧСС) и незначительным возрастанием систолического АД. ‡ Синусовая брадикардия и аналогичный период синусовой аритмии могут сочетаться с: |
