Патфиз ч.3. Патфиз ч. Частнаяпатология
 Скачать 13.12 Mb. Скачать 13.12 Mb.
|
|
§ Триггерная активность формируется на основе предшествующего ПД в случае, если МП постдеполяризации достигает порогового диапазона. § Триггерная активность развивается во время периода реполяризации (2–я и 3–я фазы ПД) и в завершающей фазе ПД (в фазе 4). В соответствии с этим выделяют раннюю и задержанную постдеполяризацию. ‡ Феномен постдеполяризации мембраны. Описанные выше механизмы (reentry и аномального автоматизма) могут лежать в основе формирования одиночного импульса и обусловить возникновение экстрасистолы. При наличии условий для повторного возникновения экстрасистол возможна генерация серии импульсов, приводящих к развитию пароксизмальной тахикардии, трепетания или фибрилляции предсердий и желудочков. СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ Сердечная недостаточность — одна из частных причин утраты трудоспособности, инвалидизации и смерти пациентов, страдающих заболеваниями ССС. Сердечная недостаточность — не нозологическая форма, не болезнь. Это синдром, развивающийся при многих болезнях, в том числе — поражающих органы и ткани, не относящиеся к ССС. Сердечная недостаточность — типовая форма патологии, при которой сердце не обеспечивает потребности органов и тканей в адекватном (их функции и уровню пластических процессов в них) кровоснабжении. Проявляется меньшей (в сравнении с потребной) величиной сердечного выброса, а также циркуляторной гипоксией. Сущность сердечной недостаточности заключается в том, что сердце (при данном ОПСС) не может переместить в артериальное русло всю кровь, притекающую к нему по венам. ПРИЧИНЫ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Две основных группы причин приводят к развитию сердечной недостаточности: оказывающие непосредственное повреждающее действие на сердце и обусловливающие функциональную перегрузку сердца, ПОВРЕЖДЕНИЕ СЕРДЦА Факторы, непосредственно повреждающие сердце, могут иметь физическую, химическую и биологическую природу. • Физические факторы: сдавление сердца (экссудатом, кровью, эмфизематозными лёгкими, опухолью), воздействие электрического тока (при электротравме, проведении дефибрилляции сердца), механическая травма (при ушибах грудной клетки, проникающих ранениях, хирургических манипуляциях). • Химические факторы: нелекарственные химические соединения (например, разобщители окислительного фосфорилирования, соли кальция и тяжёлых металлов, ингибиторы ферментов, гидроперекиси липидов), ЛС в неадекватной дозировке (например, антагонисты кальция, сердечные гликозиды, адреноблокаторы), дефицит кислорода, недостаток химических соединений, необходимых для обмена веществ (например, соли различных металлов). • Биологические факторы. † Высокие уровни БАВ (например, катехоламинов, T4). † Дефицит или отсутствие БАВ, необходимых для метаболизма (например, ферментов, витаминов и др.). † Длительная ишемия или инфаркт миокарда. Вызывает прекращение сокращений миокарда в зоне повреждения. Это сопровождается функциональной перегрузкой миокарда вне зоны ишемии или инфаркта. † Кардиомиопатии — поражения миокарда, преимущественно невоспалительной природы. Характеризуются существенными структурнофункциональными изменениями в сердце. ПЕРЕГРУЗКА СЕРДЦА Причины перегрузки сердца подразделяют на две подгруппы: увеличивающие преднагрузку или увеличивающие посленагрузку (рис. 22–23). 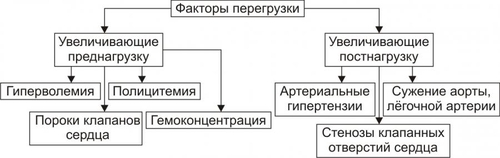 Рис. 22–23. Основные факторы перегрузки сердца. • Преднагрузка. Увеличение преднагрузки (объём крови, притекающей к сердцу и увеличивающей давление наполнения желудочков) наблюдается при гиперволемии, полицитемии, гемоконцентрации, клапанных пороках (сопровождаются увеличением остаточного объёма крови в желудочках). • Посленагрузка. Увеличение постнагрузки (сопротивление изгнанию крови из желудочков в аорту и лёгочную артерию, основным фактором постнагрузки является ОПСС) происходит при артериальных гипертензиях любого генеза, стенозах клапанных отверстий сердца, сужении крупных артериальных стволов (аорты, лёгочной артерии). ВИДЫ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Классификация видов сердечной недостаточности основана на критериях происхождения (миокардиальная и перегрузочная), скорости развития (острая и хроническая), преимущественного поражения отдела сердца (левожелудочковая и правожелудочковая), преимущественной недостаточности фазы сердечного цикла (систолическая и диастолическая) и первичности поражения (кардиогенная и некардиогенная). Выделенные на основе этих критериев виды сердечной недостаточности перечислены на рис. 22–24. 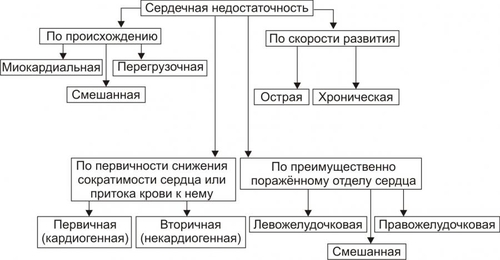 Рис. 22–24. Виды сердечной недостаточности. ПО ПРОИСХОЖДЕНИЮ По этому критерию выделены миокардиальная, перегрузочная и смешанные формы сердечной недостаточности. • Миокардиальная форма развивается преимущественно в результате непосредственного повреждения миокарда. • Перегрузочная форма сердечной недостаточности возникает преимущественно в результате перегрузки сердца (увеличения пред- или постнагрузки). • Смешанная форма сердечной недостаточности — результат сочетания прямого повреждения миокарда и его перегрузки. ПО СКОРОСТИ РАЗВИТИЯ По быстроте развития симптомов сердечной недостаточности выделены острая и хроническая формы. • Острая (развивается за минуты и часы). Является результатом инфаркта миокарда, острой недостаточности митрального и аортального клапанов, разрыва стенок левого желудочка. • Хроническая (формируется постепенно, в течение недель, месяцев, годами). Является следствием артериальной гипертензии, хронической дыхательной недостаточности, длительной анемии, пороков сердца. Течение хронической сердечной недостаточности может осложнять острая сердечная недостаточность. ПО ПЕРВИЧНОСТИ МЕХАНИЗМА РАЗВИТИЯ По снижению сократительной функции миокарда или уменьшению притока венозной крови к сердцу выделены первичная (кардиогенная) и вторичная (некардиогенная) формы сердечной недостаточности. • Первичная (кардиогенная). Развивается в результате преимущественного снижения сократительной функции сердца при близкой к нормальной величине притока венозной крови к нему. Наиболее часто наблюдается при ИБС (может сопровождаться инфарктом миокарда, кардиосклерозом, дистрофией миокарда), миокардитах (например, при воспалительных поражениях мышцы сердца или выраженных и длительных эндотоксинемиях), кардиомиопатиях. • Вторичная (некардиогенная). Возникает вследствие первичного преимущественного уменьшения венозного притока к сердцу при близкой к нормальной величине сократительной функции миокарда. Наиболее часто встречается при острой массивной кровопотере, нарушении диастолического расслабления сердца и заполнения его камер кровью (например, при сдавлении сердца жидкостью, накапливающейся в полости перикарда — кровью, экссудатом), эпизодах пароксизмальной тахикардии (что приводит к снижению сердечного выброса и возврату венозной крови к сердцу), коллапсе (например, вазодилатационном или гиповолемическом). ПО ПРЕИМУЩЕСТВЕННО ПОРАЖЁННОМУ ОТДЕЛУ СЕРДЦА В зависимости от преимущественного поражения левого или правого отделов сердца различают левожелудочковую и правожелудочковую сердечную недостаточность. • Левожелудочковая сердечная недостаточность. Может быть вызвана перегрузкой левого желудочка (например, при стенозе устья аорты) или снижением его сократительной функции (например, при инфаркте миокарда), т.е. состояниями, приводящими к уменьшению выброса крови в большой круг кровообращения, перерастяжению левого предсердия и застою крови в малом круге кровообращения. • Правожелудочковая сердечная недостаточность. Возникает при механической перегрузке правого желудочка (например, при сужении отверстия клапана лёгочной артерии) или высоком давлении в лёгочной артерии (при лёгочной гипертензии), т.е. состояниях, сопровождающихся уменьшением выброса крови в малый круг кровообращения, перерастяжением правого предсердия и застоем крови в большом круге кровообращения. • Тотальная. При этой форме выражена и левожелудочковая и правожелудочковая сердечная недостаточность. ПО ПРЕИМУЩЕСТВЕННОЙ НЕДОСТАТОЧНОСТИ ФАЗЫ СЕРДЕЧНОГО ЦИКЛА В зависимости от вида нарушения функций миокарда левого желудочка (снижение силы и скорости его сокращения или нарушение скорости расслабления) левожелудочковую сердечную недостаточность подразделяют на систолическую и диастолическую. • Диастолическая сердечная недостаточность — нарушение расслабления и наполнения левого желудочка. Обусловлена его гипертрофией, фиброзом или инфильтрацией и приводит к увеличению конечного диастолического давления и развитию сердечной недостаточности. • Систолическая сердечная недостаточность (хроническая) осложняет течение ряда заболеваний. При ней нарушается насосная (нагнетающая) функция сердца, что приводит к уменьшению сердечного выброса. ОБЩИЕ МЕХАНИЗМЫ РАЗВИТИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Миокардиальная форма сердечной недостаточности характеризуется снижением развиваемого сердцем напряжения. Это проявляется падением силы и скорости его сокращения и расслабления. Перегрузочная форма сердечной недостаточности формируется на фоне более или менее длительного периода его гиперфункции. Последнее в конце концов приводит к снижению силы и скорости сокращения и расслабления сердца. В обоих случаях (и при перегрузке, и при повреждении сердца) снижение его сократительной функции сопровождается включением экстра и интракардиальных механизмов компенсации этого сдвига. Все они, несмотря на известное своеобразие, в условиях целостного организма взаимосвязаны таким образом, что активация одного из них существенно влияет на реализацию другого. МЕХАНИЗМЫ ЭКСТРЕННОЙ КОМПЕНСАЦИИ СОКРАТИТЕЛЬНОЙ ФУНКЦИИ Механизмы экстренной компенсации сниженной сократительной функции сердца приведены на рис. 22–25. 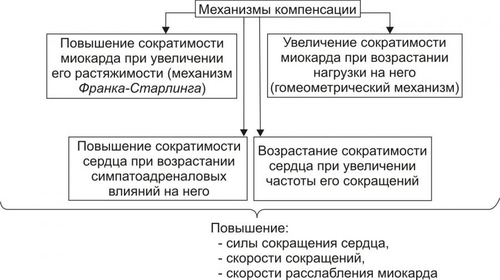 Рис. 22–25. Экстренные механизмы компенсации сниженной сократительной функции сердца. • Повышение сократимости миокарда при его растяжении притекающей кровью (механизм ФранкаСтарлинга). Обеспечивает увеличение развиваемого миокардом напряжения и скорости сокращения и расслабления. † Увеличение напряжения, развиваемого сердцем, осуществляется в ответ на нарастающее растяжение миокарда. В связи с этим механизм ФранкаСтарлинга называют гетерометрическим, т.е. связанным с возрастанием длины мышечного волокна. † Увеличение скорости сокращения и расслабления кардиомиоцитов развивается в связи с более быстрым выбросом Ca2+ из кальциевых депо (саркоплазматическая сеть) и последующим ускоренным закачиванием Ca2+ (Са2+-АТФазы) в цистерны саркоплазматической сети. • Увеличение силы сокращений миокарда в ответ на повышенную нагрузку. Происходит при неизменной длине миоцитов. Такой механизм называют гомеометрическим, поскольку он реализуется без значительного изменения длины мышечных волокон. • Возрастание сократимости сердца при увеличении ЧСС. • Повышение сократимости сердца в результате возрастания симпатикоадреналовых влияний. Характеризуется увеличением частоты и силы сокращений. † Симпатическая иннервация миокарда осуществляется окончаниями аксонов адренергических нейронов шейного верхнего, шейного среднего и звёздчатого (шейно-грудного) ганглиев. † Активация симпатических нервов вызывает положительный инотропный эффект. Увеличивается частота спонтанной деполяризации мембран водителей ритма, облегчается проведение импульса в волокнах Пуркинье, увеличивается частота и сила сокращения типичных кардиомиоцитов. † Действие катехоламинов на кардиомиоциты через КОМПЕНСАТОРНАЯ ГИПЕРФУНКЦИЯ СЕРДЦА Функционирование названных выше механизмов обеспечивает экстренную компенсацию сократительной функции перегруженного или повреждённого миокарда. Это сопровождается значительным и более или менее длительным увеличением интенсивности функционирования сердца — его компенсаторной гиперфункцией. КОМПЕНСАТОРНАЯ ГИПЕРТРОФИЯ СЕРДЦА Гиперфункция миокарда обусловливает экспрессию отдельных генов кардиомиоцитов. Она проявляется увеличением интенсивности синтеза нуклеиновых кислот и белков. Ускорение синтеза нуклеиновых кислот и белков миокарда приводит к нарастанию его массы — гипертрофии. Биологическое значение компенсаторной гипертрофии сердца заключается в том, что увеличенная функция органа выполняется его возросшей массой. МЕХАНИЗМЫ ДЕКОМПЕНСАЦИИ ГИПЕРТРОФИРОВАННОГО СЕРДЦА Потенциальные возможности гипертрофированного миокарда и увеличивать силу и скорость сокращения не беспредельны. Если на сердце продолжает действовать повышенная нагрузка или оно дополнительно повреждается, сила и скорость его сокращений падают, а их энергетическая «стоимость» возрастает: развивается декомпенсация гипертрофированного сердца. Механизмы декомпенсации гипертрофированного сердца перечислены на рис. 22–26. 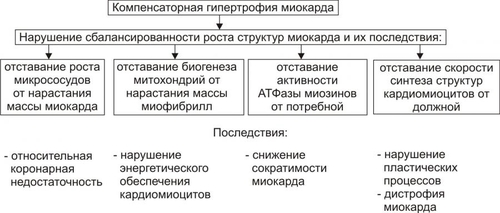 Рис. 22–26. Основные механизмы декомпенсации гипертрофированного сердца. В основе декомпенсации длительно гипертрофированного миокарда лежит нарушение сбалансированности роста различных его структур. Эти сдвиги — наряду с другими (см. рис 22–26) — в конечном счёте обусловливает уменьшение силы сердечных сокращений и скорости контрактильного процесса, т.е. — развитие сердечной недостаточности. КЛЕТОЧНО-МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Снижение сократительной функции сердца является итогом развития сердечной недостаточности самой разной этиологии. Несмотря на различие причин и известное своеобразие начальных звеньев патогенеза сердечной недостаточности, её механизмы на клеточном и молекулярном уровне едины. Главные из этих механизмов приведены на рис. 22–27. 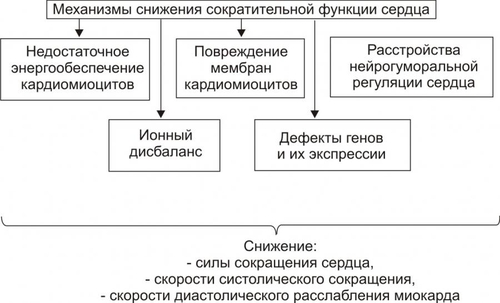 Рис. 22–27. Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности. • Недостаточность энергетического обеспечения клеток миокарда Расстройство энергоснабжения основных процессов, происходящих в клетках миокарда (прежде всего его сокращения и расслабления), развивается вследствие нарушения: ресинтеза макроэргов, транспорта их энергии к эффекторным структурам кардиомиоцитов, утилизации ими энергии макроэргических фосфатных соединений. Эти звенья патогенеза в общем виде рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства энергетического обеспечения клетки»). Нарушение обеспечения кардиомиоцитов энергией на этапах её продукции, транспорта и утилизации может быть как стартовым механизмом снижения сократительной функции сердца, так и существенным фактором нарастания её депрессии. • Повреждение мембран и ферментов кардиомиоцитов Повреждение клеточных мембран и ферментов рассмотрено в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Повреждение мембран и ферментов»). Альтерация мембран и ферментов клеток миокарда — главное, а нередко и инициальное звено патогенеза сердечной недостаточности. Изменение физикохимических свойств и конформации молекул белка (структурных и ферментов), липидов, фосфолипидов и ЛП сопровождается значительным обратимым, а часто — необратимым повреждением структуры и функции мембран и ферментов, в том числе — митохондрий, саркоплазматического ретикулума, миофибрилл, плазматической мембраны, обеспечивающих реализацию сократительной и ритмической функций сердца. • Ионный дисбаланс Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Дисбаланс ионов и воды в клетке»). Ниже приведены специфичные для развития сердечной недостаточности особенности ионного дисбаланса. Ионный дисбаланс при сердечной недостаточности проявляется нарушением соотношения между отдельными ионами в разных секторах кардиомиоцитов: в органеллах (митохондриях, саркоплазматическом ретикулуме, миофибриллах), в цитозоле, по разные стороны плазматической мембраны кардиомиоцитов. В наибольшей степени это относится к ионам: K+, Na+, Ca2+. Именно эти катионы в основном определяют реализацию таких процессов, как возбуждение, электромеханическое сопряжение, сокращение и расслабление миокарда. • Нарушения в генетической программ кардиомиоцитов Нарушения в генетической программе клеток и/или механизмов её реализации рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Генетические нарушения»). При сердечной недостаточности происходит активация генов, контролирующих процессы обновления субклеточных структур кардиомиоцитов, а также роста сосудов микроциркуляторного русла и нервных волокон. В частности, при ишемическом и стрессорном повреждении сердца подавлена экспрессия мРНК, для Ca2+зависимой АТФазы саркоплазматической сети. Это и потенцирует ингибирование процессов захвата и выброса Ca2+ ретикулумом миоцитов. В условиях ишемии и инфаркта миокарда, хронического эмоциональноболевого стресса подавлен также процесс трансляции генетической информации. Это сопровождается нарушением синтеза различных белков клеток миокарда. • Расстройства нейрогуморальной регуляции сердца Общая характеристика нарушений регуляции клеточных функций приведена в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства регуляции внутриклеточных процессов»). Ниже рассмотрены важные для развития сердечной недостаточности изменения симпатической и парасимпатической регуляции сердца. † Изменение механизмов симпатической регуляции. ‡ Уменьшение содержания нейромедиатора симпатической нервной системы — норадреналина в ткани сердца. Причины. Снижение синтеза норадреналина в нейронах симпатической нервной системы (в норме в них образуется около 80% медиатора, содержащегося в миокарде). Является результатом подавления активности фермент тирозин гидроксилазы и торможение захвата норадреналина нервными окончаниями. ‡ Снижение адренореактивных свойств сердца, т.е. выраженности ино-, хроно-, дромо- и батмотропных эффектов норадреналина и адреналина. † Изменение механизмов парасимпатической регуляции. ‡ Ацетилхолин через мхолинорецепторы вызывает уменьшение частоты сердечных сокращений, ингибируя образование цАМФ и активируя образование цГМФ. цГМФ активирует цГМФзависимую киназу, подавляющую активность потенциалозависимых Ca2+каналов. ‡ Изменение механизмов парасимпатической регуляции при сердечной недостаточности выражены значительно меньше, чем симпатической. Это является результатом более высокой резистентности парасимпатических механизмов к различным повреждающим факторам. Последствия нарушенных симпатических и парасимпатических влияний на миокард состоят в снижении степени управляемости и надёжности регуляции сердца. Это приводит к падению темпа и величины мобилизации сократительной функции сердца, особенно в чрезвычайных условиях. |
