ихтиопаталогия. Дана характеристика рыб как переносчиков возбудителей болезней человека и животных. Для студентов вузов по специальности Водные биоресурсы и аквакультура
 Скачать 10.48 Mb. Скачать 10.48 Mb.
|
|
8.1.4. МИКРОСПОРИДИОЗЫ РЫБ Это ряд заболеваний рыб, вызываемых микроспоридиями — представителями типа Microspora. В настоящее время, учитывая их уникальное ультратонкое строение (у них отсутствуют митохондрии, лизосомы, жгутики и центриоли) и молекулярные характеристики, близкие к бактериям. Микроспоридии — облигатные внутриклеточные спорообра-зующие паразиты, имеющие одноклеточную организацию. Они самые мелкие из известных паразитов, размером в среднем 2—6 мкм. Микроспоридии имеют исключительно широкий круг хозяев, охватывающий животных от простейших до позвоночных, включая млекопитающих и человека. Многие из них являются возбудителями болезней сельскохозяйственных животных, в том числе рыб. Трофические стадии микроспоридий развиваются в тесном контакте с цитоплазмой клетки хозяина и имеют очень простое строение. Размножение паразитов внутри клеток хозяина происходит посредством множественного деления (мерогонии или шизогонии), во время которого образуются многоядерные плазмодии округлой или лентовидной формы (рис. 52). Уже на начальном этапе размножения часть плазмодиев переходит к стадии спорогонии, т. е. встает на путь образования спор, в то время как другая часть плазмодиев продолжает вегетативное развитие. Процесс спорогонии достаточно прост и представляет собой поэтапное деление многоядерного плазмодия (панспороб-ласта) на одноядерные клетки, споробласты. Споробласты — переходная форма, в процессе которой формируются все органоиды спор. Зрелые споры часто остаются объединенными вместе остатками оболочки панспоробласта. У разных микроспоридий количество спор, образующихся в одном панспоробласте, четко определенное (2, 4, 8, 16 и более), что используется в систематике микроспоридий. В результате в зараженной клетке по ее периферии располагаются вегетативные, непрерывно размножающиеся плазмодии, а в центре клетки накапливаются споры микроспоридий. Подобный процесс размножения может длиться месяцами и часто ведет к гипертрофии зараженных клеток, которые достигают иногда огромных размеров (до 3—5 мм) и в результате становятся видны невооруженным глазом. Такое разрастание одной клетки хозяина под воздействием паразита называется ксеномой. 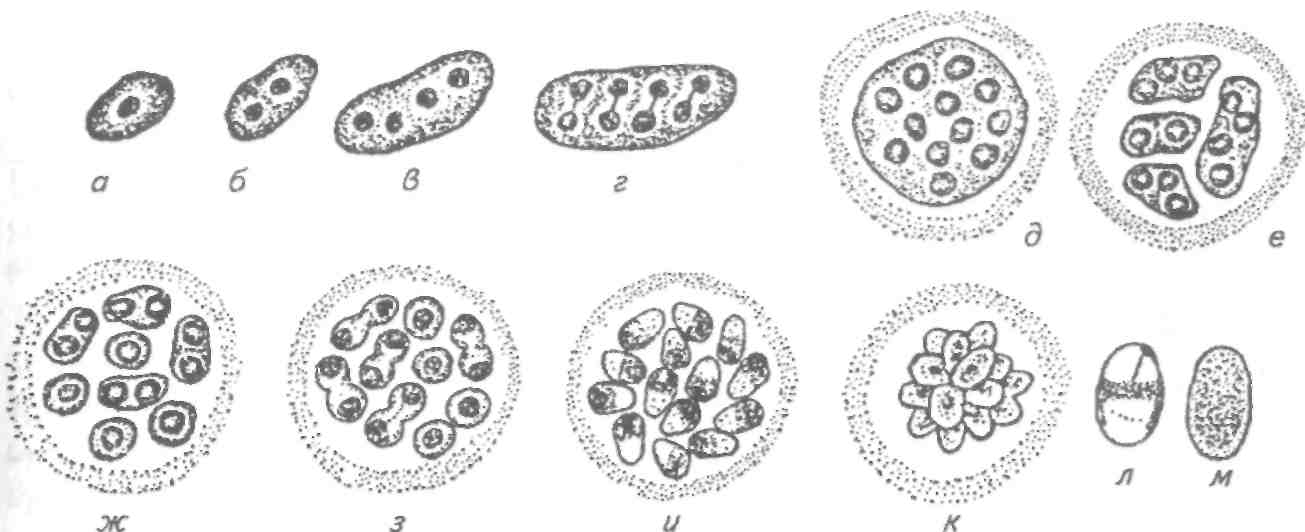 Рис. 52. Цикл развития микроспоридий рода Glugea (на примере G. anomala): а, б —молодые шизонты; в, з —поздние шизонты; д—спорогональный плазмодий; е, ж —деление спорогонального плазмодия; з—к—спорогония; л, м — споры Несмотря на чрезвычайно мелкие размеры, споры микроспоридий устроены крайне сложно и содержат уникальный аппарат для заражения клетки хозяина. Строение спор удалось установить только при использовании электронной микроскопии. Оболочка споры состоит из трех различных по строению и химическому составу слоев. В центральной части споры лежит один одно- или двухъядерный зародыш. Весь остальной объем споры занимает свойственный только микроспоридиям аппарат экструзии, состоящий из полярной трубки (ранее называвшейся стрекательной, или полярной, нитью), полярного якорного диска, поляропласта и задней вакуоли (рис. 53). Длина полярной трубки у микроспоридий рыб превышает длину споры в десятки раз, достигая 500 мкм. Она начинается от переднего полюса споры, где ее основание заключено в якорный диск, лежащий под оболочкой. От переднего Конца споры полярная трубка направляется назад, затем резко поворачивает к боковой стенке и ложится в задней трети многочисленными спиральными витками в 1—3 слоя под самой оболочкой. Всю переднюю треть или половину споры занимает поляропласт, Похожий на кипу плотно уложенных пластин и пронизанный в Центре полярной трубкой. На заднем полюсе споры расположена вакуоль, заполненная жидкостью. 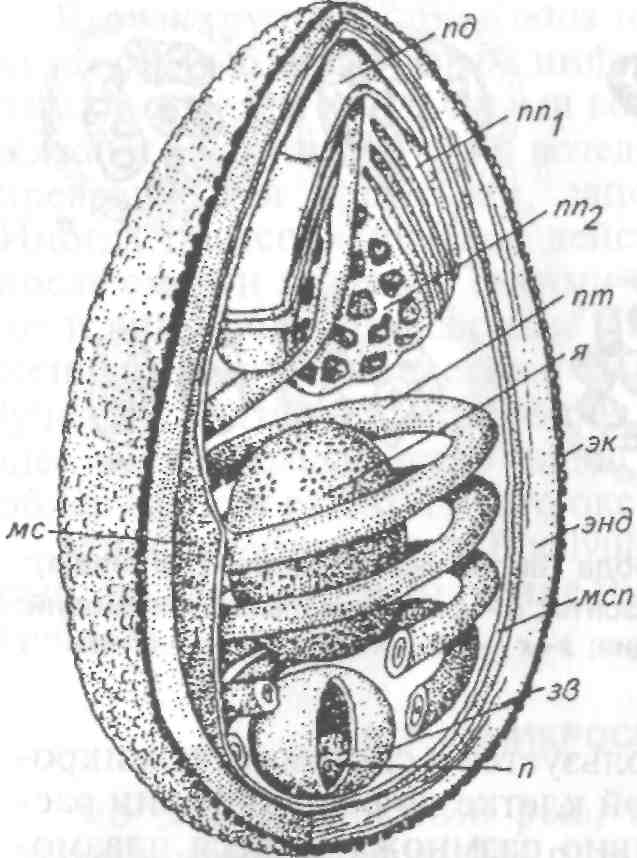 Рис. 53. Схема строения споры микроспоридий: пд — полярный диск; лп1— пластинчатый поляропласт; пп2— пузырчатый поляро-пласт; лг — полярная трубка; я — ядро; эк —экзоспора; энд— эндоспора; мел— мембрана спороплазмы; эв — задняя вакуоль; л — постеросома; мс — мембрана споронта Заражение хозяина происходит при заглатывании спор паразита. Под влиянием пищеварительных соков объем поляропла-ста сильно увеличивается путем быстрого отодвигания мембран каждой пластины друг от друга. В результате внутри споры создается высокое давление, приводящее к выворачиванию из нее полярной трубки и проталкиванию через ее канал зародыша паразита. Этот процесс длится доли секунды и похож на выстрел. Фактически споры играют роль живого шприца, инъецирующего зародыш паразита в клетку хозяина. После завершения процесса размножения и спорообразования в одном хозяине споры выводятся через кишечник или наружные покровы при жизни хозяина или после его смерти во внешнюю среду, где служат источником заражения новых хозяев. Для большинства изученных видов микроспоридий установлена узкая гостальная и тканевая специфичность. Круг хозяев паразита обычно ограничен одним видом, реже несколькими видами одного рода или семейства. Число микроспоридий, паразитирующих в пресноводных и морских рыбах, в настоящее время приближается к 100 видам, из которых около 25 зарегистрировано в России. Среди описанных видов только немногие представляют опасность для культивируемых рыб, однако с развитием как пресноводной, так и морской аквакультуры постоянно регистрируются новые виды микроспоридий, вызывающие массовые заболевания. Микроспоридиозы протекают либо в хронической форме с поражением отдельных клеток, либо в острой форме с инвазией многих клеток пораженного органа. Гибель от заболевания наблюдается чаще среди молоди рыб. Наиболее патогенны микроспоридии, поражающие кишечник или жабры. У рыб обычно паразитируют представители отряда Glugeida и входящих в него семейств Glugeidae и Pleistophoridae. Микроспоридиозы, вызываемые представителями рода Glugea В качестве возбудителей заболеваний известны Glugea anomala, G. hertwigi, G. luciopercae, G.stephani, G. bychowskii. Для микроспоридий этого рода характерно образование округлых белых ксе-ном, расположенных в строго определенных тканях и органах хозяина (рис. 54, а). При изготовлении мазков споры видов рода Glugea располагаются попарно или одиночно, реже группами, так как оболочка панспоробласта у представителей этого рода очень нестойкая. Споры удлиненно-овальной формы, с большой задней вакуолью, длиной несколько микронов (рис. 54, б). 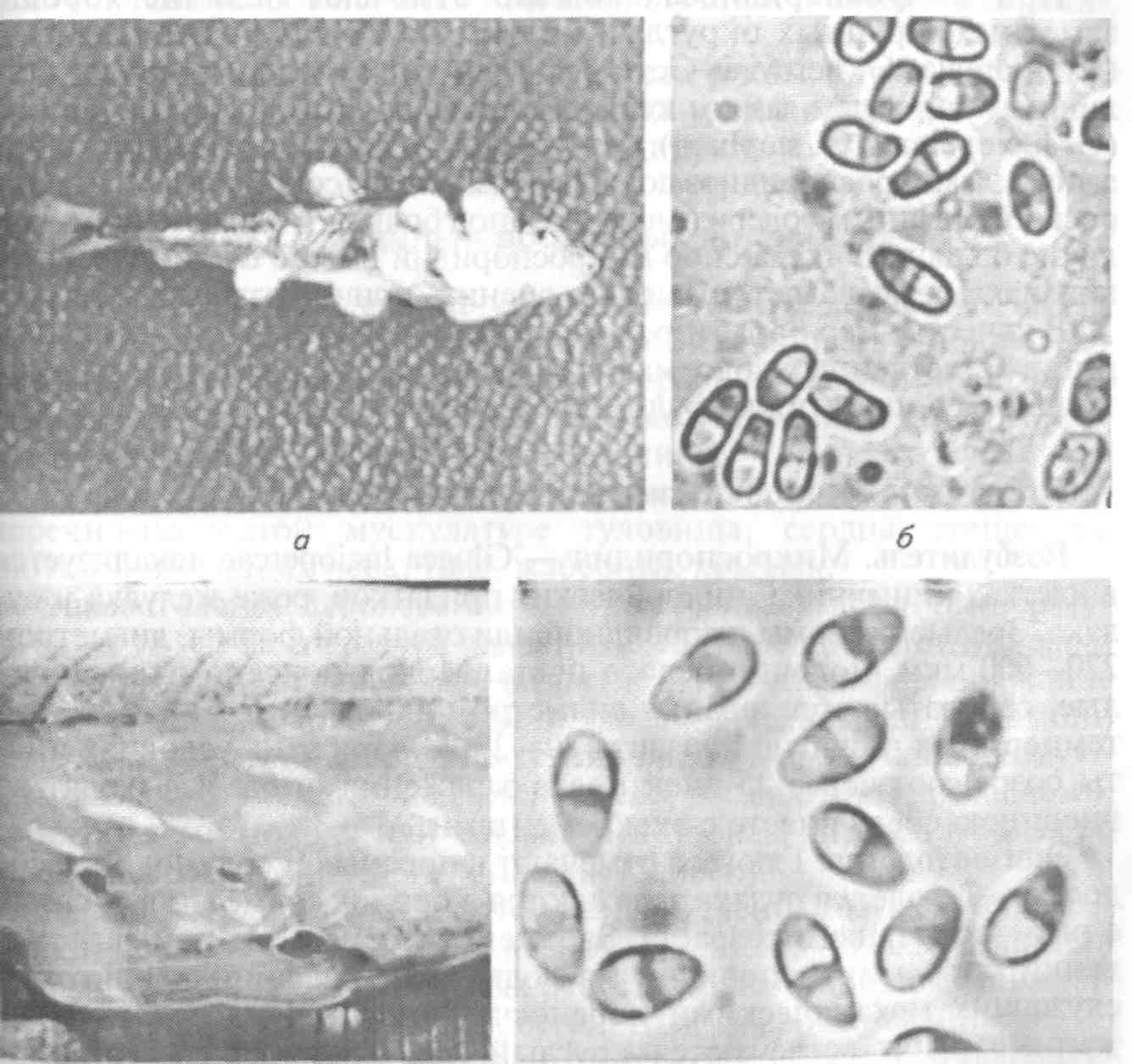 в Рис. 54. Различное поражение рыб микроспоридиями и споры паразитов: о — девятииглая колюшка, зараженная Glugea anomala (поверхностные ксеномы); б — Живые споры Glugea anomala; s - скелетная мускулатура корюшки, инвазированная Pleistophora ladogensis (зараженные волокна имеют вид белых веретеновидных цист); г — живые споры P. ladogensis Для всех видов характерна строгая специфичность. Микроспоридия G. hertwigi отмечена как паразит снетка и корюшки в разных водоемах России — от озер Северо-Запада до р. Амур. Многочисленные вспышки глюгеоза отмечены у корюшки в озерах Канады. Массовая зараженность и гибель рыб от этого паразита обычно следуют за резким подъемом численности в водоеме снетка или корюшки. Glugea stephani поражает кишечник многих камбаловых рыб, G. bychowskii — волжскую сельдь. Glugea luciopercae инвазирует клетки кишечника судака. Отмечены случаи заболевания и гибели рыб при искусственном разведении молоди камбал за рубежом и молоди судака в нашей стране. При микроспоридиозах обычно отмечают наличие хорошо заметных, крупных округлых ксеном на поверхности тела рыб (G. anomala, G. hertwigi, G. fennica) или более мелких, трудно различимых простым глазом ксеном в подслизистом слое кишечника (G. luciopercae, G. stephani). Во избежание ошибок постановка диагноза на микроспоридиоз должна обязательно сопровождаться микроскопированием содержимого цист под большим увеличением. Наличие большого числа спор микроспоридий вместе с клиническими признаками позволяет правильно оценить причину заболевания. В качестве мер борьбы рекомендуется массовый отлов больных рыб в естественных водоемах и тщательные карантинные и санитарные мероприятия в прудовых хозяйствах. Глюгеоз судака Возбудитель. Микроспоридия — Glugea luciopercae локализуется в клетках кишечника, пилорических придатков, реже желудка у судака. Зрелые ксеномы шаровидной или овальной формы, диаметром 220—600 мкм, молочно-белого цвета. Молодые ксеномы — округлые, сероватые образования диаметром 45—60 мкм. Оптимальная температура развития паразита 20—27 "С. При этих условиях цисты созревают через 25 дней после заражения рыбы и выходят во внешнюю среду вместе с экскрементами. Эпизоотология. Глюгеоз отмечают в пресных и солоноватых водоемах. Сеголетки судака заражаются в период совместного нагула с рыбами старшего возраста. Заражение происходит при заглатывании спор микроспоридий из воды, через дафний и олигохет, служащих механическими переносчиками спор паразита. Зараженные рыбы встречаются круглый год, но максимум инвазии приходится на сентябрь—октябрь. Клинические признаки и патогенез. Признаки заболевания проявляются только при высокой интенсивности инвазии: у сеголетков при 1000—1400 ксеном на рыбу, у двухлетков — при 70—500 ксеном на 1 см2 поверхности слизистой оболочки кишечника. Больная рыба плохо питается, становится истощенной, приобретает темную окраску. У нее нарушается координация движений. Гибель сеголетков наступает при уровне заражений 1400—2000 ксеном на рыбу. При вскрытии полости тела у сильно зараженных судаков отмечают отсутствие полостного жира. Стенки кишечника истощены и сквозь них просвечивают крупные ксеномы. При вскрытии кишечника слизистая оболочка кажется усыпанной манной крупой. В тяжелых случаях заболевания единичные ксеномы встречаются на поверхности печени, селезенки, в сердце, гонадах и мышцах. Диагноз. Его ставят на основании эпизоотических данных, клинических признаков заболевания и определения паразита до вида. Меры борьбы. Водоем, в котором обнаружили заболевание судака глюгеозом, объявляется неблагополучным и вводятся ограничения. В рыбоводных хозяйствах для нереста рекомендуют использовать судака старше 5 лет. После выпуска молоди судака ложе прудов максимально осушают и дезинфицируют. Глюгеоз дальневосточных лососевых Возбудитель. Заболевание у дальневосточных лососевых вызывается Glugea (=Microsporidium) toKedai. Он описан у молоди радужной форели, симы, кеты, нерки, горбуши, чавычи, кунджи на рыбозаводах и в озерах Японии, а также у производителей горбуши и симы в реках южной части Сахалина. Развитие и спорообразование микроспоридий происходят в поперечно-полосатой мускулатуре туловища, сердца, пищевода, глотки и в мышцах неба, глаз, жаберных крышек. Эпизоотология. Заболевание быстро развивается при температуре воды 15 °С. Температура воды ниже 15 °С не препятствует заражению рыбы, но сдерживает развитие паразита и формирование ксеном. Максимум зараженности (до 5000 ксеном на 1 г мышц) отмечают в августе—середине сентября. Фактором, способствующем развитию болезни, является стресс, вызванный пересадками, сортировками молоди или задержками производителей в реках во время хода у заградительных плотин (забоек). Клинические признаки и патогенез. Пораженная мускулатура содержит белые веретеноввдные ксеномы длиной 3—6 мкм, шириной 2—3 мкм. У сильно пораженных особей сердце становится анемичным, увеличенным в размерах, бугристым, деформированным. Меры борьбы. Хозяйство, где отмечено заболевание, объявляется неблагополучным. Медикаментозных средств борьбы не разработано. Рекомендуется при передержке производителей лососевых Рыб поддерживать температуру воды не выше 15 °С. Следует проводить тщательную дезинфекцию садков и бассейнов, в которых выдерживали производителей, хлорной известью или едким натром. Микроспоридиозы, вызываемые представителями рода Pleistophora Для микроспоридий этого рода характерно, что споры, если их 16 и более, после созревания остаются окружены прочной оболочкой панспоробласта. В результате на мазках помимо одиночных спор наблюдаются и многоспоровые округлые образования. Заболевание у рыб чаще протекает без образования опухолей с поражением мышечной ткани или икринок. Мышечный плейстофороз описан у различных морских и пресноводных рыб. Заболевание, вызываемое Pleistophora hyphessobryconis, часто встречается у неоновых и некоторых других аквариумных рыб и всегда заканчивается летально. В озерах Северо-Запада у налима и корюшки в мышцах паразитирует другой представитель этого рода P. ladogensis (рис. 54, в, г). Большое число микроспоридий этого рода поражает икринки разных видов пресноводных рыб. Пораженные икринки становятся белыми и хорошо выделяются на фоне здоровых. В мазках, приготовленных из зараженных икринок, присутствует большое число панспоробластов с вариабельным числом спор грушевидной или овальной формы. В большинстве случаев патогенное воздействие микроспоридий незначительно, так как количество зараженных икринок обычно не превышает нескольких процентов. К хорошо известным видам относится Pleistophora sulci (=Cocconema sulci), паразитирующая в икре разных видов осетровых. Паразит встречается везде, где обитают эти рыбы. Характерным признаком вида является наличие крайне мелких сферических спор диаметром 2,5 мкм, заключенных в округлые панспороб-ласты размером до 25 мкм. Меры борьбы. Не разработаны. 8.1.5 БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ РЕСНИЧНЫМИ (ТИП CILIOPHORA) Большое место в ихтиопатологии занимают болезни, вызываемые ресничными простейшими тип Ciliophora. Представители этого типа — наиболее сложно устроенная группа простейших. Органами движения служат многочисленные подвижные реснички, покрывающие поверхность тела целиком или частично. Уплотненный поверхностный слой эктоплазмы образует пелликулу, не позволяющую менять форму тела. У подавляющего большинства инфузорий имеется постоянное ротовое отверстие — цитостом, которое часто лежит в углублении — перистоме. Бесполое размножение совершается делением на 2 или путем множественного деления в цисте и чередуется с конъюгацией. Хилодонеллез Среди заболеваний рыб, возбудителями которых являются инфузории, особо важное значение имеет хилодонеллез. Он вызывает нередко значительный отход сеголетков карпа в зимовальных прудах центрального, западного и северо-западного районов страны, а также Сибири, т.е. тех районов, где период зимовки продолжается 6—7 мес. Возбудители. ChilodoneUa piscicola (=Chilodonella cyprini), Ch. he-xasticha (рис. 55) относятся к ресничным инфузориям сем. СЫ-lodonellidae, отр. Cyrtophorida . Тело хилодонелл сплющено в дор-зовентральном направлении, округлое (Ch. hexasticha) или сердцевидное (Ch. piscicola). Ch. piscicola достигает длины 45—70 мкм, ширины 38—57 мкм, Ch. hexastichus — длины 32—86, ширины 26— 66 мкм. Тело покрыто продольными рядами ресничек и имеет на брюшной стороне ближе к переднему концу округлый цитостом. Цитостом ведет в длинный канал — глотку, стенки которой снаб жены поддерживающим палочковым аппаратом, состоящим из 16—20 палочек, хорошо видимых как на нативных, так и на окрашенных препаратах. Паразит ползает по телу рыбы и питается за счет клеток эпителия, в которые вонзает палочковый аппарат, способный выворачиваться через ротовое отверстие. 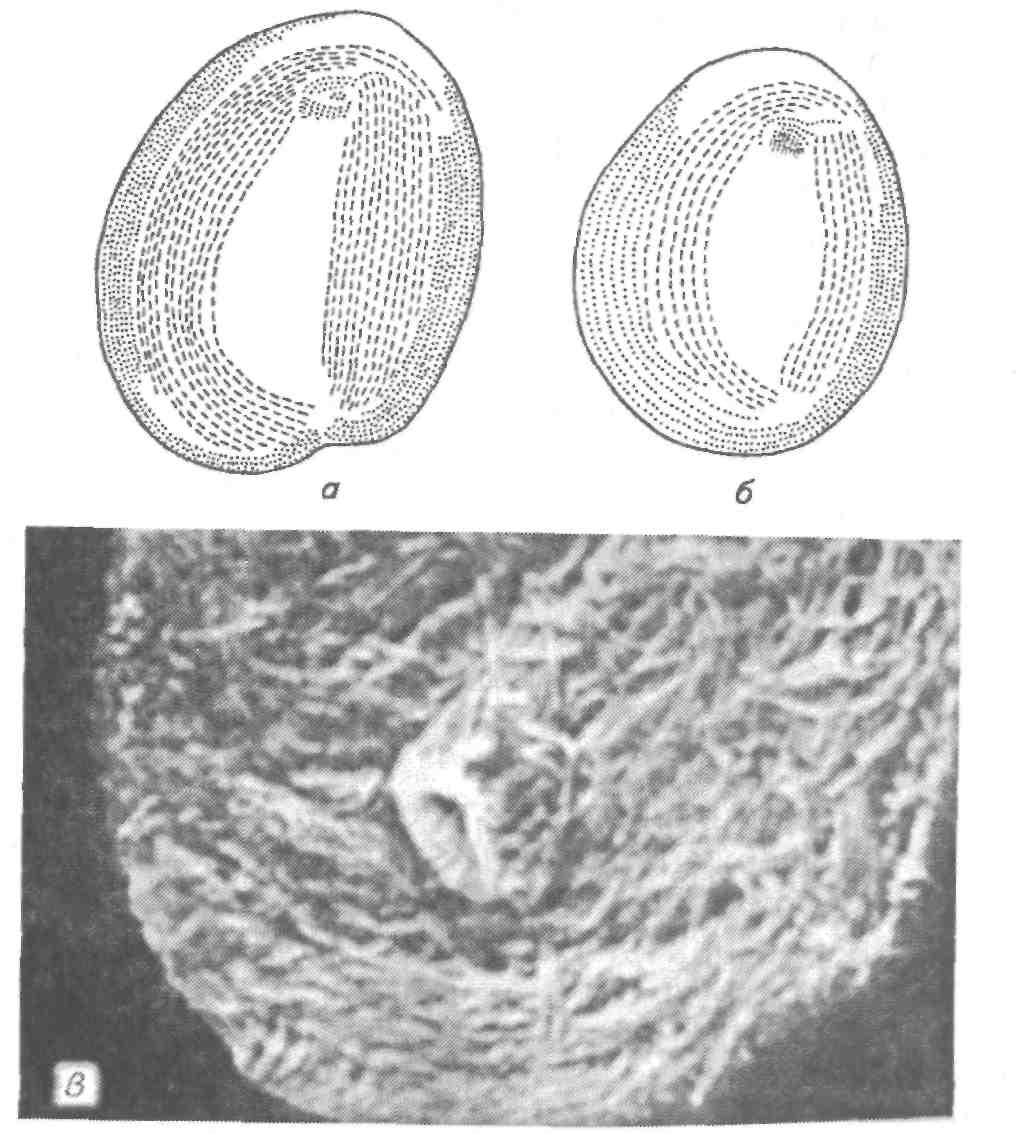 Рис. 55. Возбудители хилодонеллеза: а — ChilodoneUa piscicola; б —Ch. hexastichus; в — Ch. piscicola, электронная сканирующая микрофотография (х 20 000) к. Внутри тела паразита различают яйцевидное ядро (макронуклеус), ядрышко (микронуклеус) и 2 сократительные вакуоли. Размножение хилодонеллы происходит делением пополам в поперечном направлении. Половой процесс у хилодонеллы не прослежен, хотя ряд ученых отмечает, что у паразита наблюдается конъюгация. При неблагоприятных условиях паразит может образовывать цисты покоя. Образовавшиеся цисты сохраняются в течение довольно длительного времени на дне водоема или в толще воды, пока для паразита снова не создадутся благоприятные условия. Установлено, что свет лимитирует размножение хилодонеллы. Эпизоотология. Возбудитель заболевания встречается у очень многих пресноводных рыб, как у молоди, так и у взрослых, во все сезоны года. Однако заболевание чаще отмечается у ослабленной по каким-либо причинами рыбе. Наиболее часто оно встречается зимой и ближе к весне у ослабленной в результате неблагоприятных условий зимовки рыбы. Подвержены заболеванию карп и растительноядные рыбы. Форель и молодь лососевых болеют в меньшей степени, причем чаще летом в неблагоприятный для этих холодноводных рыб сезон. Решающее влияние на численность хилодонеллы оказывает физиологическое состояние и в первую очередь упитанность рыбы. Установлено, что особенно сильно бывают заражены рыбы, плохо или совсем не питающиеся зимой и отличающиеся низкой упитанностью. В результате голодания наступает отмирание клеток кожного эпителия, которые и являются наиболее благоприятным субстратом для паразитов. Большое значение в эпизоотологии хилодонеллеза имеет количество заразного начала в пруду. Хилодонеллез обычно сначала возникает на плохо упитанных сеголетках, в дальнейшем увеличение заразного начала приводит к заражению и хорошо упитанных рыб, что может вызвать и их гибель. На ход заболевания влияет и породный состав карпа. Хилодо-неллезу более подвержен галицийский карп, чем амурский сазан и его гибриды с карпом. Объясняется это тем, что амурский сазан и его гибриды с карпом продолжают осенью питаться при снижении температуры воды, тогда как чистокровный галицийский карп уже перестает брать корм. Корма, потребляемые при низкой температуре, расходуются на создание запасов питательных веществ, а не на рост, поэтому сеголетки амурского сазана и его гибридные формы вступают в зимовку более подготовленными, чем карп. В зимовальный пруд заразное начало может быть занесено с зимующим рыбопосадочным материалом или с водой из источника водоснабжения. Цисты паразита могут также остаться во влажном иле или на ложе пруда с предшествующей зимовки. Клинические признаки и патогенез. При тяжелой форме хилодо-неллеза на поверхности тела рыбы появляется голубовато-серый налет. Особенно хорошо такой налет выражен на поверхности головы. Его появление связано с раздражением кожи, вызываемым большим количеством хилодонелл, что сопровождается усиленным слизеотделением. При просмотре под микроскопом соскоба с тела рыбы уже при малом увеличении можно заметить десятки паразитов. При такой степени заражения рыба ведет себя беспокойно, поднимается к поверхности, слабеет, легко ловится сачком и даже руками. После таяния льда, когда с весенним повышением температуры хилодонеллез переходит в критическую стадию, годовики выскакивают из воды и плашмя падают обратно в воду. Этот симптом, очень характерный для хилодонеллеза, следует объяснить нарушением кожного дыхания, которое у молоди рыб играет значительную роль в общем дыхательном процессе. Патогенное воздействие паразита проявляется в нарушении дыхательных функций поверхности тела и жабр, вследствие сильного повреждения их возбудителем заболевания. Диагноз. Его ставят на основании клинических признаков и при обнаружении большого числа инфузорий в соскобе с поверхности тела и жабр. Меры борьбы. Важным способом предупреждения массового заболевания хилодонеллезом в карповых зимовальных прудах является переход на выращивание зимостойких форм, каковыми являются гибриды карпа с амурским сазаном. Такой переход, осуществленный во всех хозяйствах северо-западной зоны карповодства, а также некоторых других зон, резко снизил опасность вспышек хилодонеллеза и способствовал увеличению выхода годовиков после зимовки. Не менее важным мероприятием является создание благоприятных условий, стимулирующих рост и развитие рыбы, так как хорошая упитанность повышает сопротивляемость к заболеванию. Для этого в первую очередь надо обеспечить рыбу полноценными кормами. Для предотвращения заноса инвазионного начала рыбу следует перед зимовкой провести через антипаразитарные ванны (5%-ные солевые в течение 5 мин) и обработать в зимовальных прудах органическими красителями. В зависимости от вида рыбы и ее физиологического состояния могут быть и другие способы ее обработки. Для уничтожения цист паразита ложе пруда после проведения зимовки следует обрабатывать негашеной или хлорной известью. Для предотвращения попадания инвазионного начала из источника водоснабжения необходимо следить, чтобы в головных прудах не было сорной рыбы. Кроме того, на водоподающих каналах следует устанавливать фильтры, предотвращающие попадание рыбы и паразитов в зимовальные пруды. При вспышке хилодонеллеза во время подращивания мальков форели в желобах и бассейнах рекомендуется проводить мальков через лечебные ванны. Учитывая, что молодь лососевых не выдерживает 5%-ный раствор поваренной соли, лучше применять 0,005%-ный раствор марганцовокислого (перманганата) калия или 2%-ный раствор поваренной соли в течение 10—15 мин. Эффективны также обработки растворами формалина и малахитового зеленого. После освобождения от молоди желобов и бассейнов последние необходимо продезинфицировать с помощью концентрированного раствора поваренной соли или другого дезинфектан-та, а затем просушить на солнце. |
